NEJM:TL1A单抗tulisokibart治疗中重度溃疡性结肠炎初获成功
时间:2024-09-27 13:00:23 热度:37.1℃ 作者:网络
溃疡性结肠炎是一种慢性炎症性胃肠道疾病,症状包括腹部痉挛、腹泻和直肠出血。溃疡性结肠炎是炎症性肠病的一种,主要影响结肠和直肠。它的特点是肠道黏膜的炎症,通常始于直肠,并可能向上扩展至整个结肠。UC的发病机制尚不完全清楚,可能与遗传易感性、环境因素和免疫系统的异常反应有关。
中度至重度活动性溃疡性结肠炎的治疗包括生物疗法和小分子疗法,如TNF抑制剂,英夫利昔单抗(Infliximab),阿达木单抗(Adalimumab),和戈利木单抗(Golimumab)、抗整合素类药物维多珠单抗(Vedolizumab)、抗IL-12/IL-23单克隆抗体乌司奴单抗(Ustekinumab),以及JAK抑制剂托法替尼(Tofacitinib)等。然而,在常规疗法未产生足够反应的患者中,这些药物的临床缓解率整体仍然不高,需要更新的治疗药物。
多项研究表明人类肿瘤坏死因子样细胞因子 1A (TL1A) 与炎症性肠病的发病机制有关。 TL1A 主要在正常生理条件下由内皮细胞表达,在炎症期间由免疫细胞以高浓度表达。TL1A 及其受体(死亡结构域受体 3 [DR3])在发炎的肠道组织中显著上调。9,10 鼠 TL1A 抗体可有效治疗动物模型中的活动性结肠炎。编码 TL1A 的基因 TNFSF15 和编码 DR3 的基因 TNFRSF25 均已被证实为不同人群的炎症性肠病易感基因。
Tulisokibart(以前称为 PRA023)是一种人源化 IgG1 kappa 单克隆抗体,可与膜结合和可溶形式的 TL1A 结合,具有高亲和力和特异性。 Tulisokibart 可阻止 TL1A 和 DR3 的相互作用,从而抑制 1 型和 17 型辅助 T 细胞反应、增加调节性 T 细胞活性并降低促纤维化途径。10,16 我们进行了 ARTEMIS-UC 试验,以评估 tulisokibart 对中度至重度活动性溃疡性结肠炎患者的疗效和安全性。
方法
研究者随机分配了对糖皮质激素有依赖性或对溃疡性结肠炎的常规或高级疗法无效的患者,让他们接受静脉注射 Tulisokibart(第 1 天 1000 毫克,第 2、6 和 10 周 500 毫克)或安慰剂。队列 1 包括患者,无论其反应可能性测试的状态如何。队列 2 仅包括反应可能性测试呈阳性的患者。主要分析是在队列 1 中进行的;主要终点是第 12 周的临床缓解。在预先指定的分析中,将队列 1 和 2 中反应可能性测试呈阳性的患者合并在一起。
符合条件的患者被纳入队列 1,无论他们在基因诊断测试中的状态如何,该测试旨在识别对抗 TL1A 抗体产生应答可能性较高的患者(详情见补充附录)。队列 2 的纳入仅限于应答可能性测试呈阳性的患者。在预先指定的分析中,将队列 1 和 2 中应答可能性测试呈阳性的患者合并在一起,以评估 tulisokibart 在这一亚群中的疗效。经过不超过 5 周的筛选期后,符合条件的患者以 1:1 的比例随机分配接受静脉注射 tulisokibart,剂量为第 1 天 1,000 mg,然后在第 2、6 和 10 周 500 mg,或在相同时间点接受安慰剂治疗(补充附录图 S1)。使用基于网络的中央系统对患者进行随机分配,分配至 tulisokibart 或安慰剂组,并根据反应可能性测试(仅限队列 1)和之前是否接受过高级疗法(是或否)进行分层。Tulisokibart 或安慰剂给药时间为 30 分钟。
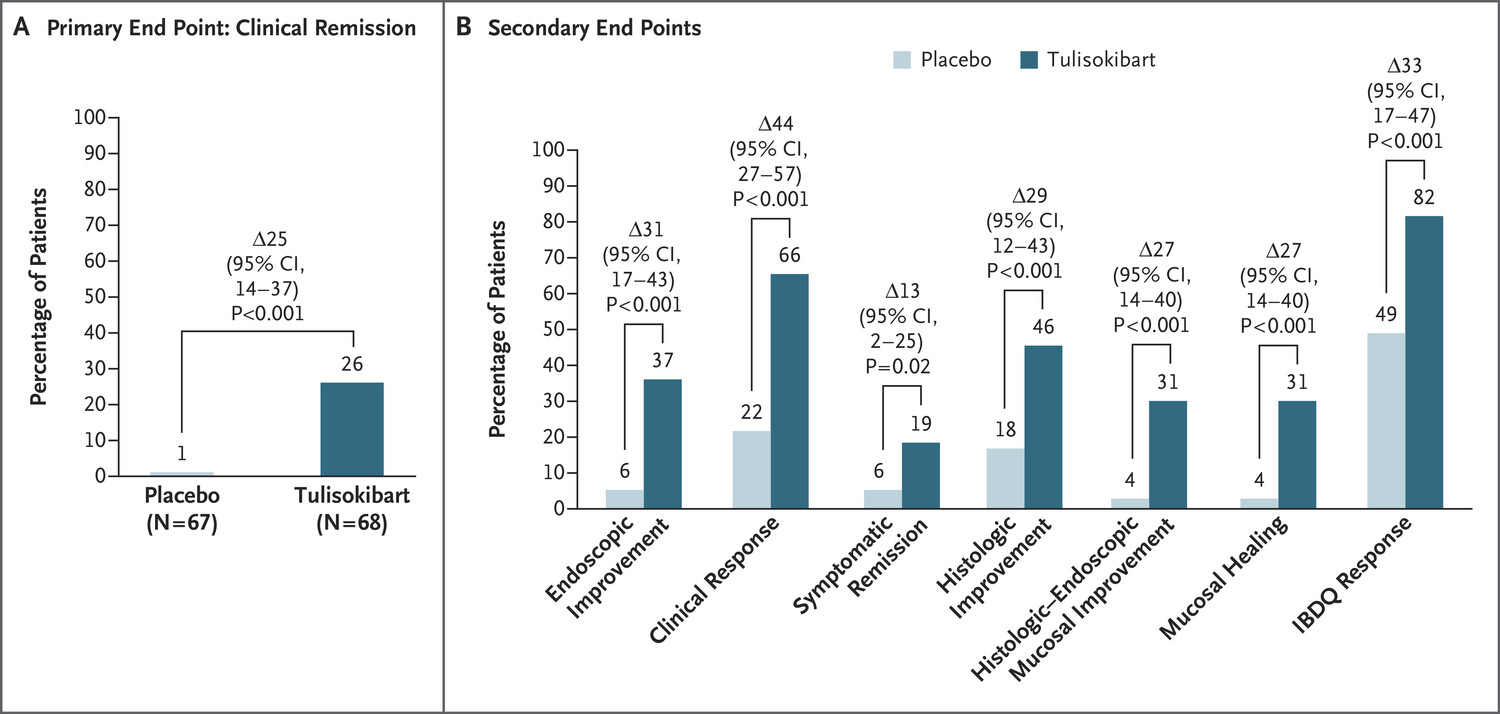
主要疗效终点是队列 1 的第 12 周临床缓解情况。临床缓解定义为改良 Mayo 内镜子评分为 0 或 1、直肠出血子评分为 0、大便频率子评分为 0 或 1 且不高于基线值。
结果
在队列 1 中,共有 135 名患者接受了随机分组。第 12 周,第 1 组中接受 tulisokibart 治疗的患者临床缓解率显著高于接受安慰剂治疗的患者(26% vs. 1%;差异,25 个百分点;95% 置信区间 [CI],14 至 37;P<0.001)(图 1A)。与安慰剂相比,第 1 组中所有排名靠前的次要终点均观察到 tulisokibart 具有显著优势。具体而言,tulisokibart 组中内窥镜检查改善(37% vs. 6%;差异,31 个百分点;95% CI,17 至 43;P<0.001)和临床反应(66% vs. 22%;差异,44 个百分点;95% CI,27 至 57;P<0.001)的患者多于安慰剂组。与安慰剂相比,tulisokibart 在症状缓解、组织学改善、组织学内镜粘膜改善、粘膜愈合和 IBDQ 反应方面的治疗差异分别为 13 个百分点(95% CI,2 至 25;P=0.02)、29 个百分点(95% CI,12 至 43;P<0.001)、27 个百分点(95% CI,14 至 40;P<0.001)、27 个百分点(95% CI,14 至 40;P<0.001)和 33 个百分点(95% CI,17 至 47;P<0.001)(图 1B)。
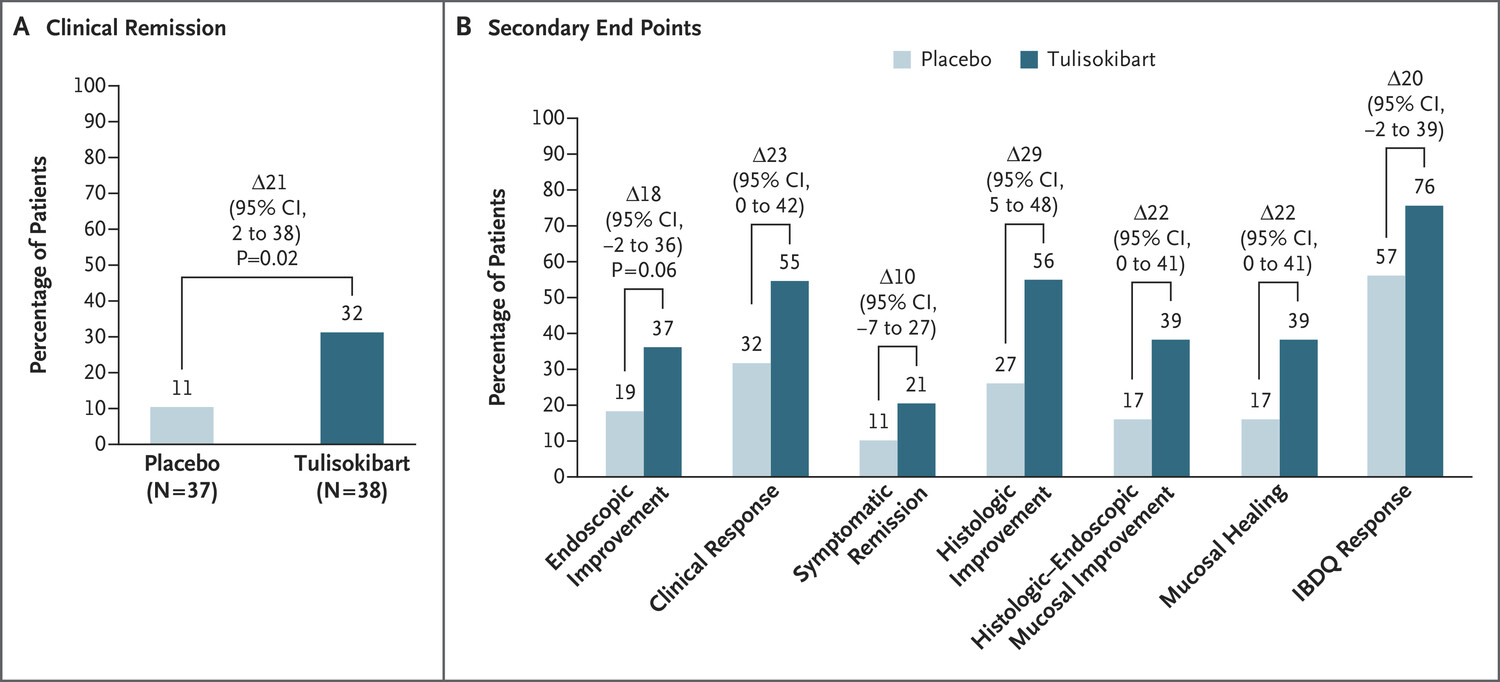
在队列 2 中,共有 43 名患者接受了随机分组。两个队列中共有 75 名反应可能性测试呈阳性的患者接受了随机分组。在反应可能性测试呈阳性的患者中(队列 1 和 2 合并),接受 tulisokibart 治疗的患者临床缓解率高于接受安慰剂治疗的患者(32% vs. 11%;差异,21 个百分点;95% CI,2 至 38;P=0.02)。在所有入组患者中,tulisokibart 组和安慰剂组的不良事件发生率相似;大多数不良事件的严重程度为轻度至中度。
结论
在这项短期试验中,tulisokibart 在诱导中度至重度活动性溃疡性结肠炎患者的临床缓解方面比安慰剂更有效。
从这项研究来看,虽然观察时间很短,仅12周,这也表明tulisokibart见效十分迅速,同时缓解也极为显著,临床缓解率达到32%。可以说与目前现有的药物形成互补,为UC的治疗提供全新的可能性。
原始出处:
Phase 2 Trial of Anti-TL1A Monoclonal Antibody Tulisokibart for Ulcerative Colitis,N Engl J Med 2024;391:1119-1129 DOI: 10.1056/NEJMoa2314076 https://www.nejm.org/doi/full/10.1056/NEJMoa2314076

