恶性胰岛素瘤多发肝转移一例
时间:2024-09-22 06:00:38 热度:37.1℃ 作者:网络
1 病例资料
患者男性,70岁,因“发作性意识障碍4个月余”于2022年8月收住北京协和医院内分泌科。
患者于4个月前某日午餐4 h 后突发意识障碍,伴大汗、走路不稳。遂就诊于当地医院,指测血糖2.2 mmol/L,予静脉推注葡萄糖,20 min 后症状缓解。此后患者多次于餐后3~4 h出现意识模糊、手足舞动、对答不切题,发作时指测血糖均低于2.8 mmol/L,静推或口服葡萄糖后意识可恢复。2022年7月于当地医院查空腹静脉血糖为3.8 mmol/L,胰岛素为28.0 μIU/mL;动态血糖监测提示空腹、餐后2~3 h、夜间22:00~24:00时血糖多次低于检测下限;甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原199(CA199)、前列腺特异性抗原(PSA)等肿瘤标志物均为(-)。腹部增强CT示:胰腺大小形态及密度正常,肝内可见多发结节状低密度影,最大约2.1 cm×2.1 cm。增强MRI示:肝脏多发占位性病变,考虑转移瘤可能性大。
入院查体:血压 131/86 mm Hg(1 mm Hg=0.133 kPa),脉搏86次/min,体质量指数 29.17 kg/m2,体型均匀肥胖,神志清,对答流畅,未见黑棘皮征,双肺呼吸音清,心律齐,腹软,双下肢无水肿。患者否认含巯基类药物、胰岛素及磺脲类药物使用史;个人史、既往史无特殊;具有肺癌家族史。
患者为老年男性,慢性病程,主要表现为发作性意识障碍,发作时静脉血糖低于2.8 mmol/L,进食后症状缓解,符合Whipple三联征的典型表现[1],因此低血糖症定性诊断明确。当血糖低于3 mmol/L时,同步胰岛素水平超过3 μIU/mL,符合胰岛素依赖性低血糖症。
患者否认胰岛素使用史,因此不考虑外源性胰岛素所致低血糖。内源性高胰岛素性低血糖症的病因涵盖广泛,包括胰岛素瘤、非胰岛素瘤性胰源性低血糖综合征、Roux-en-Y胃旁路术后胰岛细胞增生症、先天性高胰岛素血症、胰岛素自身免疫综合征、反应性低血糖及胰岛素促泌剂的使用等。结合外院影像学检查结果,首先考虑胰岛素瘤。
患者入院后,密切监测其血糖水平,并在血糖低于2.8 mmol/L时留取同步C肽、胰岛素、胰岛素原以及尿常规样本,以进一步证实内源性高胰岛素性低血糖症的诊断。鉴于外院腹部增强CT未显示胰腺异常,需完善胰腺增强灌注CT、奥曲肽显像以进一步定位病灶,必要时还需完善68Ga-NOTA-Exendin-4 PET/CT以及超声内镜等检查以明确定位诊断。
目前,影像学检查在区分良恶性胰岛素瘤方面效果显著,如胰腺灌注CT、3T MRI、Exendin4-PET/CT等技术的诊断灵敏度和特异度均超过90%,其中胰腺灌注CT在诊断胰岛素瘤方面的灵敏度和特异度均高达94.6%[2-3]。结合多种影像学检查有助于提高定位诊断的准确性。
此外,患者存在肝脏多发占位,已进行肿瘤标志物筛查,需进一步行病理检查以明确占位性质。考虑到胰岛素瘤可能是多发性内分泌腺瘤病的组分之一,入院后可完善甲状旁腺激素、游离钙、血钙、血磷、24 h尿钙、垂体前叶功能、胃泌素、胰高血糖素、降钙素等筛查。
患者入院后,完善低血糖症定性及定位诊断相关检查。当两次测得静脉血糖低于2.8 mmol/L时,同步检测显示胰岛素≥ 3 μIU/mL,C肽≥0.6 ng/mL(详见表1),这一结果支持内源性高胰岛素血症引起的低血糖症。同时,胰岛素自身抗体(IAA)(-),抗核抗体(ANA)(+) 1:80。
表1 低血糖症定性诊断相关指标
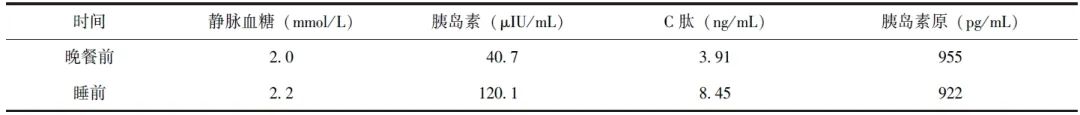
此外,AFP、CEA、CA199、CA242、A72-4等肿瘤标志物均在正常范围。胰腺增强CT+灌注显示,胰头钩突处存在一稍高强化占位(约1.6 cm×1.7 cm,图1A),考虑神经内分泌肿瘤可能;肝内多发动脉期稍高强化结节(较大者长径约1.5 cm,图1B),肝S8段多发稍低强化结节(较大者长径约1.3 cm),转移灶可能。
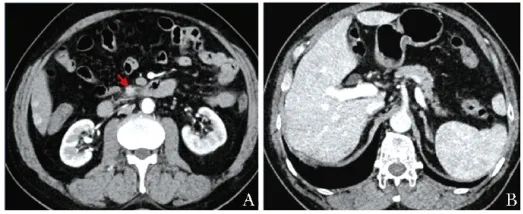
图1 恶性胰岛素瘤定位诊断
A.胰腺增强CT+灌注(肝脏动脉期),可见胰头部稍高强化占位(约1.6 cm ×1.7 cm);B.肝内多发稍高强化结节,较大者长径约1.5 cm;
奥曲肽显像结果显示:胰头钩突局部放射性摄取轻度增高,范围约为2.4 cm×1.7 cm,肝内多发稍低密度结节,放射性摄取高于周围肝实质,最大者约为1.7 cm×1.7 cm,生长抑素受体高表达,考虑胰头钩突神经内分泌肿瘤伴多发肝转移可能。68Ga-NOTA-Exendin-4 PET/CT扫描显示,胰头钩突部可见放射性摄取增高灶(1.3 cm×1.4 cm),其最大标准摄取值 (SUVmax) 为4.7(图1C);肝内可见多发放射性摄取增高灶,其中较大者长径约1.3 cm,SUVmax为3.3(图1D)。
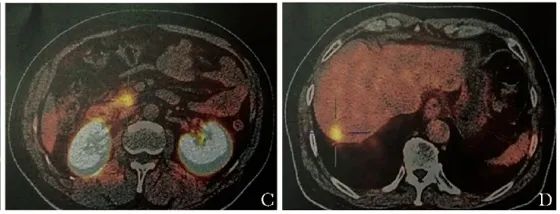
图1 恶性胰岛素瘤定位诊断
C.68Ga-NOTA-Exendin-4 PET/CT示胰头钩突局部放射性摄取轻度增高;D.肝内可见多发放射性摄取增高灶
腹部超声提示:肝内多发实性占位,肝多发囊肿,胆囊泥沙样结石可能,胆总管增宽。在多发性内分泌腺瘤病筛查方面,患者的垂体前叶功能、血钙、血磷、甲状旁腺激素以及垂体常规MRI等检查结果均未见明显异常。
经内分泌全科大查房后,请基本外科、肝脏外科、放射科、肿瘤内科和消化内科等多学科会诊,患者“低血糖症、恶性胰岛素瘤肝内多发转移”诊断明确。鉴于当前病情,多学科团队建议先行肝内动脉栓塞,并联合依维莫司治疗。待病灶有所缩小、血糖水平稳定后,再评估是否行胰腺原发肿瘤手术。随后,患者开始接受奥曲肽治疗,0.1 mg皮下注射,每8小时1次,并规律加餐生玉米淀粉。
经上述治疗,患者的低血糖症状得到明显改善。随后由放射科行经肝动脉造影、碘油栓塞术,以及CT引导下经皮肝穿刺活检。肝活检病理结果显示为神经内分泌肿瘤(胰岛素瘤),倾向于G2期(图2A)。免疫组化分析显示(图2B、2C):Insulin(+),CgA(+),Gastrin(-),Glucagon(-),Ki-67(index3%),Somatostatin(-),Syn(+),P53(野生型),ATRX(部分+),SSTR2(+),MGMT(-)。
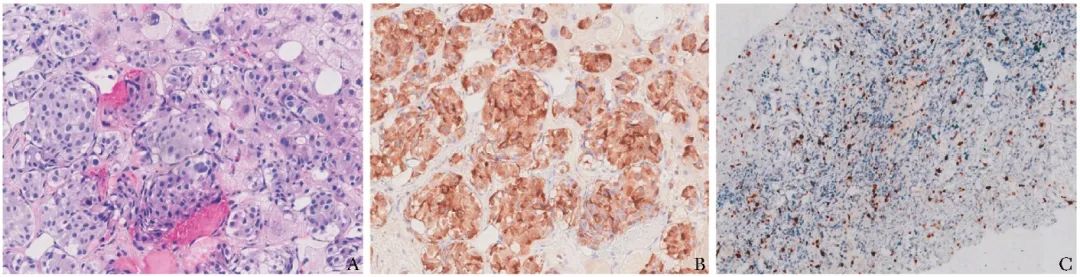
图2 肝穿刺活检组织病理切片染色
A.HE染色(×80),符合神经内分泌肿瘤,细胞形态单一,呈巢状分布,周围血管丰富;B.Insulin染色(×80);C.Ki-67免疫组化染色(×20)
随后复查肝功能无明显异常,患者开始口服依维莫司,每日1次,每次5 mg。经过上述综合治疗,患者的血糖水平稳定在3.0~6.8 mmol/L之间。此后半年,患者接受了2次肝转移瘤栓塞和射频消融术。后复查胸腹CT示:胰头钩突高强化结节灶;肝内多发稍低密度结节,部分较前缩小;部分原高强化灶转为无明显强化,部分较前变化不大。目前患者接受规律随访,整体状况良好,继续口服依维莫司,夜间基本无需加餐,监测血糖均在正常范围。
该例患者恶性胰岛素瘤合并肝转移(T1N0M1a,Ⅳ期,G2级)诊断明确。胰岛素瘤作为功能性胰腺神经内分泌肿瘤中最常见的类型[4-5],通常体积较小,且多数位于胰腺体尾部。尽管90%的胰岛素瘤为良性,但一旦出现转移,即可被判定为恶性,其中以肝转移最常见[6]。恶性胰岛素瘤与良性相比,其肿瘤体积往往更大,并伴随远处转移灶。由于产生胰岛素更多,恶性胰岛素瘤导致的低血糖症状更为严重、持续时间也更长。
胰岛素和胰岛素原水平也可用作良恶性胰岛素瘤的鉴别指标[7]。一项纳入121例成人恶性胰岛素瘤的研究发现,患者的平均诊断年龄为56.0岁,男女比例约为3:4,平均肿瘤大小为3.0 cm,原发肿瘤直径中位数为1.8 cm(0.7~13.5 cm)。其中胰体/胰尾的恶性胰岛素瘤占比为46.3%,而胰头部仅占18.2%。肿瘤侵犯范围多样,包括局限于胰腺内(39.7%)、发生远处转移(38.8%)以及侵犯周围器官组织或区域淋巴结(15.7%)。患者的中位总生存期为143个月,其中5年和10年总生存率分别为58% 和55%。影响患者预后不良的因素主要包括无法接受手术治疗及存在远处转移等[8-9]。
恶性胰岛素瘤的综合治疗因其复杂性和挑战性,需多学科团队协作以改善患者的长期预后。对于恶性胰岛素瘤,手术切除通常为首选治疗方式,但对于合并肝转移的患者,必须全面评估原发灶和肝转移灶手术切除的可能性。欧洲内分泌肿瘤协会将胰腺神经内分泌肿瘤肝转移分为3型[10]:Ⅰ型为单一肝转移,可行标准手术切除,占比约20%~25%;Ⅱ型为复杂型,即分布于两侧肝脏、伴有小卫星灶的孤立转移块,尽管具有挑战性,仍可考虑外科处理,占比约10%~15%;Ⅲ型为弥漫型,即两叶弥散分布转移瘤,无法手术干预,占比高达60%~70%。
肝转移负荷对药物疗效具有直接影响。一项关于生长抑素类似物抗肿瘤生长的临床研究显示[11],肝转移负荷>25%与≤25%的患者相比,中位生存时间明显缩短(24.1个月比50.8个月)。对于合并Ⅲ型肝转移瘤的患者,局部治疗是一个值得考虑的选项,主要包括经动脉途径治疗和消融治疗[12-13]。经动脉途径治疗包括肝动脉栓塞、肝动脉化疗栓塞和肝动脉放射性微球栓塞[14];而消融治疗则包括射频消融和微波消融。鉴于本例患者年龄较大,且肝转移灶为Ⅲ型,目前无法进行手术切除。考虑到患者原发病灶体积小,肿瘤负荷主要集中于肝脏,故优先处理肝脏病灶。对于原发病灶的局部治疗,如超声内镜下无水乙醇注射等,暂不作为首要考虑。
在药物选择方面,虽然生长抑素类似物可有效抑制胰岛素的分泌,但也可能抑制胰高糖素的分泌,增加低血糖风险[15]。鉴于本例患者还患有胆囊泥沙样结石,长期使用生长抑素类似物可能有加重胆道疾病的风险[16],因此长效生长抑素类似物并不适用于该患者。
在靶向治疗药物中,哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂(如依维莫司),被欧洲肿瘤内科学会指南推荐用于较低级别胰腺神经内分泌瘤的治疗[17],有助于延长患者的无进展生存时间。化疗方案则更适用于G3级肝转移患者[18]。此外,肽受体-放射性核素治疗和肝移植等其他治疗方法也可根据患者的具体情况进行考虑。
随着医学研究的深入,胰腺神经内分泌肿瘤的治疗取得了新的突破。DAXX/ATRX、EPHB4、ROS1和KMT2A等基因突变的研究为未来的治疗策略提供了潜在靶点[19]。值得注意的是,胰腺神经内分泌肿瘤在其基因表达上展现出独特性,其程序性细胞死亡蛋白-1(PD-1)的表达水平高于其他类型神经内分泌肿瘤,且伴有更多的肿瘤浸润淋巴细胞[20]。
因此,以PD-1抑制剂和抗血管内皮生长因子单抗为代表的免疫疗法,为胰腺神经内分泌肿瘤的治疗展现了较好的应用前景。该患者经多次肝内动脉栓塞及射频消融治疗,同时联合依维莫司靶向治疗,其肝内转移灶逐渐缩小,且血糖水平稳定在正常范围。后续患者需定期规律随访和复查,综合评估治疗效果,据此决定是否行胰腺原发肿瘤手术或超声内镜下无菌乙醇注射治疗。
综上,本文报道了一例恶性胰岛素瘤伴多发肝转移患者的临床特征及其诊疗经过。该病例的诊治不仅为临床医师提供了宝贵的实践经验,也带来一些重要启示:当遇到高度疑似胰岛素瘤的病例时,应综合运用多种影像学手段进行定位检查,以确保诊断的准确性和可靠性。此外,多学科协作诊疗模式对于提高此类患者的长期生存率至关重要。不同学科间的紧密协作与持续沟通,为患者制订更为全面、精细且高度个体化的治疗方案,不仅可显著提高治疗效果,有效延长患者的生存时间,而且能够显著改善患者的生活质量。
参考文献
[1]Kittah N E, Vella A. Management of endocrine disease: pathogenesis and management of hypoglycemia[J]. Eur J Endocrinol, 2017, 177(1): R37-R47.
[2]Zhu L, Xue H D, Sun H, et al. Insulinoma detection with MDCT: is there a role for whole-pancreas perfusion?[J]. AJR Am J Roentgenol, 2017, 208(2): 306-314.
[3]Zhu L, Xue H D, Sun Z Y, et al. Prospective comparison of biphasic contrast-enhanced CT, volume perfusion CT, and 3 Tesla MRI with diffusion-weighted imaging for insulinoma detection[J]. J Magn Reson Imaging, 2017, 46(6): 1648-1655.
[4]Brandi M L, Agarwal S K, Perrier N D, et al. Multiple endocrine neoplasia type 1: latest insights[J]. Endocr Rev, 2021, 42(2): 133-170.
[5]吴文铭, 陈洁, 白春梅, 等. 中国胰腺神经内分泌肿瘤诊疗指南(2020)[J]. 中华消化外科杂志, 2021, 20(6): 579-599.
[6]Baudin E, Caron P, Lombard-Bohas C, et al. Malignant insulinoma: recommendations for characterisation and treatment[J]. Ann Endocrinol (Paris), 2013, 74(5/6): 523-533.
[7]Yu R, Nissen N N, Hendifar A, et al. A clinicopathological study of malignant insulinoma in a contemporary series[J]. Pancreas, 2017, 46(1): 48-56.
[8]Sada A, Glasgow A E, Vella A, et al. Malignant insulinoma: a rare form of neuroendocrine tumor[J]. World J Surg, 2020, 44(7): 2288-2294.
[9]Kurakawa K I, Okada A, Manaka K, et al. Clinical characteristics and incidences of benign and malignant insulinoma using a national inpatient database in Japan[J]. J Clin Endocrinol Metab, 2021, 106(12): 3477-3486.
[10]Frilling A, Li J, Malamutmann E, et al. Treatment of liver metastases from neuroendocrine tumours in relation to the extent of hepatic disease[J]. Br J Surg, 2009, 96(2): 175-184.
[11]Caplin M E, Pavel M, Phan A T, et al. Lanreotide autogel/depot in advanced enteropancreatic neuroendocrine tumours: final results of the CLARINET open-label extension study[J]. Endocrine, 2021, 71(2): 502-513.
[12]Vogl T J, Naguib N N N, Zangos S, et al. Liver metastases of neuroendocrine carcinomas: interventional treatment via transarterial embolization, chemoembolization and thermal ablation[J]. Eur J Radiol, 2009, 72(3): 517-528.
[13]Mohan H, Nicholson P, Winter D C, et al. Radiofrequency ablation for neuroendocrine liver metastases: a systematic review[J]. J Vasc Interv Radiol, 2015, 26(7): 935-942.e1.
[14]Engelman E S, Leon-Ferre R, Naraev B G, et al. Comparison of transarterial liver-directed therapies for low-grade metastatic neuroendocrine tumors in a single institution[J]. Pancreas, 2014, 43(2): 219-225.
[15]Rinke A, Krug S. Neuroendocrine tumours-medical therapy: biological[J]. Best Pract Res Clin Endocrinol Metab, 2016, 30(1): 79-91.
[16]Brighi N, Lamberti G, Maggio I, et al. Biliary stone disease in patients receiving somatostatin analogs for neuroendocrine neoplasms. a retrospective observational study[J]. Dig Liver Dis, 2019, 51(5): 689-694.
[17]Pavel M, Öberg K, Falconi M, et al. Gastroenteropancreatic neuroendocrine neoplasms: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2020, 31(7): 844-860.
[18]Jin K Z, Xu J, Chen J, et al. Surgical management for non-functional pancreatic neuroendocrine neoplasms with synchronous liver metastasis: a consensus from the Chinese Study Group for Neuroendocrine Tumors (CSNET)[J]. Int J Oncol, 2016, 49(5): 1991-2000.
[19]Burns L, Naimi B, Ronan M, et al. Report of a novel molecular profile in malignant insulinoma[J]. J Clin Med, 2023, 12(4): 1280.
[20]Bösch F, Brüwer K, Altendorf-Hofmann A, et al. Immune checkpoint markers in gastroenteropancreatic neuroendocrine neoplasia[J]. Endocr Relat Cancer, 2019, 26(3): 293-301.


