European Respiratory Journal:肺动脉高压的病理学和病理生物学:未来方向
时间:2024-09-21 16:03:26 热度:37.1℃ 作者:网络

近年来,在多种类型的肺动脉高压的肺血管重塑机制的细胞和分子层面研究中取得了重大进展,这些类型包括肺动脉高压(第一大类)、与左心疾病相关的肺动脉高压(第二大类)、与慢性肺疾病和缺氧相关的肺动脉高压(第三大类)以及慢性血栓栓塞性肺动脉高压(第四大类)。然而,这些不同类型的肺动脉高压的生存率仍不尽如人意,凸显出将创新的科学知识更有效地转化为医疗干预的关键需求。在第七届世界肺动脉高压研讨会的会议中,我们深入探讨了病理学和病理生理学领域的最新进展,重点分析其与不同肺动脉高压亚型的相关性。此外,我们研究了最新的组学技术和其他技术进展如何帮助我们更好且更快速地理解导致肺血管重塑起始和进展的多种基本机制。最后,我们讨论了旨在改善患者护理、优化药物开发并为推动该领域研究提供必要支持的策略。
病理学与病理生物学:简要概述
肺血管重塑是所有类型肺动脉高压(PH)的共同特征,主要表现为肺循环远端发生的一系列结构和功能性改变。在肺动脉高压(PAH)中,这些改变主要影响肺小动脉;而在肺静脉阻塞性疾病、肺毛细血管血管瘤病或与左心疾病相关的肺动脉高压中,则主要涉及小到中等大小的静脉和毛细血管。这些改变一旦影响到肺循环的较大部分,会导致肺血管阻力(PVR)增加,进而引起肺动脉压力升高,并对右心室的结构和功能产生影响。
确诊PAH时,患者通常已出现可能不可逆的肺血管病变。然而,目前尚无特定类型的病变被确认与PAH患者显著增加的PVR存在直接因果关系。尽管一些研究揭示了某些闭塞性病变集中于特定部位,病变在整个肺动脉系统中的复杂分布仍未明确,这使得全面理解其病理机制充满挑战。此外,不同PH类型之间的组织学异质性也增加了研究难度。异质性不仅与患者的临床特征(如发病年龄、病程进展速度和治疗反应)相关,还涉及各种可能导致PAH或PH的病因。这种异质性,加上肺组织获取的困难,严重限制了新疗法的开发,但也推动了个性化和精准治疗的探索。未来的治疗可能依赖于可靠且可重复的生物标志物,以及一些新兴技术的应用。
肺血管重塑的一个关键特征是血管壁内外血管和免疫细胞的积累,这一过程由多种病理性分子机制动态协调。驱动这一过程的因素包括肺内皮细胞(ECs)分泌的缩血管和扩血管物质的不平衡,平滑肌细胞(SMCs)和成纤维细胞生长调节的紊乱,以及血栓、炎性介质、TGF-β家族信号通路等多种机制的失调。高剪切应力、慢性缺氧、遗传易感性和TGF-β家族的调控失衡均是促进这些病理过程的因素。目前,多个新疗法正处于开发的不同阶段,为改善PAH/PH患者的预后提供了希望。
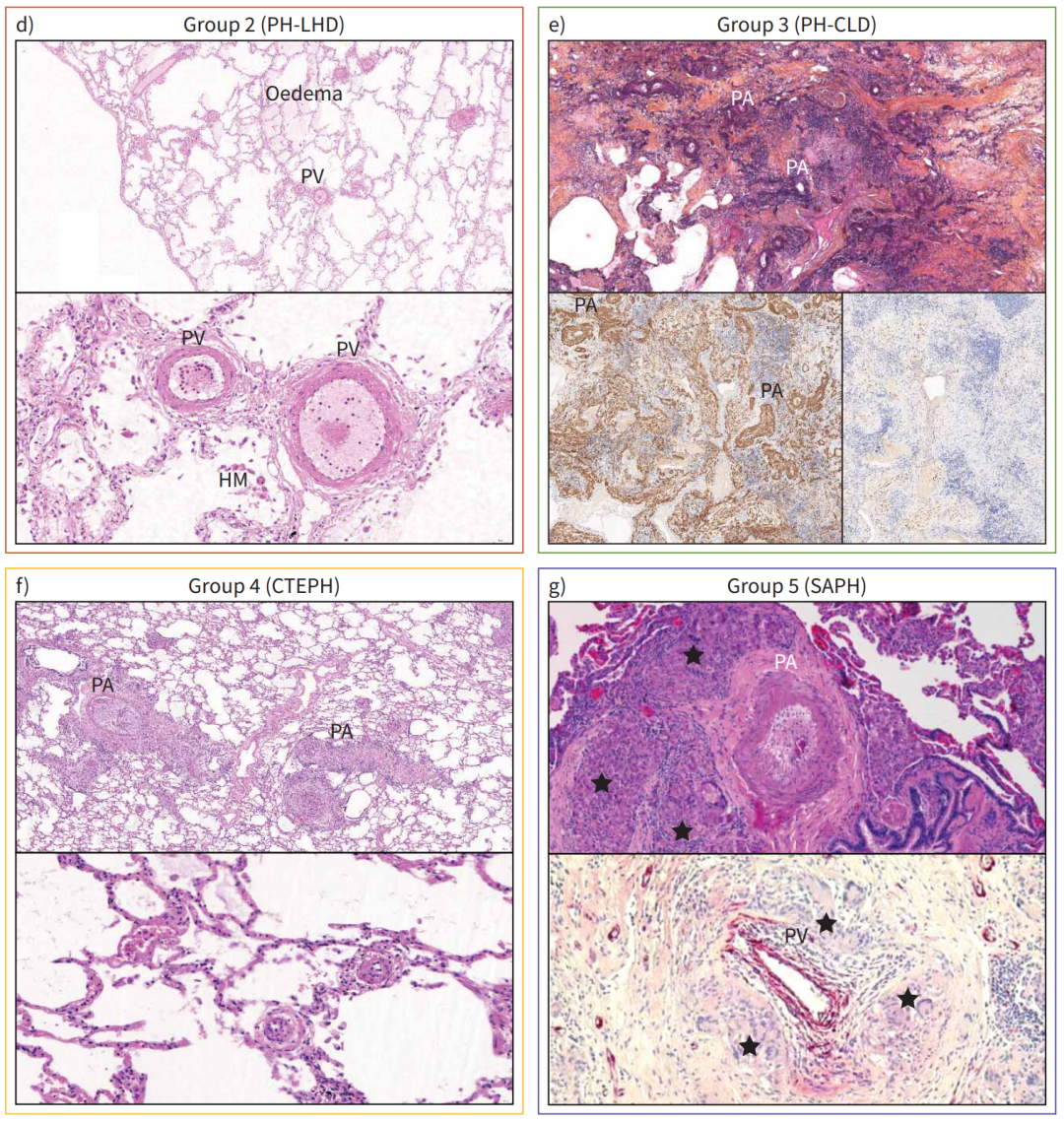
对于不同PH形式的理解和治疗,尤其是与慢性肺疾病相关的PH,研究进展较为缓慢。部分原因是缺乏不同PH组别间特征性组织病变的比较研究。在慢性高海拔PH中,缺氧是主要介导因素。长期生活在高海拔的患者尸检显示,近端肺动脉的中膜肥厚,以及远端小动脉肌化增加,导致远端与近端动脉比例升高。同样,慢性阻塞性肺疾病相关PH(COPD-PH)患者表现为中膜层肥厚,并在小动脉中出现新的平滑肌层和内弹性膜。COPD-PH的病理还包括血管细胞在内膜和中膜中的积聚。相比暴露于香烟烟雾或博来霉素的动物,患有COPD和特发性肺纤维化(IPF)并伴有PH的患者,在接受肺移植时表现出更多的微血管重塑,尤其是在严重PH患者中。这与PAH的重塑模式有所不同。
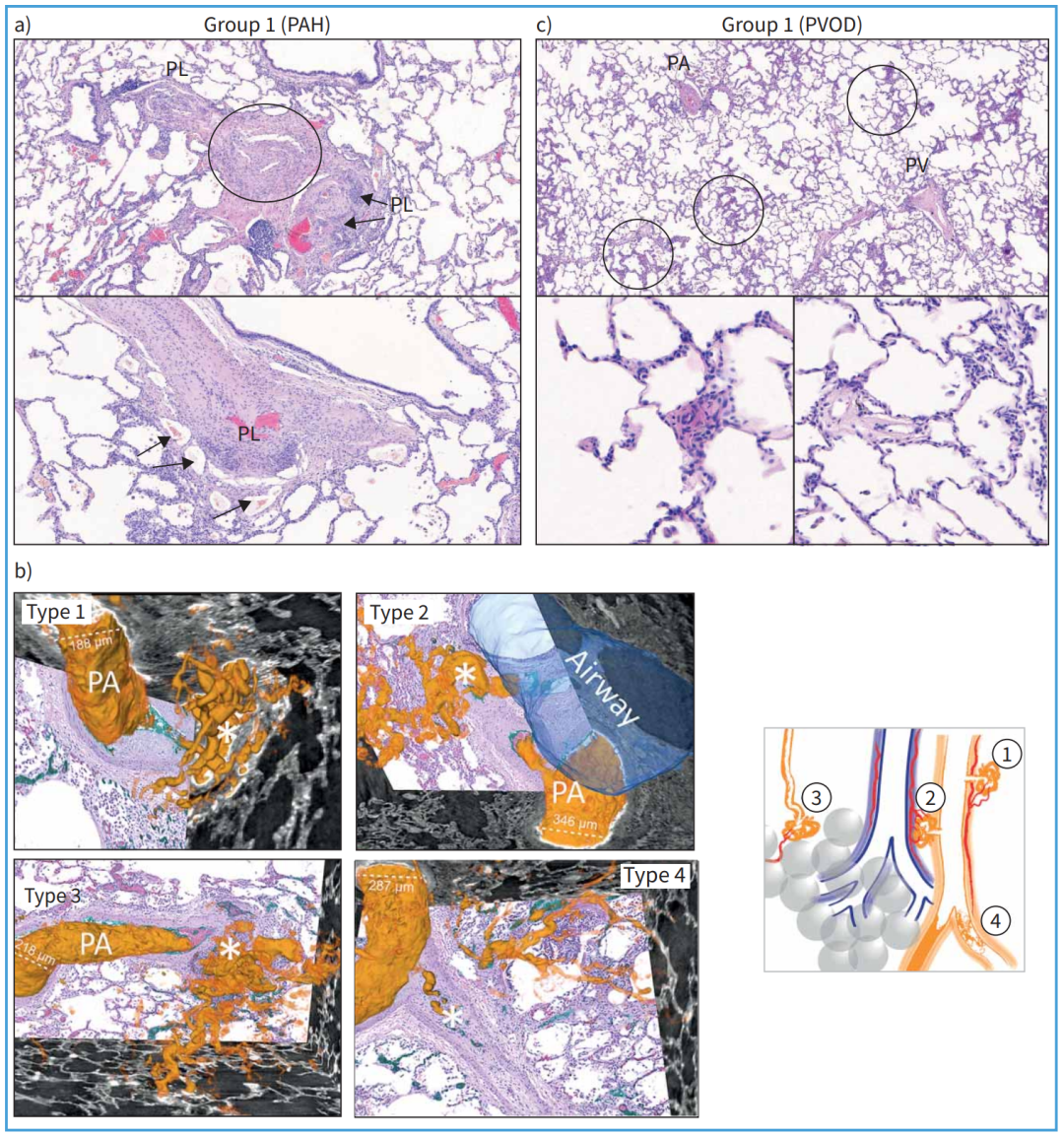
有趣的是,在IPF-PH、COPD-PH等疾病中,病理研究通常未发现丛状病变的存在。这一现象仍未被充分解释,也挑战了我们对丛状病变功能及起源的理解。然而,丛状病变常见于特发性和遗传性PAH患者,提示可能存在独特的致病机制。一些研究发现,丛状病变内存在支气管肺动脉吻合,表明系统性肺血管与肺循环之间可能存在分流。类似地,Ghigna等人观察到,主要携带BMPR2突变的PAH患者中,丛状病变常连接滋养血管和支气管动脉,并通过旁路连接到肺静脉。最新的研究通过基于同步辐射的微型计算机断层扫描(CT)进行三维(3D)分析,揭示了丛状病变的多样性。图1展示了这些病变的不同类型。这种成像技术与组织学、免疫组织化学等技术结合,为我们探索PH机制提供了全面的手段。
参考文献:
Pathology and pathobiology of pulmonary hypertension: current insights and future directions;Christophe Guignabert, Jurjan Aman, Sébastien Bonnet, Peter Dorfmüller, Andrea J. Olschewski, Soni Pullamsetti, Marlene Rabinovitch, Ralph T. Schermuly, Marc Humbert, Kurt R. Stenmark;Journal Article | European Respiratory Journal Date: 29-Aug-2024 DOI: 10.1183/13993003.01095-2024


