【Blood】我如何诊断和治疗异基因造血干细胞移植后的机化性肺炎
时间:2024-09-11 12:08:16 热度:37.1℃ 作者:网络
移植后机化性肺炎
机化性肺炎(organizing pneumonia,OP)是一种间质性肺疾病,可由多种原因引起,包括对药物的特发性反应、胶原血管疾病、误吸或感染以及常见的可变免疫缺陷。除了这些原因外,OP也是异基因造血细胞移植(HCT)后一种已知的非感染性肺部并发症,是HCT受者非复发死亡率的重要危险因素。但对其流行病学的了解尚不清楚,包括其与慢性移植物抗宿主病(cGVHD)的关系,与闭塞性细支气管炎综合征(BOS)不同,OS并未被普遍认为是慢性移植物抗宿主病(cGVHD)的独特肺部表现,因此缺乏诊断标准和治疗方法。鉴于其与非HCT人群中的OP具有相似的临床特征、放射学和组织学表现,HCT接受者的OP的诊断方法和治疗策略在很大程度上是根据非HCT人群改良。
《Blood》近日发表How I Treat系列文章,斯坦福大学医学院三位呼吸重症专家提出OP的诊断标准,概述了诊断和治疗策略,并强调了可能出现的潜在挑战,并讨论了这一领域的知识缺口,以及未来研究的需要领域。

病例1:HCT-OP的临床表现及诊断
患者为73岁男性,有MDS病史,接受非清髓性异基因外周血干细胞移植(PBSCT), HCT一年后出现进行性呼吸困难、干咳和低氧血症。在就诊前几周新诊断为皮肤cGVHD。胸部CT示胸膜下和支气管血管周围分布的上肺叶主要的磨玻璃影(图1A)。给予左氧氟沙星治疗感染性肺炎但未见改善。临床病史未显示既往有与OP相关的药物暴露。进行支气管镜检查和支气管肺泡灌洗(BAL),细菌、真菌和病毒病原体的微生物培养结果为阴性。鉴于缺乏与已知肺毒性药物或感染因子的关联,诊断为HCT-OP,开始使用泼尼松(每天1mg/kg),并在4个月内逐渐减量。患者的临床症状迅速缓解,包括皮肤cGVHD,影像学改善(图1B)。
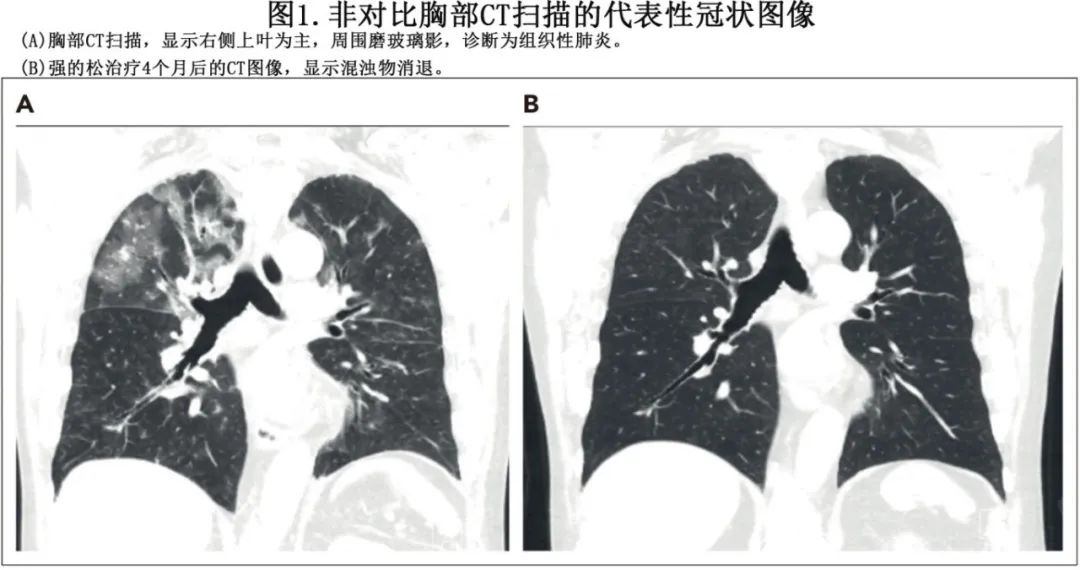
病例1讨论
该病例说明了HCT-OP的典型表现。OP的典型症状包括呼吸困难、干咳、深吸气胸膜炎性胸痛和低热。HCT-OP可发生于成人和儿童HCT受者。HCT-OP通常在肺外GVHD新发或加重时短暂发生,最常与皮肤、胃肠道或口腔GVHD相关。罕见在其他器官的GVHD缓解时发生。大多数HCT-OP发生在HCT后的前 3年内,但也有晚期发生的报道。Freudenberger等人描述了49例活检证实的OP,表现时间从HCT后几天到>7年。由于OP的症状和影像学结果与感染性肺炎非常相似,HCT-OP的诊断经常推迟,可能导致与该疾病相关的发病率和死亡率。
尽管对HCT-OP流行病学的了解有限,但在一项研究中,在5340例接受异基因HCT的患者中发现 49例(0.9%)活检证实的OP。OP与急性GVHD(优势比3.8) 和cGVHD(优势比3.1)均有显著相关性。因此,尽管HCT-OP的病理生理特征尚不清楚,但其发生与GVHD发病之间的时间关系提示存在类似的免疫介导损伤。HCT-OP的其他危险因素包括脐血以外的干细胞来源、清髓性预处理方案和大剂量照射。但由于单中心回顾性研究的固有局限性,这些发现并未得到普通认可。虽然目前没有明确的诊断标准,但作者提出以下诊断HCT-OP的标准:
1.异基因HCT史。
2. 其他器官的急性或慢性GVHD病史,与疾病活动无关。
3.胸部CT表现与OP相符。
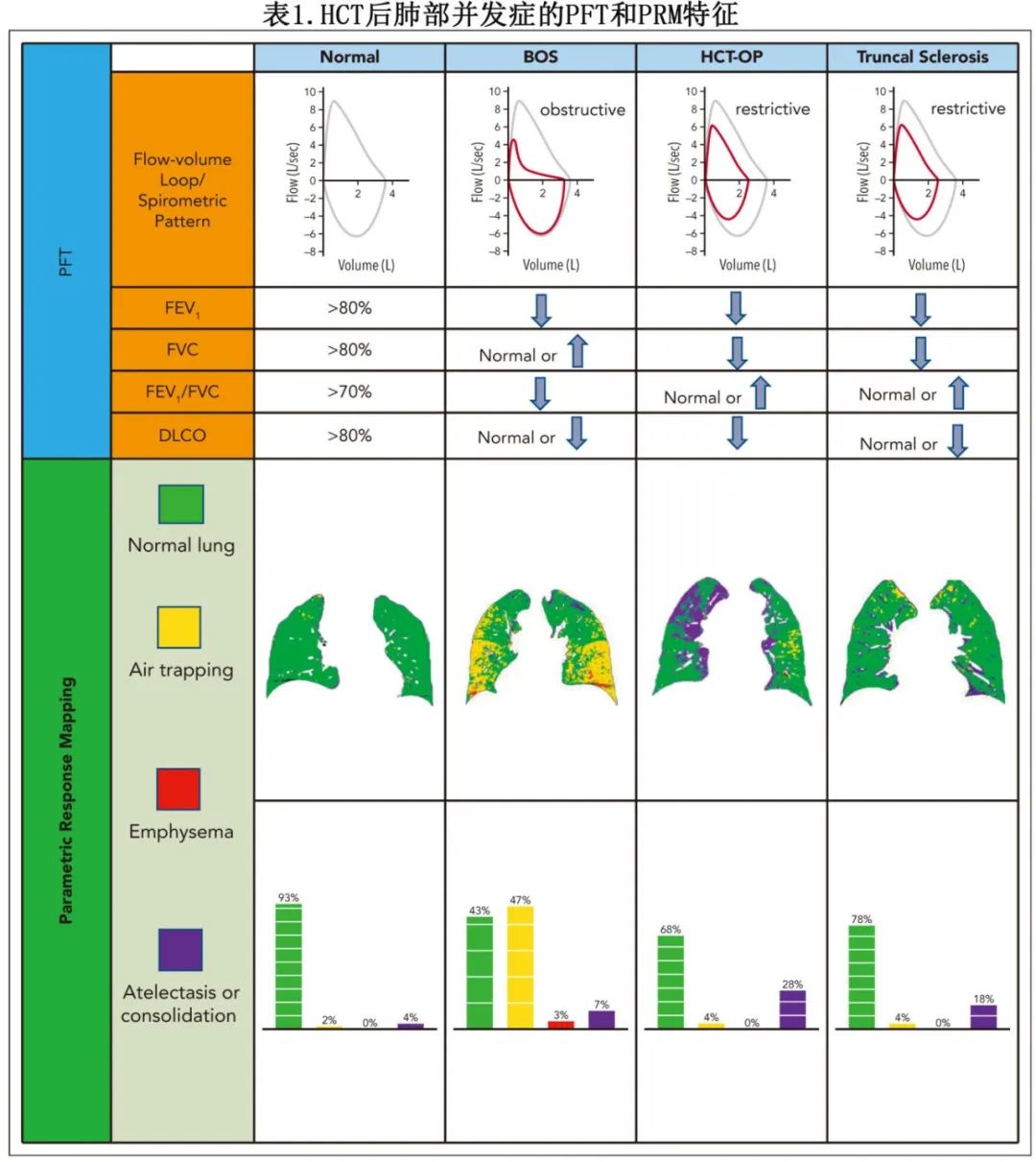
4.限制性肺量测定模式下一氧化碳弥散能力(DLCO)下降(表1)。
5.呼吸道培养未发现感染性病原体,或者尽管接受了广谱抗菌治疗,但临床或影像学无改善。
6.肺活检符合OP(如果可行)。
HCT-OP的诊断需要全面的临床评估,包括排除相关疾病,如药物性肺炎。目前尚无特异性检查(包括肺功能检查[PFT])能够区分药物性肺炎和OP。因此其诊断需通过仔细评估患者暴露于可诱发肺炎的药物来确定(见www.pneumotox.com)。考虑到在活动性感染的情况下,免疫抑制有增强的风险,因此应坚决排除感染原因。肺科医生的早期介入对于HCT受者肺部并发症的诊断和评估至关重要。可弯曲支气管镜联合BAL是识别免疫功能低下宿主机会性感染的常用诊断工具。支气管镜检查可安全用于危重患者,甚至血小板严重减少的患者。对于因临床不稳定而不适合进行支气管镜检查的患者,应采用其他诊断方法,如呼吸道培养、呼吸道病毒聚合酶链反应(PCR)、霉菌血清PCR和其他非培养真菌试验(如β-d-葡聚糖和半乳甘露聚糖曲霉)。对于免疫功能低下的感染性疾病的累及,强烈建议由专家协助检查。建议同时使用支气管镜检查和无创检查,因为这两种方法都有各自的局限性,但同时使用时可以相互补充。HCT受者的支气管镜检查率经常受到各种因素的影响,如支气管镜检查的时机、支气管镜检查前抗菌治疗的持续时间、急性GVHD或中性粒细胞减少。在这种情况下进行无创检查可提高诊断率,然而,HCT后某些肺部并发症无法通过无创检查进行诊断(例如弥漫性肺泡出血,当无法获得诱导痰时,可归因于其他病原体的感染,如非结核分枝杆菌);在这种情况下,进行支气管镜检查的获益超过潜在风险。由于在cGVHD患者中观察到手术并发症的高风险,肺活检通常推迟。作者将肺活检用于高度选择性的病例,例如:(i)尽管进行了全面评估,但诊断仍然难以确定;(ii)尽管接受了皮质类固醇治疗,患者的临床状况仍无改善;(iii)恶性肿瘤或侵袭性真菌病的鉴别诊断仍很高。
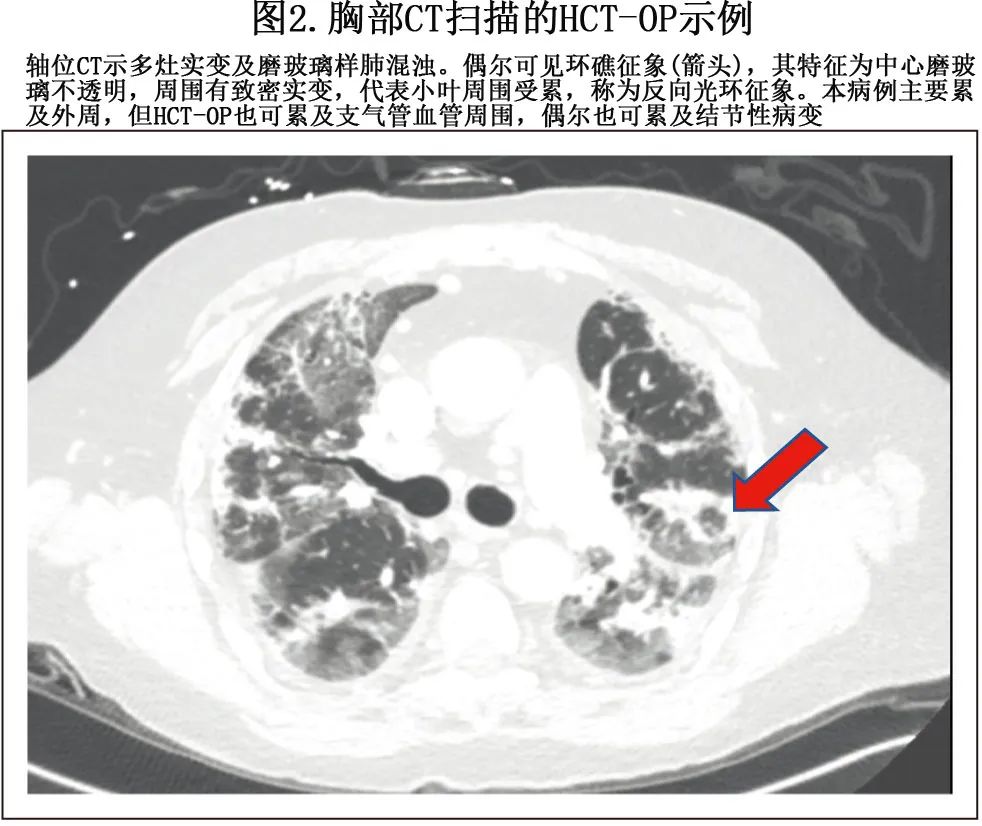
HCT-OP 的放射学表现可以是多样的,从经典的环礁征(图2)到支气管血管周围或胸膜下分布的非特异性毛玻璃样阴影和实变的组合,伴或不伴肺的结构扭曲,由纤维化导致。HCT-OP既可单侧发生,也可双侧发生,既可单发病变,也可多灶实变,无区域偏好。极少数情况下,HCT-OP可表现为明显的结节性实变。如果临床病史和放射史高度提示HCT-OP,而感染检查未显示,则应开始治疗HCT-OP。
限制性通气模式和DLCO下降是HCT-OP肺功能检查的常见异常(表1)。阻塞性模式不典型,但已有报道。但出现阻塞性肺活量模式应考虑BOS,因为HCT-OP和BOS并不相互排斥(见后面病例)。肺功能检查(PFT)用于支持HCT-OP的诊断,并作为疾病监测、监测治疗效果和复发的重要工具,但PFT结果也可能受到与cGVHD相关其他伴发肺部疾病的影响,如BOS、躯干硬化性皮肤病(称为躯干硬化)引起的肺外限制和感染性肺炎。因此,在HCT-OP的治疗中必须采用多学科方法,包括移植医生、肺病专家、传染病专家和胸科放射科医生。PFT的价值及其在诊断和随访方面的局限性见下文。
病例2:HCT-OP与非HCT-OP的比较
患者为有骨髓纤维化病史的70岁男性,接受清髓性异基因 PBSCT。HCT三年后出现肝脏cGVHD,接受泼尼松(80mg/d或1mg/kg/d)和吗替麦考酚酯(1g,每日两次)治疗。肝脏cGVHD稳定后泼尼松逐渐减少到8mg/d,吗替麦考酚酯停用8个月。2个月后出现发热、咳嗽,胸部CT扫描示右上肺弥漫性磨玻璃影伴结节(图 3A)。包括BAL在内的感染性检查为阴性,并确诊HCT-OP。泼尼松逐步恢复至1 mg/kg和1 mg/kg后,患者的呼吸道症状和影像学异常消失。重新开始使用吗替麦考酚酯作为皮质类固醇替代药物(corticosteroid-sparing agents)(图3B)。
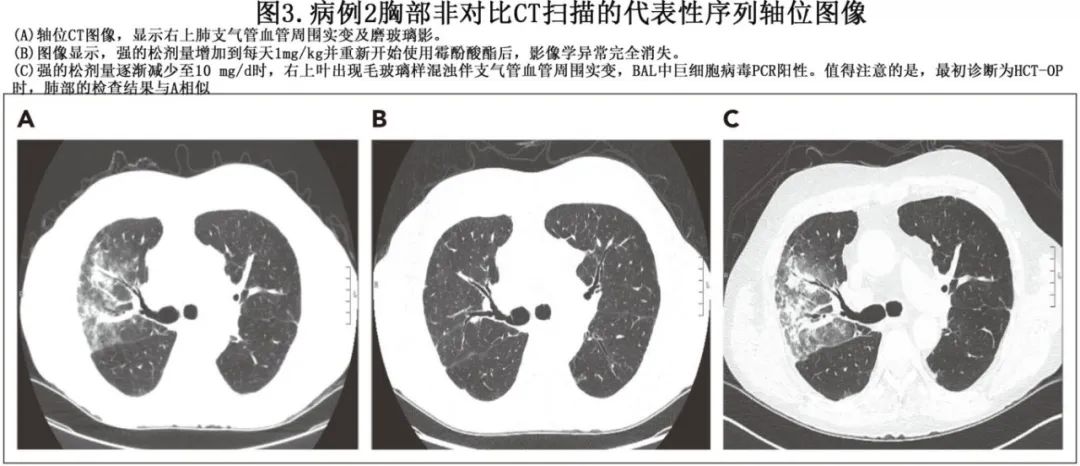
患者病情稳定,直至泼尼松在4个月期间逐渐减量至10mg,此时患者再次出现发热和咳嗽。胸部CT扫描显示右上肺叶片状实变和磨砂玻璃,分布与先前的HCT-OP相似(图3C)。BAL检测结果显示巨细胞病毒(CMV) PCR阳性,但血清CMV PCR阴性。考虑到操作风险,未进行肺活检以明确CMV肺炎的诊断。经过多学科讨论后,开始使用更昔洛韦,患者的症状改善,而泼尼松保持为10mg。后续的胸部CT扫描也显示右上肺叶异常消失(图像未显示)。
病例2讨论
该病例表明,HCT-OP 不仅可发生在新发 GVHD 时,也可以发生在肺外 cGVHD 的免疫抑制减量时。Freudenberger等人观察到22%的活检证实的OP病例与皮质类固醇减量有关,因此应在cGVHD发病时获得PFT,然后进行连续PFT监测,因为在免疫抑制减量期间,即使患者仍无症状,PFT变化可能是肺部并发症(即BOS或HCT-OP)的早期征兆。建议在HCT后的前1- 2年内每3-6个月进行一次PFT,以改善监测,特别是有肺cGVHD危险因素的患者,如肺外cGVHD或既往呼吸道病毒感染的患者。该建议符合NIH指南和NIH 2020年cGHVD临床试验标准共识发展项目,重点是早期识别疾病。不幸的是,由于HCT后进行常规PFT的比率很低(<40%的HCT受者在移植后每年有>1次PFT),并且这一频率在移植后大幅下降,因此遵守这些建议的情况并不理想。部分归因于医生意识不足、患者合共病、就诊困难或安排PFT的后勤障碍。为了解决这些挑战,越来越多的研究证明了居家肺量测定法的疗效。这些设备具有可接受的准确性,可进行遥测监测,是促进疾病早期发现和干预的有吸引力的解决方案,并有可能改善患者结局。
HCT-OP复发较常见,高达30%至50%,并且可能与免疫抑制逐渐减量、出现新表现或在cGVHD恶化期间有关。有GVHD病史的患者更容易发生HCT-OP复发的风险。
HCT受者也可能因与GVHD无关的原因而发生OP(表2)。
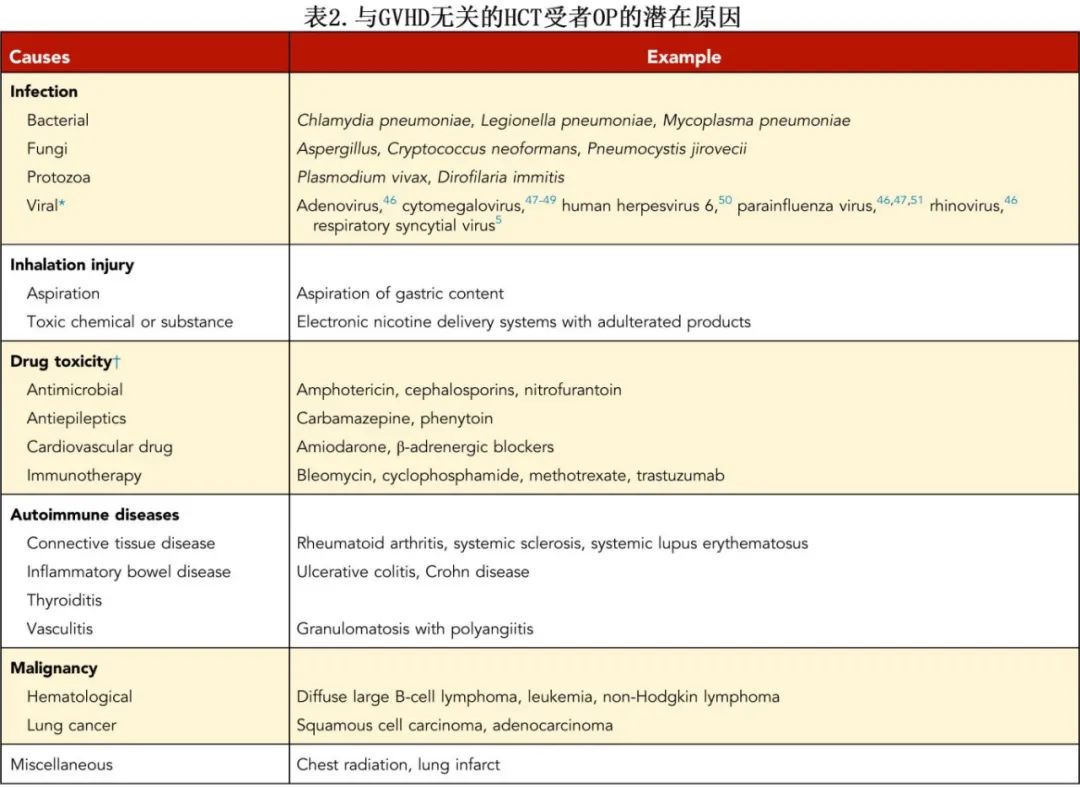
在这种情况下,评估应包括全面的诊断检查,以确定可疑的原因。呼吸道病毒感染是OP的原因之一(表2)。在这些情况下,如本例所示,单独治疗潜在的病毒感染可能会解决OP。如果需要皮质类固醇治疗病毒诱导的OP,使用可用的抗病毒药物通常可以更快地减少皮质类固醇的剂量,而非缓慢减量。
有趣的是,作者未观察到迁移性肺浸润,而这通常被描述为隐匿性OP(COP)的特征。相反,正如本病例所示,复发发生在类似于指数发作的x线片分布中(图3A,C)。即使HCT-OP的复发与指数发生相隔数年,情况也是如此。确切的机制尚不清楚,但可能与召回性放射性肺炎(recall radiation pneumonitis)相似。
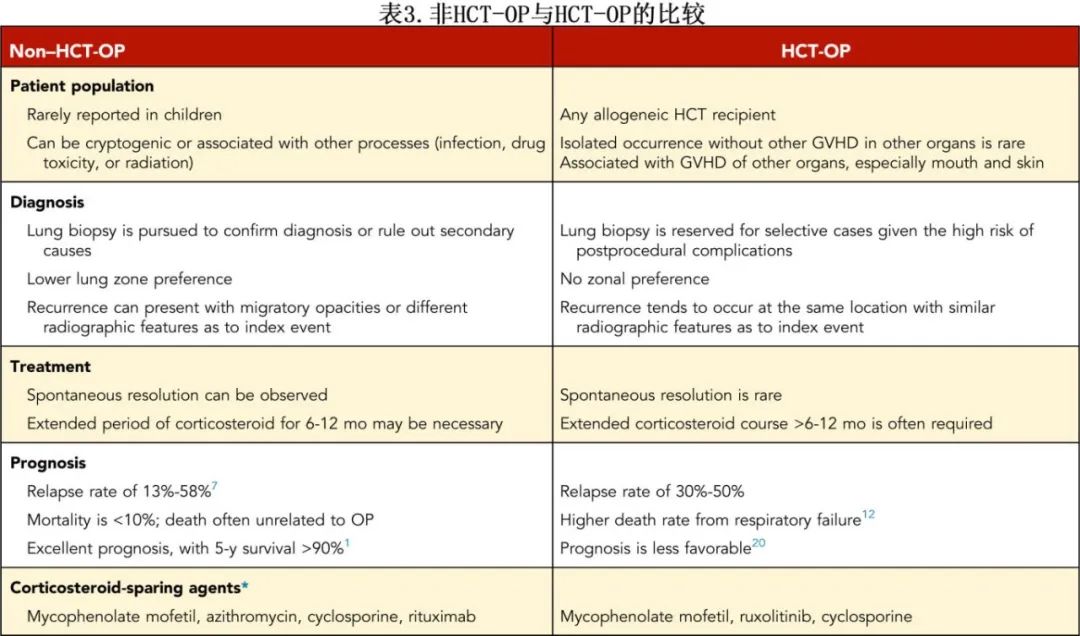
与COP不同,COP的总体生存率通常较好,呼吸衰竭导致的死亡并不常见,Nakasone等人进行的一项回顾性研究发现,呼吸衰竭的高发生率(25%)导致高非复发死亡率。同样,一些研究表明,呼吸衰竭是HCT-OP患者死亡的主要原因。尽管如此,大多数接受皮质类固醇治疗的患者有显著的临床和影像学改善,与作者的经验一致。HCT-OP的5年总生存率(70.8%)与BOS(73.8%)相当。COP中有OP自发消退的报道,但在HCT-OP中很少见到。表3总结了非HCT-OP与HCT-OP之间的其他临床差异。
病例3:HCT-OP的治疗
患者为67岁男性,有骨髓增生异常综合征病史,接受非清髓性异基因HCT,移植后并发口腔cGHVD。口腔 cGHVD发病时主诉有干咳和右侧胸膜炎性胸痛。胸部CT扫描示磨玻璃影,主要位于右下肺叶。除了 BAL细胞计数显示淋巴细胞优势(35%)外,包括BAL在内的感染性检查为阴性。随后确诊 HCT-OP。患者开始接受每日40 mg(0.5 mg/kg)泼尼松治疗,症状和影像学改善。在每月门诊访视和PFT指导下,以每2周5 mg的速度将泼尼松减量(图4)。患者停用泼尼松,并保持呼吸稳定。2个月后再次出现咳嗽和胸膜炎性胸痛。影像学特征和感染性检查倾向于HCT-OP复发。重新开始泼尼松(40 mg/d)治疗,临床和影像学改善。与移植医师讨论后,开始使用伊布替尼(140 mg/d)作为皮质类固醇替代药物。患者接受感染预防,包括阿昔洛韦、泊沙康唑和磺胺甲恶唑/甲氧苄啶。泼尼松以平均每2周5mg的速度逐渐减量,泼尼松成功停药,HCT-OP未复发。
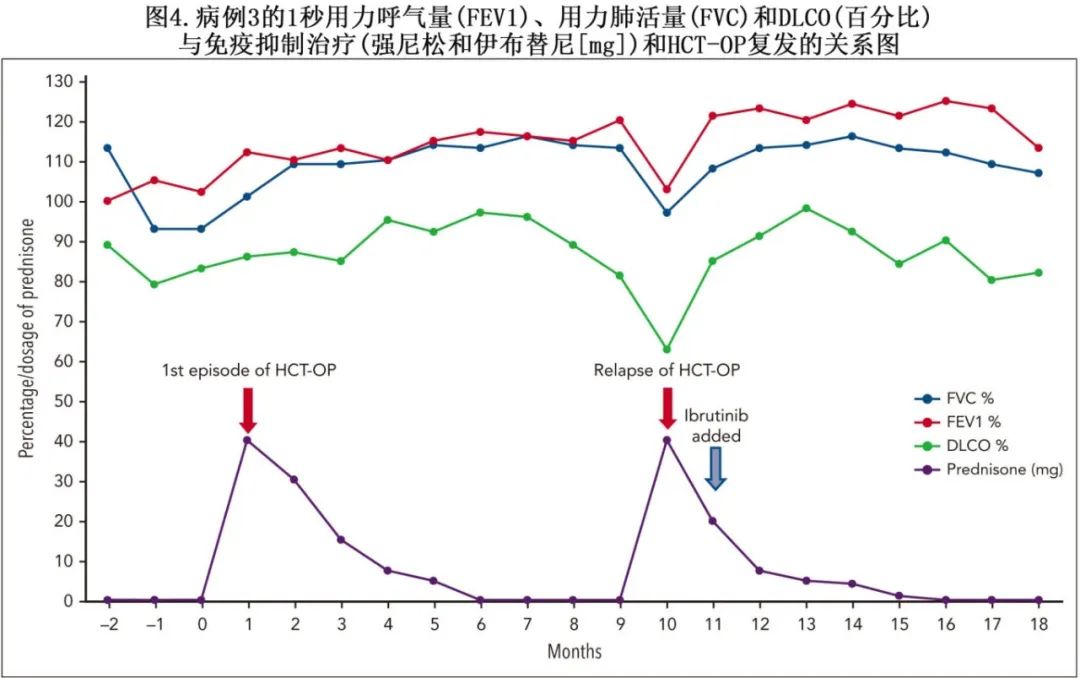
病例3讨论
与COP不同,在COP中可以观察到自发消退,而HCT-OP通常需要免疫抑制。全身性皮质类固醇仍是确诊时的主要治疗。一般情况下泼尼松起始剂量为每日1 mg/kg。对于非低氧血症的患者,每日0.5mg/kg的泼尼松可能足够。但对于需要机械通气支持或严重低氧血症并需要入住ICU的危重患者,建议每日1~2mg/kg的甲强龙冲击,并根据临床稳定性由医师决定减量,直至患者可减量至泼尼松每日1mg/kg。
开始使用皮质类固醇1~2周后,患者对皮质类固醇的应答应明显。观察到临床改善后,可尝试每周将泼尼松减量10 mg,直至达到50~ 60mg/d的剂量。胸部重复CT扫描的目的为确保影像学改善,并监测与免疫抑制相关的机会性感染。此后通常以每2周5mg的速度逐渐减量。如果有必要,可以在这一阶段引入皮质类固醇替代药物,特别是如果在皮质类固醇逐渐减少期间有HCT-OP发作的证据。图5总结了皮质类固醇起始、减量和皮质类固醇难治性HCT-OP治疗的一般方法。
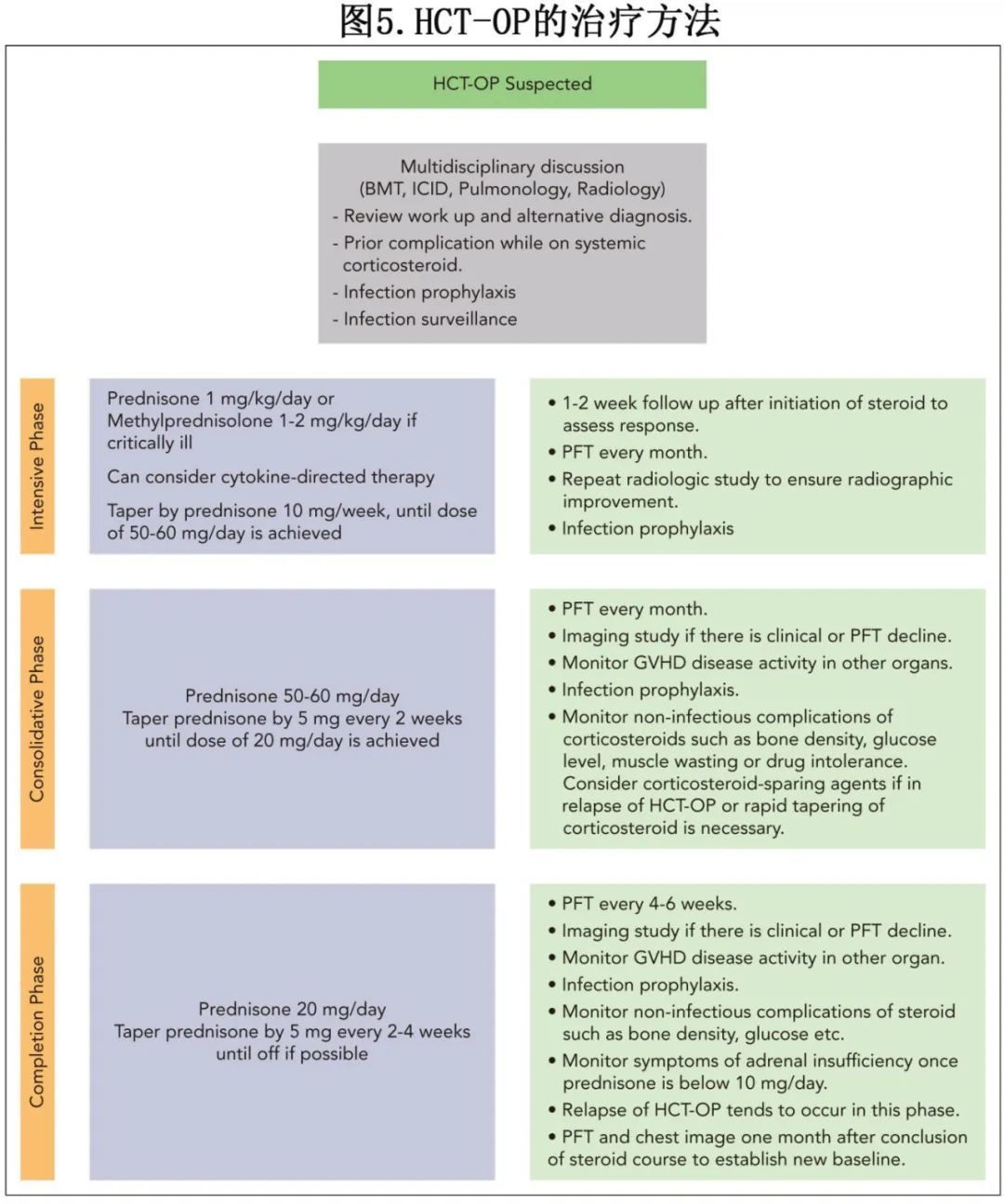
在整个治疗阶段应常规监测并发症,如肺外cGVHD加重、感染和长期使用皮质类固醇相关的并发症。适当的感染预防至关重要,因为机会性感染是最常见并发症。因此,在HCT-OP的早期通常每月监测患者,包括使用PFT、血氧饱和度测量和运动能力。在减量期间保持低阈值,以便进行随访影像学检查,以指导皮质类固醇剂量调整。一旦泼尼松剂量达到20mg/d,作者倾向于缓慢减量,因为低于这个剂量时HCT-OP复发的风险增加。相反,如果观察到显著的皮质类固醇诱发的不良反应,则可以更快地减量,或者可以在治疗过程中更早地引入减少皮质类固醇替代药物。
在首次发生HCT-OP时,作者通常不使用皮质类固醇替代药物,而在疾病复发时使用(如病例所示)。但如果因皮质类固醇不耐受(例如未控制的糖尿病、骨质疏松症、椎体骨折或肌病)需要更快的皮质类固醇减量,可考虑在HCT-OP指数发作时使用皮质类固醇替代药物。目前在HCT-OP中使用药物作为皮质类固醇替代药物尚无循证标准。由于目前尚无关于最佳治疗方法的共识指南或研究,因此在临床实践中存在较大的变异性。Yanik等人进行的一项前瞻性、开放标签试验表明,同时给药皮质类固醇和依那西普可使33%的限制性肺病患者的强制肺活量(FVC)改善>10%;5年生存率为44%,依那西普耐受性良好,且不增加感染风险。关于HCT-OP中使用的其他药物的数据仅限于病例报告和系列报道(表4)。
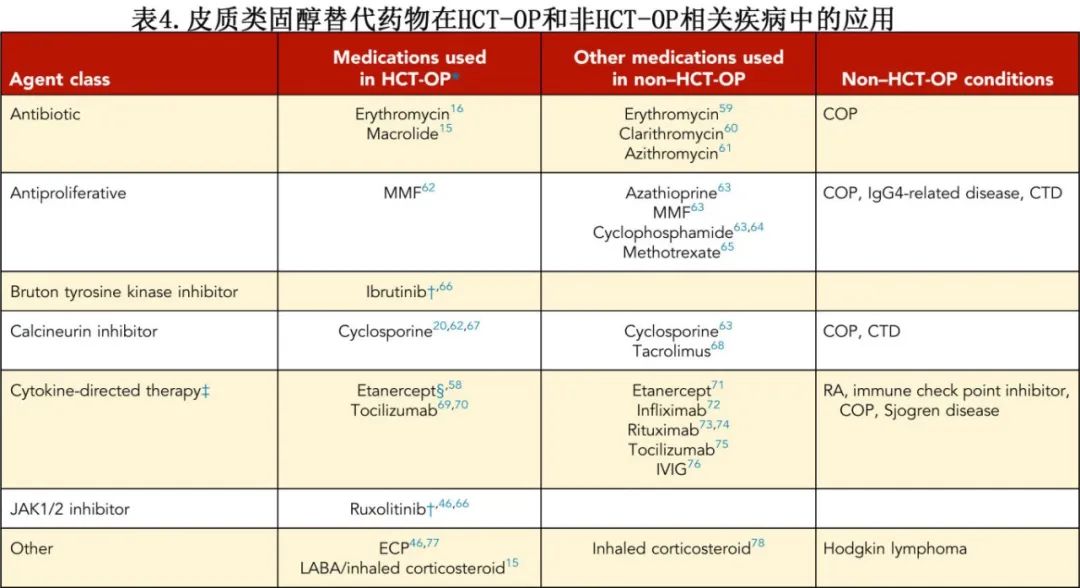
鉴于缺乏具体的 HCT-OP数据,作者提供了非HCT人群中发生的OP时使用的药物的参考。由于皮质类固醇替代药物可能具有复杂的药物药物相互作用,对免疫抑制有较大影响,对非肺部 cGVHD的疗效也不尽相同,药物选择应与移植医师、肺科医师和感染性疾病专科医师讨论。
病例4:HCT-OP治疗过程中的并发症及并发BOS
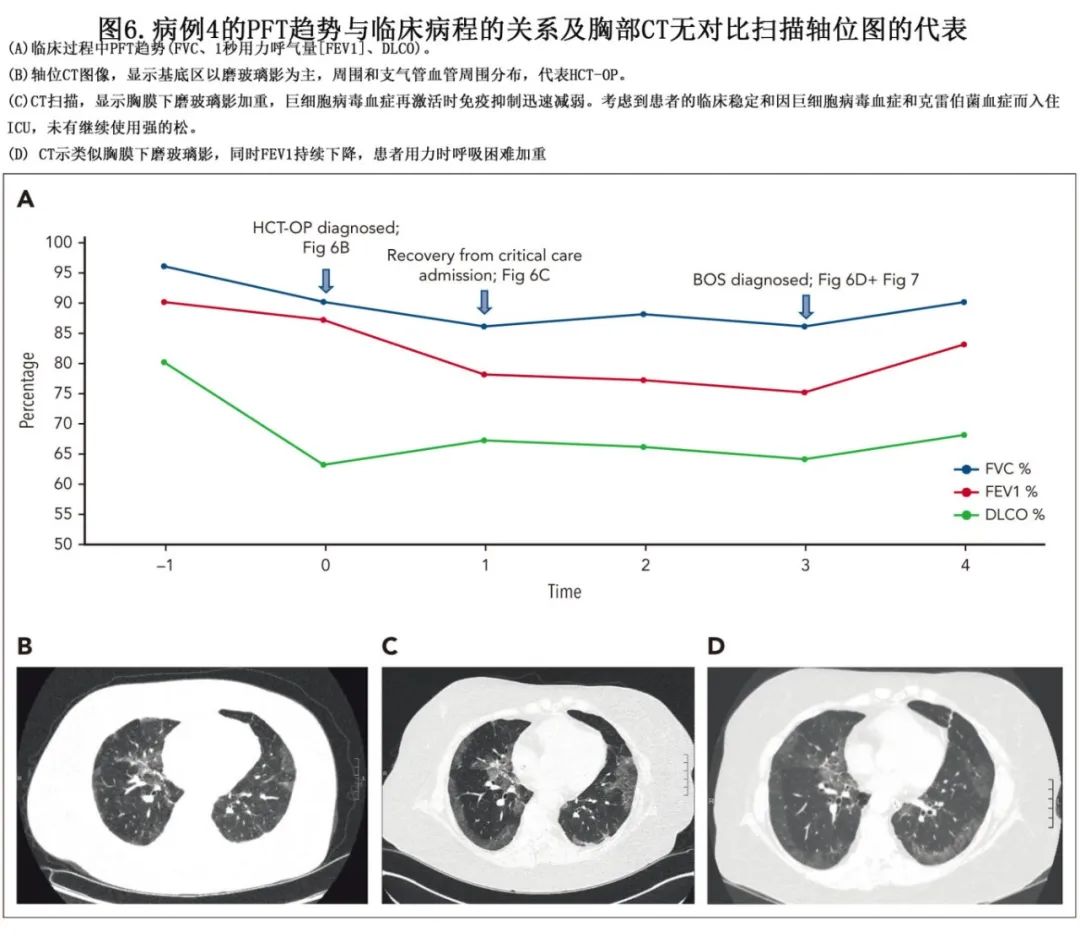
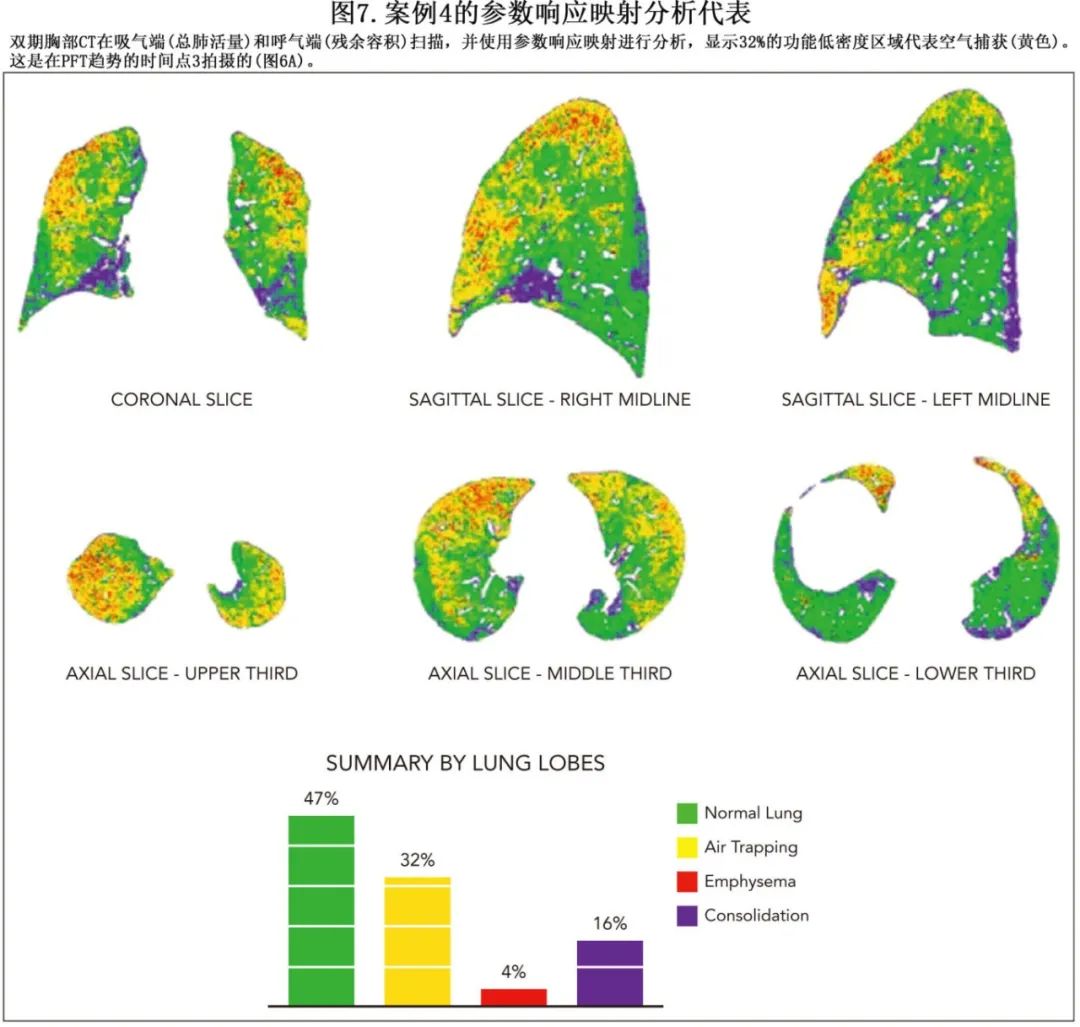
患者为57岁复发性霍奇金淋巴瘤女性患者,接受非清髓性异基因PBSCT。2年后发生眼部和肝脏cGVHD。患者的免疫抑制方案包括芦可替尼(10mg/d)、体外光分离治疗和泼尼松(10 mg/d)。患者因亚急性发作的呼吸困难被转诊,并被发现有以基底部为主的双侧磨玻璃影(图6B)。PFT显示DLCO下降(图6A,时间0)。BAL等感染检查为阴性。患者开始使用1mg/kg泼尼松进行HCT-OP治疗,主诉呼吸状态有所改善。四周后因克雷伯氏菌血症和巨细胞病毒血症入住ICU。患者接受抗菌治疗并出院回家。在密切监测下,2周内将泼尼松剂量从40 mg/d逐渐减量至15 mg/d。在皮质类固醇逐渐减量期间,x线片显示恶化,表明HCT-OP出现复发(flare) (图6C)。然而鉴于临床稳定和最近入住ICU,免疫抑制未升级。此后不久,患者开始主诉呼吸困难和咳嗽加重。x线片间期无变化(图6D),但其PFT显示1秒内用力呼气量下降(FEV1),FEV1/FVC比值为0.76,与阻塞性肺疾病恶化有关。PFT不符合BOS的NIH标准,因为FEV1/FVC比值仍然大于0.7。胸部CT扫描与后处理肺密度参数反应映射(PRM)显示HCT-OP结果不变,但显示明显的空气捕获(即32%的功能性低密度区)(图7),与BOS的诊断一致。在使用丙酸氟替卡松/沙美特罗和孟鲁司特后,患者呼吸困难有所改善, PFT趋势也有所改善(图6A)。
病例4讨论
该病例强调了HCT-OP治疗的复杂性和治疗过程中可能出现的临床问题,包括以下情况:(i)在皮质类固醇减量期间HCT-OP复发;(ii)担心合并感染;(iii) BOS的发生。HCT患者的复杂性需要在引入更强化的免疫抑制时确定风险和收益,包括感染和恶性肿瘤复发。在开始免疫抑制治疗时应让移植团队参与,以确保适当的感染预防,并充分考虑药物相互作用。正如本例所示,虽然增加皮质类固醇最初改善HCT-OP,但也增加患者感染的风险,导致不良后果和临床周折。对于正在进行的HCT-OP,快速的皮质类固醇减量似乎是违反直觉的,但在多学科讨论的指导下,患者最终通过修改治疗方案获得有意义的恢复。
限制性通气模式和DLCO降低是HCT-OP的标志性PFT表现;这与BOS相反,其特征为FEV1降低和阻塞性肺活量模式。这两种不同的模式有助于疾病表型分型,并指导检查和管理。然而除了BOS和HCT-OP外,HCT患者还容易发生其他肺部并发症,如药物性肺炎和躯干硬化;这些疾病过程并不相互排斥。这些疾病的合并可能导致一个单独的PFT指标下降或FEV1、FVC和DLCO的联合下降,从而对准确表型构成挑战。BOS的放射学特征,如呼气CT显示的小气道增厚和空气滞留,可能在伴随HCT-OP时不明显,取决于操作经验。认识到这些局限性,研究已表明使用PRM分析动态胸部CT扫描的价值,它可以通过吸气和呼气之间的逐体素比较来评估肺部衰减的变化,从而对肺实质的阻塞性和限制性疾病进行定性和定量分析。目前已经开发出一种算法来量化正常肺、空气潴积和肺实质实变的呼吸变化。通过PRM进行定量CT成像不仅提高诊断BOS的敏感性和特异性,而且有助于鉴别HCT后晚期肺部并发症。表1总结了 HCT后不同非感染性肺部并发症的PFT模式和PRM结果
结论
尽管最近对 BOS的认识和处理有了改进,但由于缺乏统一的定义、诊断标准及其与非 HCT-OP的表现和临床病程的混淆,阻碍了 HCT-OP的进展。这种不明确导致对其流行病学的了解也有限(包括报告的发病率和患病率的差异),并妨碍了对其危险因素的明确理解。本文所概述的HCT-OP的方法和治疗策略来源于单中心经验,鉴于患者概况和移植实践的差异,可能不广泛适用。这也强调了开展大型多中心研究的必要性,以确定作者提出的方法的可行性和疗效。然而至少来说,作者的病例系列是为HCT-OP提供结构化护理模型的初步努力。HCT-OP的独特特征和GVHD患者多器官累及的复杂性需要肺科、胸部放射学、移植和传染病临床医生之间的多学科合作,以便进行适当的疾病检测,仔细选择免疫抑制剂,监测和评估其他HCT或治疗相关的合并症。为了改善这一严重疾病的结局,还需要对上述各个领域进行进一步研究。
参考文献
Yu Kuang Lai , Husham Sharifi , Joe L Hsu.How I diagnose and treat organizing pneumonia in hematopoietic cell transplant recipients.Blood . 2024 Sep 5;144(10):1048-1060. doi: 10.1182/blood.2023023249.


