特别关注|不同来源的细胞外囊泡在肝细胞癌发生进展中的作用治新思路
时间:2024-08-15 18:00:27 热度:37.1℃ 作者:网络
肝细胞癌(HCC)是全球第五大流行的肿瘤类型,每年至少造成78万人死亡,在患有乙型肝炎或丙型肝炎、酗酒和非酒精性脂肪性肝病的患者中,HCC更容易发生。对于早期HCC患者,手术切除是主要治疗方法,预后相对较好,然而,由于HCC发病隐蔽且在早期阶段缺乏明显的生物标志物,大多数患者在诊断时已经进展到晚期阶段,导致预后不良,因此,深度探究HCC的致病机制,寻找更为有效的治疗方法迫在眉睫。
细胞外囊泡(EV)是一种源于细胞膜的囊泡,包裹着蛋白质、核酸、脂质、代谢物,甚至来自亲代细胞的细胞器,EV通过在细胞间传递各种分子信号发挥不同的作用。根据其产生方式及分子大小的不同,EV分为外泌体、微泡和凋亡小体,这些实体缺乏自我复制能力,并通过不同的生物机制产生。外泌体的大小30~120 nm,起源于在内体成熟过程中形成的多囊泡体内的管腔内小泡,成熟的多囊泡体可以与溶酶体融合以进行降解,或与质膜融合导致管腔内小泡释放到细胞外空间。微泡是细胞直接从质膜上萌发50~1 000 nm的囊泡产生的,而凋亡小体主要由正在进行凋亡的细胞释放,大小为50~5 000 nm。EV具有广泛的生物学功能,参与各种生理和病理过程,EV通过在细胞间转移不同的分子来促进细胞间的沟通,此外,EV在复杂的生物学行为中发挥着关键作用,如肿瘤的发生,EV在HCC的发生、发展中也发挥着重要作用,然而,不同来源的EV对HCC的作用不同,本文通过总结不同来源的EV对HCC的作用,进一步了解HCC的致病机制,以期为HCC的诊断及治疗开辟新道路。
1HCC细胞来源的EV与HCC
众所周知,HCC细胞比健康细胞分泌更多的EV。这些HCC-EV在肿瘤增长、血管生成和免疫调节中发挥作用(图1)。
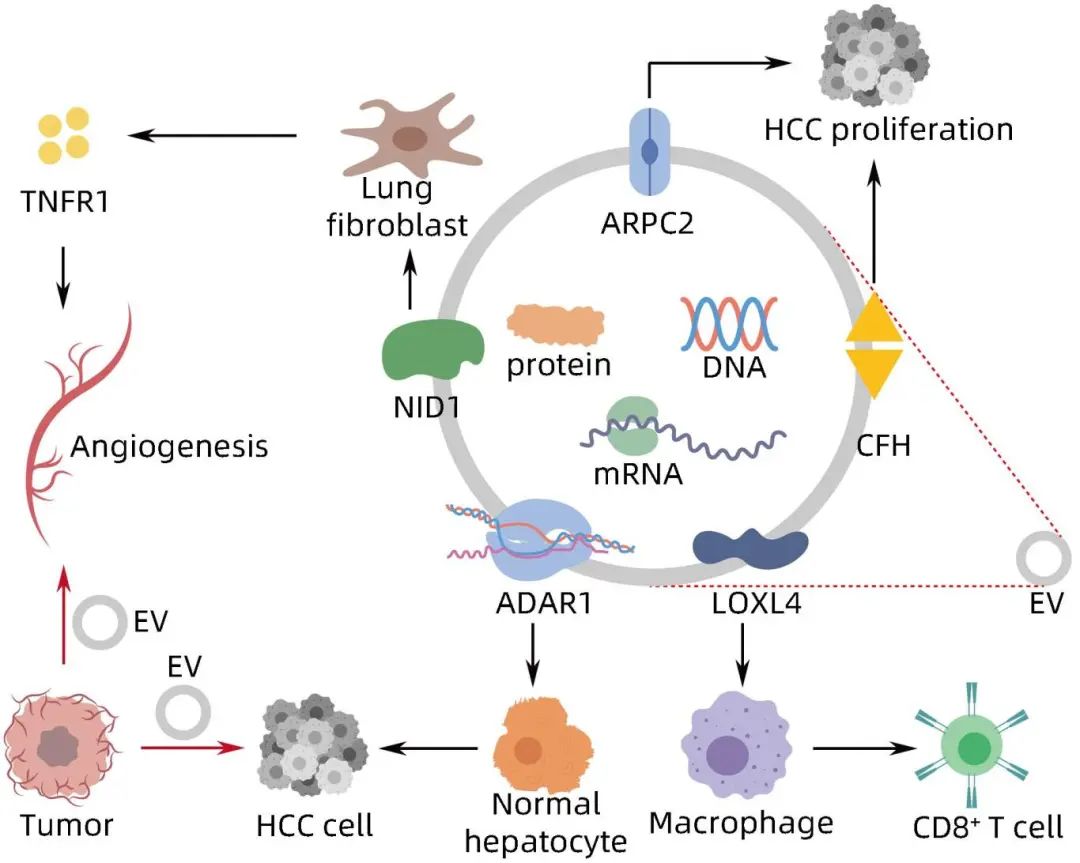
图1 HCC-EV对HCC的影响
1.1 EV可促进HCC免疫逃逸
免疫逃逸是导致HCC治疗困难的重要原因之一。Zhao等通过小鼠体内外实验发现,赖氨酰氧化酶样4(LOXL4)在HCC的免疫逃逸和致瘤性方面发挥着重要作用,进一步通过构建小鼠HCC原位异种移植模型发现,HCC的免疫逃逸及致瘤性是由于来源于肿瘤细胞的EV通过递送LOXL4来实现的,体外实验证明,LOXL4可诱导巨噬细胞中程序性死亡配体1(PD-L1)的表达,并通过激活信号转导与转录激活因子1(STAT1)引起免疫抑制。体内实验也验证了HCC细胞衍生的EV通过递送LOXL4促进了HCC细胞的免疫逃逸和致瘤性。LOXL4通过EV递送到巨噬细胞中,通过激活STAT1诱导PD-L1,抑制CD8+T淋巴细胞对HCC细胞的杀伤能力,从而促进HCC的免疫逃逸。补体系统与肿瘤细胞的免疫监视密切相关,HCC-EV含有大量补体蛋白,补体因子H(CFH)是一种丰富的可溶性血清蛋白,可帮助肿瘤细胞免疫逃逸,其在HCC细胞系的EV中高表达,并且通过实验发现,与非转移型HCC细胞系的EV相比,转移型HCC细胞EV中CFH的表达水平更高,这就说明富含CFH的EV不但可以促进HCC的免疫逃逸,而且可以促进HCC细胞增殖,并且赋予HCC细胞转移能力。
1.2 EV可促进HCC增殖及转移
HCC-EV介导microRNA,促进HCC的增殖及转移。研究发现,miR-3129在HCC患者血浆EV中高表达,EV携带miR-3129进入HCC细胞中,促进了HCC细胞的恶性生物学行为。此外,作用于RNA-1的腺苷脱氨酶(ADAR1)是一种RNA编辑酶,EV中常常包含ADAR1,含有ADAR1的EV扩散到HCC细胞,同时也扩散到相邻非癌细胞中,ADAR在与肿瘤的发生、发展有关的AZIN1残基367处进行编辑,导致AZIN1 RNA突变,进而引起HCC扩散及预后不良。HCC晚期常常伴有转移,而肺是HCC肝外转移常见部位,研究发现,HCC-EV促进血管生成,并导致肿瘤细胞在肺部定植,而这种作用是由于携带巢蛋白1的EV通过激活肺成纤维细胞进而分泌肿瘤坏死因子受体1来实现的。此外,肌动蛋白相关蛋白2/3复合物亚基2(ARPC2)在转移性HCC细胞的EV中高度表达,而敲除APRC2发现,EV在增强肿瘤细胞的生长、运动和转移方面的活性被抑制,这就说明含有APRC2的EV促进HCC的生长及转移。
1.3 EV可促进HCC侵袭
研究发现,减少Rab20的表达可以促进EV的分泌,进而促进了HCC细胞的侵袭性及肿瘤的转移,这种作用是由于低表达Rab20导致HCC细胞释放的EV中磷酸丙糖异构酶1(TPI1)水平降低,众所周知,TPI1促进糖酵解,进而促进细胞代谢,而EV中TPI1的减少意味着细胞糖代谢过程重编,进而促进肿瘤进展。热休克蛋白90一直是癌症治疗的重要治疗靶点,热休克蛋白90抑制剂STA9090可以诱导肝癌细胞EV的产生,促进HCC侵袭,这种作用与空泡分选蛋白35(Vps35)相关,Vps35与Bcl-2相关转录因子1(Bclaf1)蛋白水平呈正相关,Bclaf1通过Vps35的正调控促进STA9090诱导的EV引起的侵袭能力,进而调控HCC转移,由此可见,STA9090通过Bclaf1-Vps35-EV轴促进HCC侵袭及转移。
2M2型肿瘤相关巨噬细胞(TAM)来源的EV与HCC
TAM存在于HCC的微环境中,通过激活一些信号通路极化为M1或M2细胞,M1 TAM被IFN-γ、LPS激活,并分泌促炎细胞因子,如IL-1β和IL-12,以及NO、ROS和各种趋化因子受体配体。M2 TAM被IL-4、IL-13激活,分泌高水平的抗炎细胞因子如IL-10,并表达相关的趋化因子以启动抗炎机制,M1和M2又可以通过交换信号因子相互转化。极化为M2 TAM常常与恶性生物学行为相关。M2 TAM分泌的EV通过抑制免疫反应促进HCC的发生。
Lv等收集HCC及健康志愿者血清通过提取EV发现,1号染色体上的局灶扩增lncRNA FALEC在HCC患者的血清EV中高表达,并且发现富含FALEC的EV诱导巨噬细胞M2极化,通过激活Wnt/β-catenin信号通路促进HCC恶性生物学行为。此外,肿瘤细胞来源的EV可以将lncRNA PART1递送至巨噬细胞,导致HCC进展中的M2巨噬细胞极化,促进HCC的增殖、迁移及侵袭,这种作用是由于HCC细胞来源的EV通过抑制miR-372-3p来上调Toll样受体4,从而促进HCC中的巨噬细胞M2极化导致HCC的进展,EV还可以将miRNA递送至肿瘤细胞,促进肿瘤的侵袭进展。M2极化的巨噬细胞产生的EV中miR-15b高表达,EV将miR-15b转移到HCC细胞中,导致大肿瘤抑制激酶1下调,促进HCC细胞的增殖、迁移和侵袭。Ning等研究发现,TGF-β1/BMP-7通路的激活促进了HCC的侵袭与干性,进一步研究发现,TGF-β1/BMP-7通路的激活离不开M2巨噬细胞来源的EV,含有miR-17-92的M2巨噬细胞EV将miR-17-92递送至HCC细胞,通过激活TGF-β1/BMP-7通路加剧了HCC的恶行生物学行为。
此外,M2巨噬细胞来源的EV诱导HCC免疫逃逸,通过构建HCC小鼠模型探索M2巨噬细胞来源的EV对HCC中的作用发现,M2巨噬细胞来源的EV促进HCC的肿瘤进展,并且通过免疫组化实验发现,与健康小鼠组织相比,HCC组织中CD8+T淋巴细胞数量减少,这是由于巨噬细胞来源的EV通过携带miR-21-5p促进HCC小鼠的CD8+T淋巴细胞耗竭,进而减少对HCC细胞的杀伤能力,造成HCC细胞免疫逃逸。同时,将M2巨噬细胞来源的EV与CD8+T淋巴细胞在HCC细胞中共培养也发现了这一现象。由此可见,M2 TAM-EV促进了HCC的生长、侵袭及免疫逃逸(图2)。
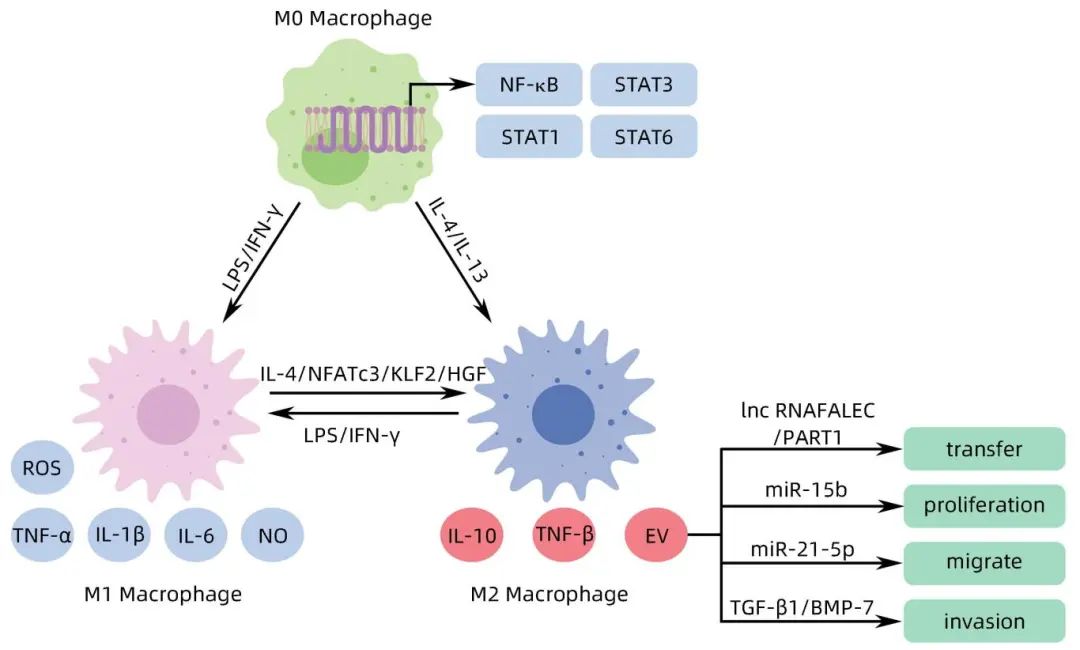
图2 M1/M2巨噬细胞极化及M2 TAM-EV对HCC的影响
3脂肪细胞来源的EV与HCC
脂肪细胞(adipocyte)为癌细胞提供各种分子,这些分子推动更高的代谢率的产生,以驱动肿瘤细胞的增殖和转移过程。Adipocyte-EV富含miR-23a/b、血管内皮因子、葡萄糖转运蛋白1和缺氧诱导因子1α。Adipocyte-EV可能通过降低抗肿瘤的miRNA-34a水平和上调致癌泛素特异肽酶7/细胞周期蛋白A2信号通路来诱导细胞增殖,从而促进肿瘤的生长。由此可见,Adipocyte-EV可以促进HCC的恶性生物学行为。
4骨髓间充质干细胞(BMSC)来源的EV与HCC
BMSC存在于许多组织中,其治疗价值已在多种癌症中被报道,包括HCC。BMSC-EV可以促进HCC细胞的凋亡,这种作用通过过表达miR-20a-3p后被增强,可见携带miR-20a-3p的BMSC-EV增强了HCC细胞杀伤作用,此外,通过进一步体内和体外研究发现,BMSC-EV携带的miR-20a-3p靶向抗凋亡蛋白c-FLIP并增加HCC细胞中TNF相关的凋亡诱导配体(TRAIL)的水平,从而促进与TNF相关的凋亡诱导配体有关的细胞凋亡。
CD38在促进肿瘤细胞生长及免疫逃逸方面发挥着重要作用。CD38在HCC组织及细胞中高表达,据报道,抑制CD38的表达可能逆转HCC进展。研究者将BMSC-EV通过电穿孔加载至siCD38并与HCC细胞共培养发现,EV/siCD38处理的HCC细胞中CD38表达降低,进一步小鼠实验发现,注射EV/siCD38的小鼠肿瘤体积和重量减少,此外,EV/siCD38还可以逆转小鼠对PD-1/PD-L1抑制剂的耐药性。由于BMSC-EV携带miR-125b可以减少HCC细胞的增殖及侵袭,研究者通过基因工程将miR-125b加载至EV与HCC细胞共培养,发现与对照组相比,HCC细胞生成减少,并且HCC细胞增殖减少。由此可见,BMSC-EV可以促进HCC细胞凋亡,减少HCC细胞的增殖及侵袭,并且可以逆转耐药性。
5总结及展望
综上所述,EV已成为HCC发病机制中的重要因素,肿瘤细胞分泌的EV可通过协助创造良好的肿瘤微环境和传递分子信息的方式刺激肿瘤细胞的生长、增殖和侵袭,M2型肿瘤相关巨噬细胞分泌的EV可通过诱导M2巨噬细胞的极化促进HCC的生长、侵袭及免疫逃逸,脂肪细胞分泌的EV通过推动更高的代谢率促进HCC的转移和进展,而BMSC分泌的EV可诱导肿瘤细胞的凋亡及减少HCC细胞的增殖及侵袭,同时可以逆转HCC的化疗耐药性(图3)。此外,EV中骨桥蛋白高表达,由此可以将EV中高水平的骨桥蛋白亚型作为诊断HCC的一种有前途的生物标志物。EV在药物递送方面也是有前景的,标准化的程序和对供体细胞类型和药物负载技术的新见解有望推动临床成功。总之,EV在HCC的发生和进展中发挥着重要作用,因此,基于EV为靶点的治疗有望成为有效治疗HCC的新方法。
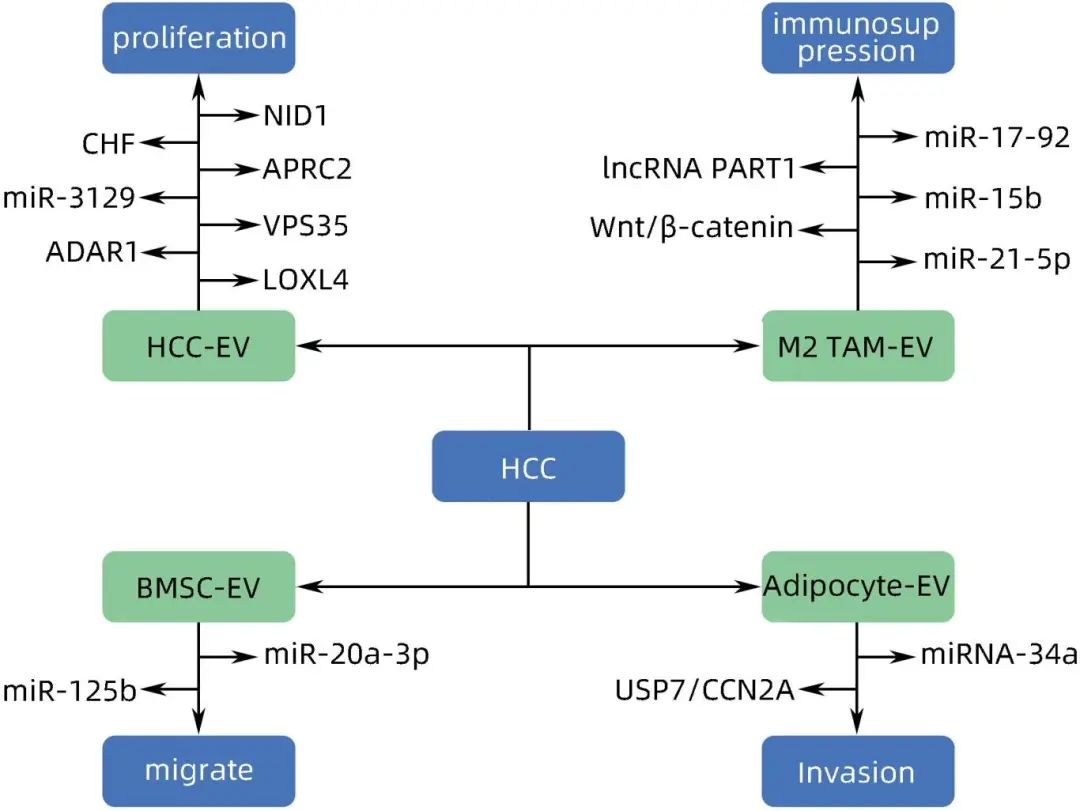
图3 不同来源的EV对HCC的影响
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240630



