用10个问题阐述CAR-T治疗血液肿瘤相关感染的预防和管理
时间:2024-08-11 06:02:23 热度:37.1℃ 作者:网络
CAR-T相关感染
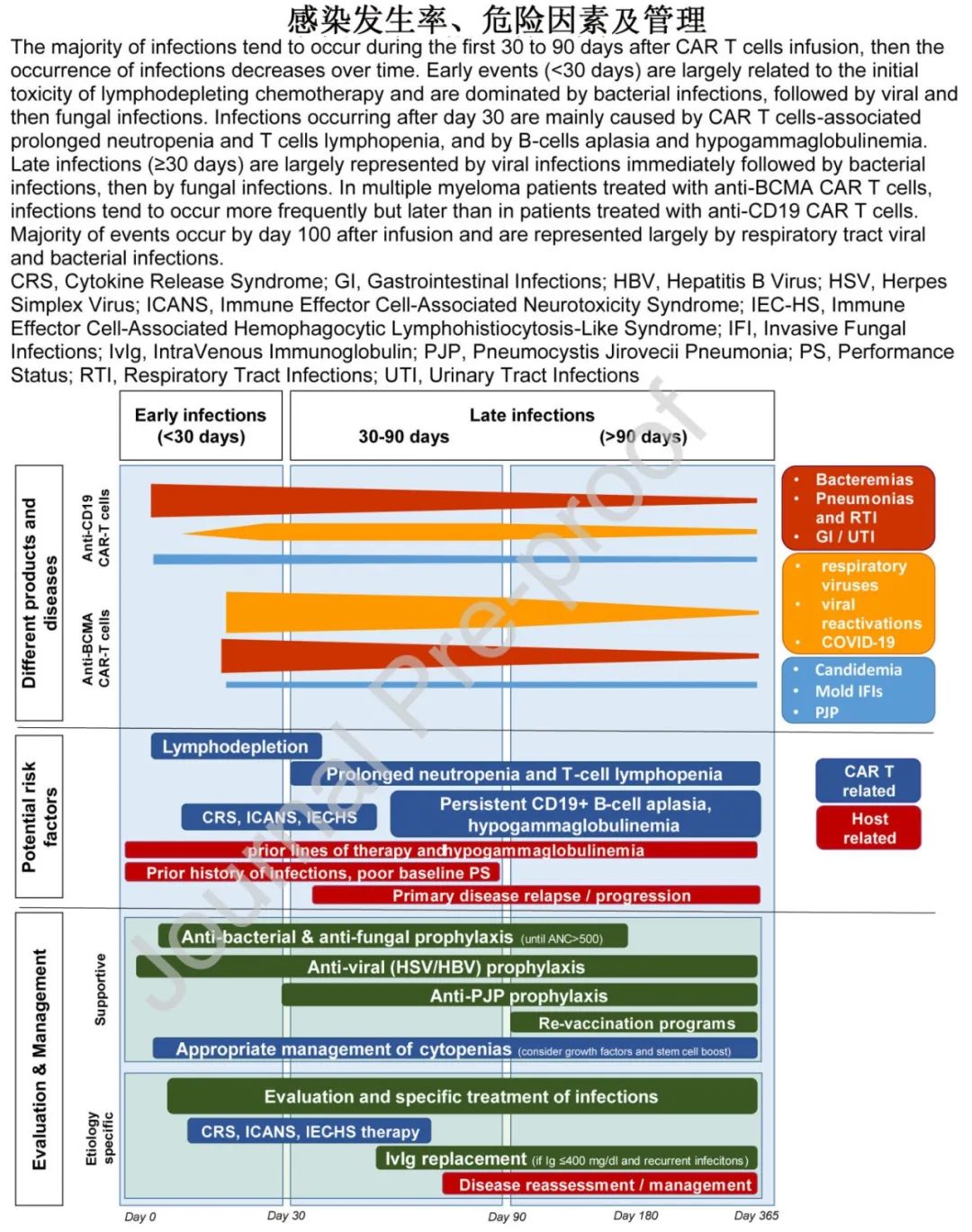
CAR-T细胞疗法是治疗血液恶性肿瘤的重大突破,包括复发或难治性(R/R) B细胞急性淋巴细胞白血病(B-ALLl)、B细胞非霍奇金淋巴瘤(NHL)和多发性骨髓瘤(MM)等。但感染也越来越得到关注,特别是在输注后前30天,并且是CAR-T治疗后非复发死亡的重要诱因。
美国移植和细胞治疗学会(ASTCT)实践指南委员会(CoPG)和ASTCT移植感染性疾病特别兴趣工作组(TID-SIG)牵头组成专家组,确定了CAR-T细胞治疗后感染管理中的关键挑战,探讨了十个关键的临床实践问题,并制定了最佳实践建议指南,目前处于《Transplantation and Cellular Therapy》的pre-proof阶段。

问题1:CAR-T治疗后的感染频率如何?
近期一项大型META分析显示成人中为33.8%,其中重度(≥3级)为16.2%,导致的死亡率为1.8%。另一项儿童、青少年和年轻成人(CAYA)的研究结果相似,为22%-40%。感染的类型可能随着时间的推移而变化,取决于免疫恢复的速度,也可能根据潜在疾病和CAR-T细胞产物的类型而有所不同。
• CD19 CAR-T:
o前30天感染率更高,细菌感染往往在前30天更频繁。
o 30天后呼吸道病毒感染最为常见
o真菌感染<6%,而病毒再激活(单纯疱疹病毒(HSV)、水痘带状疱疹病毒(VZV)、人类疱疹病毒-6 (HHV-6)、巨细胞病毒(CMV)、腺病毒罕见,但可发生于30天之前和之后(阿昔洛韦预防是常见的做法)。
• BCMA CAR-T:
o骨髓瘤临床试验中报告的感染率高达58%-69% (20%-48%为≥3级),但发生时间比CD19 CAR-T细胞治疗后报告的时间晚(中位46-60天);感染密度在第30-100天之间最高,超过100天就会下降
o呼吸道病毒感染在第30天前后普遍存在
o真菌感染罕见(<5%),病毒再激活(EB病毒、巨细胞病毒、乙型肝炎病毒、VZV)很少观察到
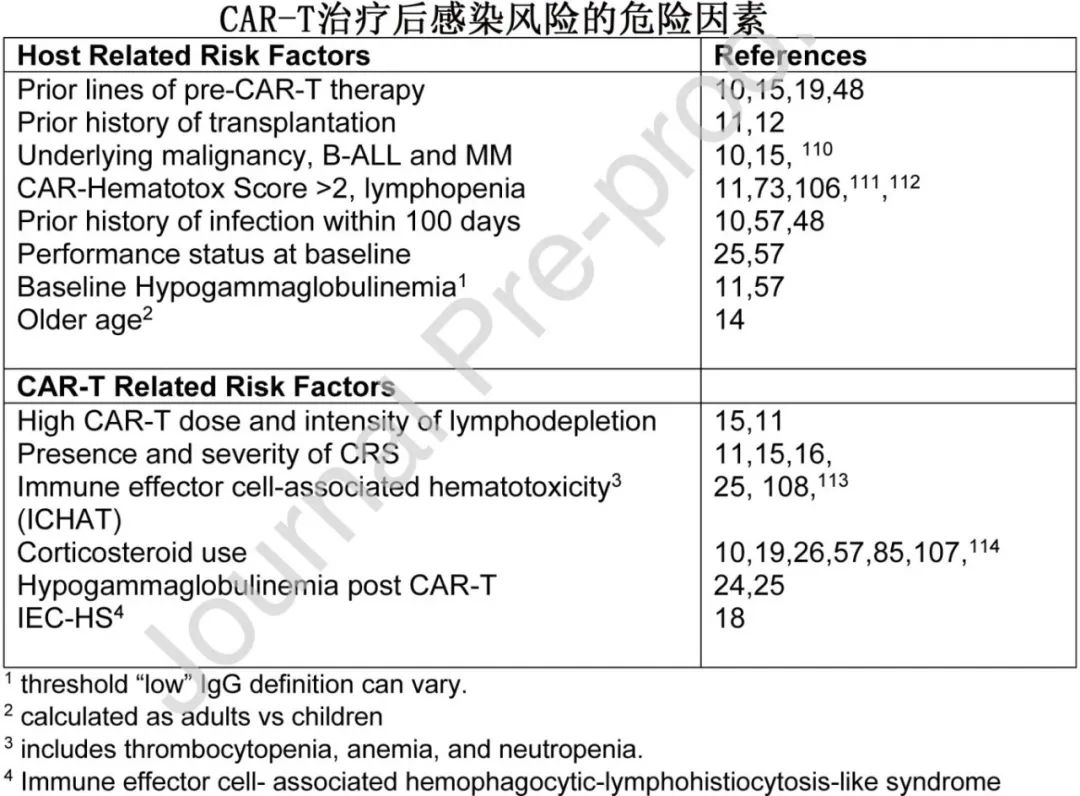
问题2:CAR-T治疗后感染的危险因素?
问题3:CAR-T治疗前的感染筛查?
所有患者在进行清淋化疗和CAR-T细胞输注前应接受详细的病史(包括疫苗接种)和体格检查。任何新的症状和/或身体检查结果应彻底调查,并酌情咨询传染病(ID)。如果确定感染,建议进行多学科讨论,讨论清淋疗法感染进展的风险与潜在恶性肿瘤进展的风险,以决定最佳方法。
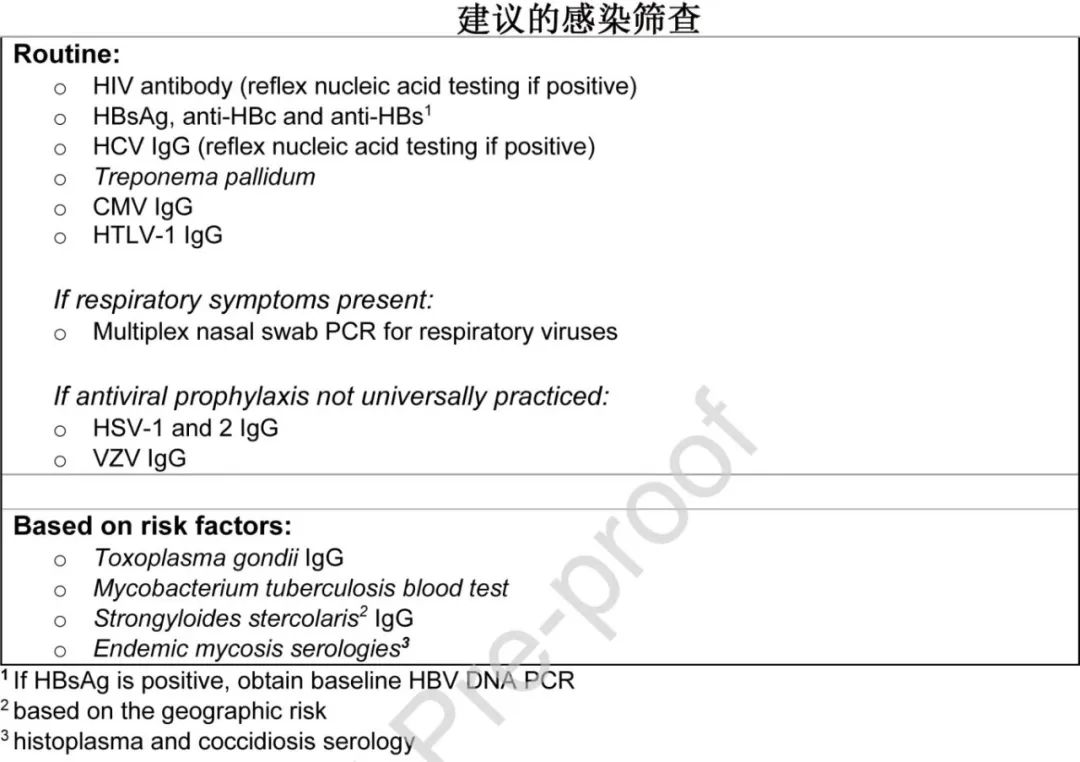
•CAR-T细胞治疗前的常规筛查:
o实验室筛查应包括HIV抗体(最好是第四代抗原/抗体组合)、乙型肝炎病毒表面抗体(抗HBs)和抗原(HBsAg)、乙型肝炎病毒核心抗体(抗HBc)、丙型肝炎病毒抗体(抗HCV),如果阳性则进行核酸检测;基于危险因素进行梅毒螺旋体检测(根据机构指南进行密螺旋体或非密螺旋体检测筛查)。
o HBsAg阳性患者应进行基线HBV DNA检测。
o有呼吸道症状的患者应通过多重病毒PCR检测呼吸道病毒,包括SARS-CoV-2,并根据指示进行肺部影像学检查。筛查无症状成年患者的效用尚不清楚,CAYA的实践正在发展,许多中心仅检测有症状的患者。有严重症状的下呼吸道感染,特别是SARS-CoV-2感染,应延迟至临床好转;ASTCT指南建议对有症状感染的患者延迟14-20天。如果认为延迟CAR-T细胞治疗对潜在恶性肿瘤的进展风险太高,则无症状或轻度呼吸道病毒感染的患者可能会继续进行治疗;建议进行包括传染病专业知识在内的多学科讨论。
•如果已知危险因素存在,则进行患者特异性筛查:
o结核分枝杆菌检测:对于来自流行地区的患者,如果皮肤或血液结核检测呈阴性,应在淋巴细胞减少和/或既往广泛的清淋化疗的背景下谨慎解释。
o粪类圆线虫抗体筛查(与伊维菌素经验性治疗相比),因为 CRS 和/或 ICANS 治疗的潜在高剂量皮质类固醇增加过度感染综合征(hyperinfection syndrome)的风险。
o有暴露史患者检验弓形虫血清学。
o仅当预防这些病毒未得到普遍实施时,才检查HSV1、HSV2和 VZV 血清学。此外,考虑检测 CMV 和人 T 细胞嗜淋巴细胞病毒 (HTLV-1) 血清状态。
问题4:CAR-T治疗后的抗菌预防有哪些?
尚无相关临床标准。CAR-T细胞输注后的前30天感染风险最高,可能与中性粒细胞减少和治疗CRS和/或ICANS所需的进一步免疫抑制有关。大多数中心从造血细胞移植(HCT)和专家意见中推断出预防建议,但在药物、时间和持续时间上存在差异。总体策略考虑对细菌、氏肺囊虫、某些病毒和真菌的预防,并提供建议的停止标准。
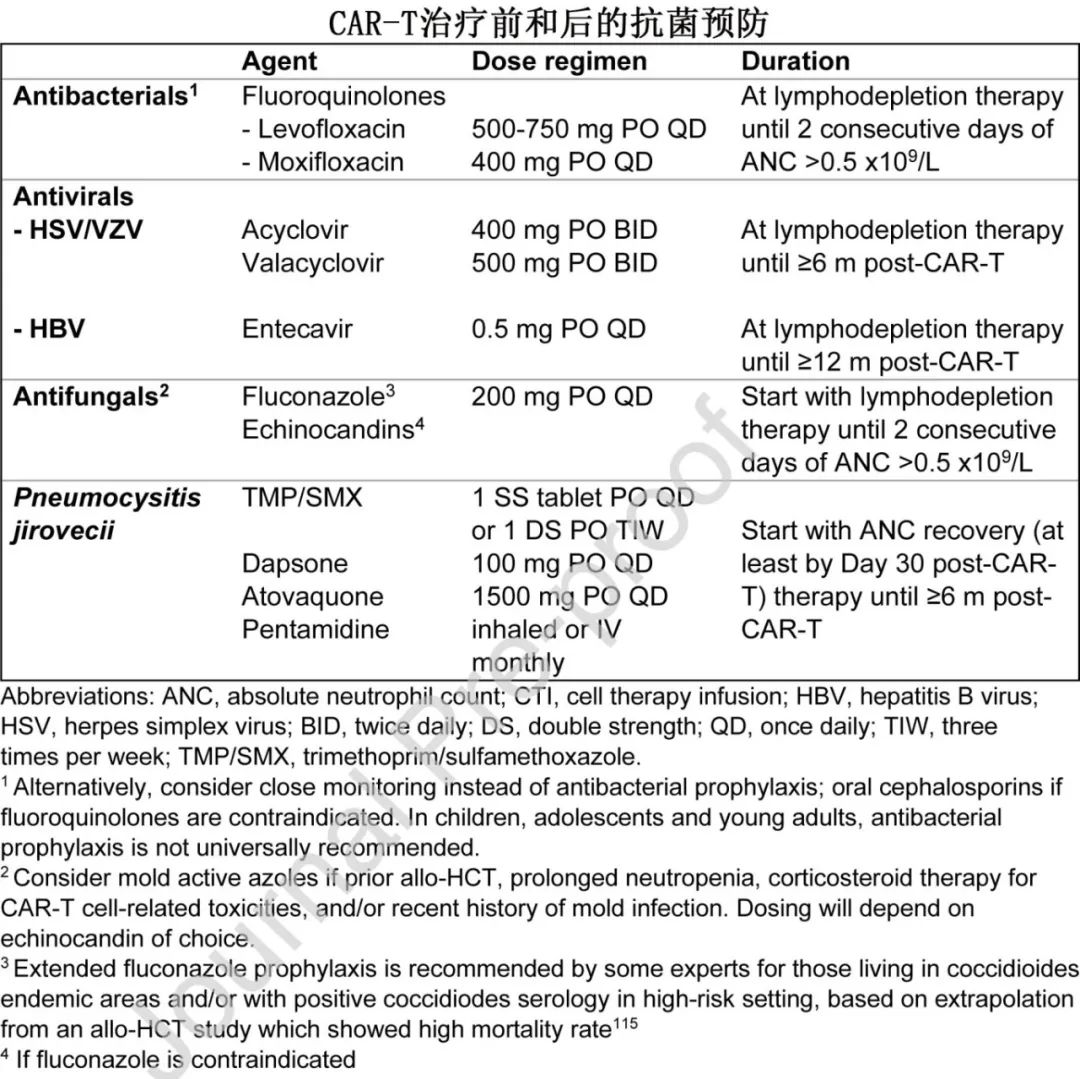
•抗菌
o氟喹诺酮类药物(或第3代口服头孢菌素)常规预防仍存在争议。部分进行住院 CAR-T 细胞治疗的中心也考虑对中性粒细胞减少性发热患者进行仔细监测并开始静脉注射抗生素;所有儿科研究均未采用抗菌预防。
o在门诊环境中,可考虑在预期的中性粒细胞减少症期间至计数恢复期间(连续2天ANC>0.5 ×109/L)进行氟喹诺酮类药物预防治疗。
o 11%-17% 的 CAR-T 治疗患者在第30天后出现持续性血细胞减少(有时≥3个月,无疾病复发或骨髓发育不良的证据),可能需要更长时间的预防治疗。
•抗病毒
o从清淋治疗开始至输注后至少6个月,应使用阿昔洛韦或伐昔洛韦预防 HSV 和VZV。儿科人群的给药持续时间通常较短(通常为3个月,临床研究中为1-6个月)。由于阿昔洛韦预防治疗,HSV/VZV感染率较低 (见问题1)。如果不进行抗病毒预防,疱疹病毒感染的发生率高达50%,尤其是VZV(中位至发病时间79天,范围49-723天)。
o目前没有足够的数据支持 CMV 血清阳性患者 CMV 预防的建议。在 CMV 病毒载量治疗阈值升高但无 CMV 疾病的患者中,应要求传染病会诊进行进一步管理。
o 尽管不建议对CMV、EBV和 HHV-6 进行常规监测,但在特殊人群中可考虑进行针对性监测(见问题6)。
o 乙型肝炎表面抗原 (HBsAg) 检测呈阳性的患者应从清淋化疗开始接受恩替卡韦0.5 mg每日一次,直至 CAR-T 后至少≥12个月;提前停药可导致致死性再激活。
o 慢性 HBV 携带者(HBsAg阴性,抗HBc 阳性)HCT后再激活的2年累积风险为40.8%。通过外推,他们应在 CAR-T 细胞治疗中接受预防治疗,或每月监测 HBV DNA 和肝酶以检测早期再激活,如果再激活则开始治疗。
o 慢性丙型肝炎病毒 (HCV) 患者应转诊至肝病科,以进一步评价是否直接抗病毒 (DAA) 治疗。
o 鉴于关于 CAR-T 细胞治疗人类免疫缺陷病毒 (HIV) 患者结局的数据有限,应在开始清淋前咨询 HIV 专家控制病毒载量。患者应继续抗逆转录病毒治疗,尽量减少中断。
•抗真菌
o 对于实行普遍抗真菌预防的中心,氟康唑可以从清淋开始,覆盖中性粒细胞减少期,直至中性粒细胞恢复。
o由于侵袭性真菌感染 (IFI) 的发生率从0%到15%不等,可根据风险因素(包括持续性中性粒细胞减少症、重度CRS、接受高剂量皮质类固醇和曲霉病发生率>6%的中心)考虑对特定患者进行霉菌活性抗真菌预防,包括儿童。CAR-T 细胞治疗前给予BTK抑制剂也可能增加治疗后 IFI 的风险。
o建议在 CAR-T 细胞输注后开始使用甲氧苄啶磺胺甲恶唑 (TMP/SMX) 预防耶氏肺孢子虫 (PJP),直至至少6个月。这是基于一项研究显示,当在3个月时常规停止预防时,40例患者中有2例在 CAR-T 细胞治疗后 <6个月发生 PJP 肺炎;所有病例均为重度,需要机械通气。CD4+ T细胞总数是否应指导停止预防尚不清楚,但部分中心采用 < 200个/mm3 的阈值来指导持续时间。对于长期血细胞减少的患者,考虑使用骨髓抑制性较低的替代药物。
问题5:CAR-T治疗前近期发生感染的患者如何管理?
缺乏前瞻性或大规模回顾性研究数据来为进行清淋和CAR-T细胞输注并伴有活动性感染的风险评估提供信息,这意味着医疗决策主要基于一般原则和其他数据的推断。清淋后100天内的感染与CAR-T输注后30天内感染风险增加有关。一项针对接受CD19 CAR-T细胞治疗的成年B细胞恶性肿瘤患者的研究报告称,基线肠道微生物组组成与临床反应相关,先前使用广谱抗生素治疗与更差的生存率和增加的神经毒性相关。综合这些重要意见,小组的建议为:
•与肿瘤学家合作,让ID专家参与资格筛选、制定计划,平衡进行CAR-T细胞治疗的紧迫性与CAR-T胞输注后的发病率,包括感染风险。
•如果可能,延迟治疗直到感染得到控制。
••如果进行CAR-T细胞治疗,则调整定制治疗或相应预防。
•针对清淋后患者感染风险高的感染制定监测计划。
问题6:监测哪些感染以及CAR-T治疗后监测多久?
患者应在每次随访时进行病史和体检,以确保没有活动性感染。对真菌感染高风险的患者应进行临床监测,并在适当的情况下考虑开始抗霉菌预防。
关于接受CAR-T细胞治疗的患者中CMV、HHV-6、EBV和腺病毒等病毒感染的流行病学和临床意义的数据有限。前瞻性巨细胞病毒监测显示,再激活率高达25%,在BCMA CAR-T和使用类固醇>3天的患者中风险更高。CRS和ICANS的治疗通常需要多天的皮质类固醇和免疫抑制治疗,可增加了病毒再激活和感染的风险。免疫效应细胞相关噬血细胞淋巴组织细胞增多症样综合征(IEC-HS)是CAR-T疗法的另一种毒性,需要显著的免疫抑制,导致病毒感染的风险增加。没有终末器官疾病的情况下,管理巨细胞病毒再激活和其他病毒的最佳方法仍不确定,因为治疗阈值未知。
对于巨细胞病毒再激活风险较高的患者,如既往有巨细胞病毒再激活史、使用皮质类固醇>3天、接受BCMA CAR-T产品以及在CAR-T细胞治疗前接受更多化疗的患者,可以考虑在CAR-T输注后的前2-6周每周监测巨细胞病毒。另一个例子是接受过大量治疗的儿科ALL患者或因CAR-T细胞毒性而接受长期免疫抑制治疗的患者。治疗的决定取决于临床情况和机构实践。
专家组不推荐常规进行EBV、HHV-6和腺病毒PCR监测。某些研究方案可能需要升级清淋或T细胞消耗策略,特别是在异基因CAR中,可能是病毒再激活的高风险环境;这种情况下可能需要进行额外的筛查。
建议:
•患者应在基线时进行巨细胞病毒血清学检查
•对于病毒再激活或感染风险高的患者,或有其他诊断无法解释的感染或神经症状后遗症的患者,应检查病毒聚合酶链反应
问题7:CAR-T后发热如何管理?
CAR-T输注后发热率为24%-94%,其中CRS是常见诱因。CAR-T多于CAR-T后1-2周发生,中位至发作时间2-3天。用IL-6和/或类固醇治疗CRS可能改变或掩盖感染的临床表现,特别是在伴有中性粒细胞减少的情况下。区分CRS和严重感染的细胞因子谱分析仍在发展中,尚未常规用于临床决策。
CAR-T细胞输注后30天内发热,无论中性粒细胞计数如何,均应提示感染性检查。应考虑尽早进行ID咨询,并根据临床情况进行血液培养、尿液分析、尿液培养、放射影像学和其他检查(如艰难梭菌粪便检查、上呼吸道呼吸道病原体检查)。与CAR-T细胞治疗相关的肺毒性可以模拟感染,而支气管肺泡灌洗有助于诊断。
鉴于CAR-T细胞治疗后早期细菌感染占主导,根据治疗发热和中性粒细胞减少症的机构指南,应快速启动广谱抗生素治疗。如果有临床和/或微生物学证据表明存在感染,可以修改抗菌治疗。如果呼吸道病毒感染被确定为发热的来源,其管理应遵循血液恶性肿瘤和TCT患者的指南。在密切监测的情况下,降低抗生素剂量的策略可能是安全的,如果没有临床感染怀疑并且发热消退,可以考虑采用这种策略。
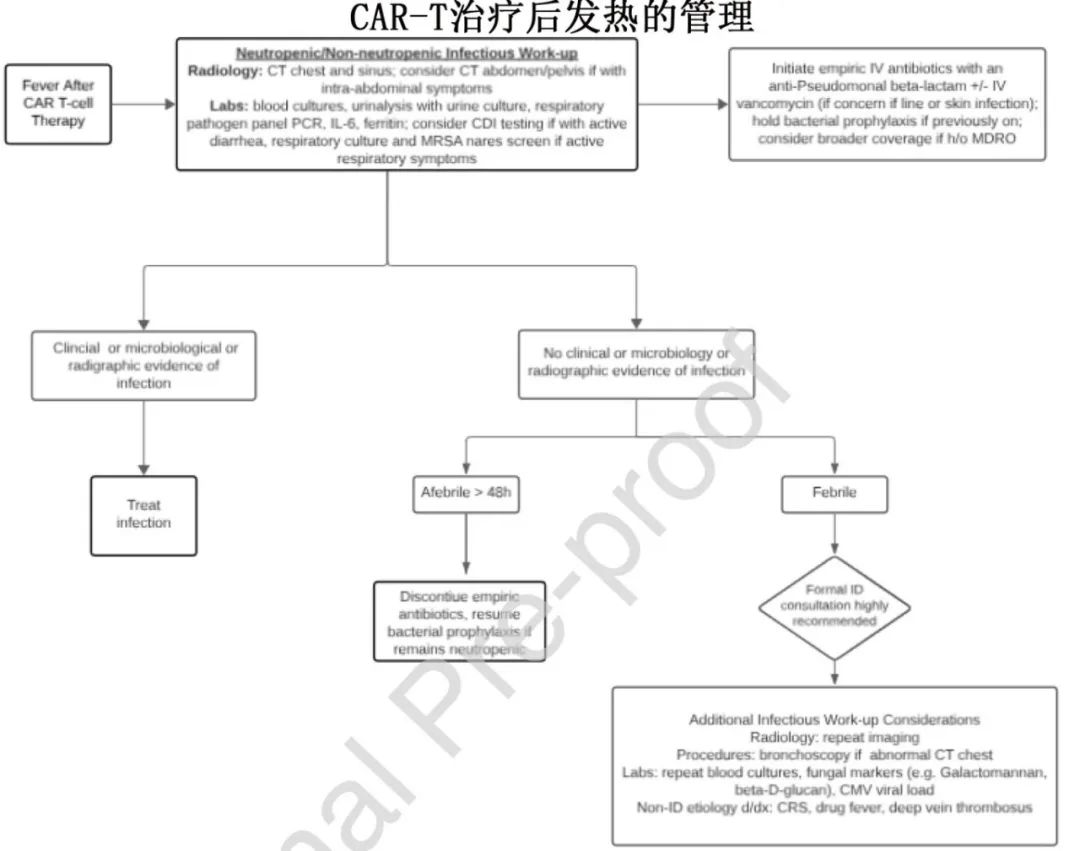
建议:
•由于CRS治疗可以掩盖发热,临床应高度怀疑感染,应考虑早期进行ID咨询。
•CAR-T细胞输注后发热应保证及时的感染性检查和启动广谱抗生素。
问题8:低丙球蛋白血症如何治疗?
低丙球蛋白血症可增加感染风险,尤其是荚膜细菌。CD19 CAR-T治疗后的低丙球蛋白血症比例为23%-81%,其中44%可持续≥18个月。BCMA CAR-T中为69%,发生于60-90天,42%-47%持续>1年。低丙球蛋白血症可发生于CAR-T前。
CAR-T后静脉注射免疫球蛋白G (IVIG)替代治疗的建议:
缺乏随机临床试验的证据来支持CAR-T细胞治疗后经验性IVIG替代治疗。由于CAR-T细胞产品、患者人口统计学和IVIG实践指南的差异,数据有限和且研究异质性,难以对比。虽然有机构对IgG≤400 mg/dL的患者给予IVIG,但其他机构要求患者有复发或严重感染史。建议儿童、青少年和年轻人在IgG≤400mg/d时进行常规替代治疗。
•对于 B 细胞恶性肿瘤,建议在 CAR-T 细胞治疗前和治疗后前3个月测定血清免疫球蛋白G(IgG)。可考虑在清淋开始前数周内给予IVIG,如果有复发性感染和持续性低丙球蛋白血症既往史,可作为输注后的预防治疗。
•建议在出现严重或复发性细菌感染,特别是累及窦肺道的IgG≤400的患者中考虑使用IVIG。
•在前3个月后,IgG≤400 mg/dL且未发生感染的患者可在密切监测下停用IVIG。对于出现复发性或重度细菌感染的 IgG 400 mg/dL-600 mg/dL 患者,可考虑补充IVIG。当IgG < 200 mg/dL时,也可考虑IVIG,尤其是当与极低的 IgA 水平相关时,与 CAR-T 细胞输注后的时间以及感染的发生率和严重程度无关。
•IgG> 600mg/dL的复发性或严重感染患者应接受额外的免疫学评价,如果特异性 IgG 亚类水平或免疫滴度较低或无保护作用,可考虑 IgG 替代治疗或疫苗接种。
•IgG补充剂应每3-4周给予400-500 mg/kg IVIG,成人IgG目标谷值 >600 mg/dL。
•如果患者尽管每月补充一次,但感染仍持续复发,可增加剂量或频率,或考虑皮下 (SC) 给予特定的 SCIg 制剂。
•目前没有证据支持儿童停止免疫球蛋白的安全性。补充剂应每4周给予250-500 mg/kg IVIG。长期 B 细胞再生障碍性贫血的儿童可考虑 SCIg 替代治疗,目标为维持IgG> 1000mg/dL。
问题9:CAR-T治疗后的疫苗再接种?
目前的建议主要是从其他免疫功能低下和HCT人群中推断出来的,尽管有多项研究报道使用了SARS-CoV-2 mRNA疫苗。需要更多的研究来确定与CAR-T细胞治疗患者的疫苗免疫原性相关的因素,并优化再接种计划。有两点需要考虑:
•尽管与免疫功能正常的个体相比,CAR-T接受者的疫苗应答可能较低,但可能会引起体液免疫,细胞免疫应答可能更稳健,以帮助预防感染严重程度
•目前尚不清楚 CAR-T 细胞治疗对先前建立的体液免疫的影响程度,尽管在 CD19 CAR-T 细胞受者中似乎相对保存完好,但在 BCMA CAR-T 细胞治疗后较少。
问题9.1:CAR-T细胞治疗前应接种哪些疫苗?
•由于在 CAR-T 细胞治疗后可立即发生免疫应答减弱,因此除季节性灭活流感疫苗 (IIV) 和直接针对 SARS-CoV-2 的疫苗外,不建议在 CAR-T 细胞治疗前接种疫苗。
问题9.2:CAR-T细胞治疗后应接种哪些疫苗?
•建议 CAR-T 细胞受者应至少(重新)接种肺炎衣原体、甲型肝炎、乙型肝炎(如果缺乏血清保护)、破伤风、白喉和百日咳疫苗。VZV 血清阳性成人接种者或有水痘或带状疱疹病史的接种者可接种重组佐剂带状疱疹疫苗。SARS-CoV-2 疫苗接种见下文。下表为接受 CAR-T 细胞治疗的成人患者的疫苗接种方案;由于缺乏数据,未提供儿童指南。
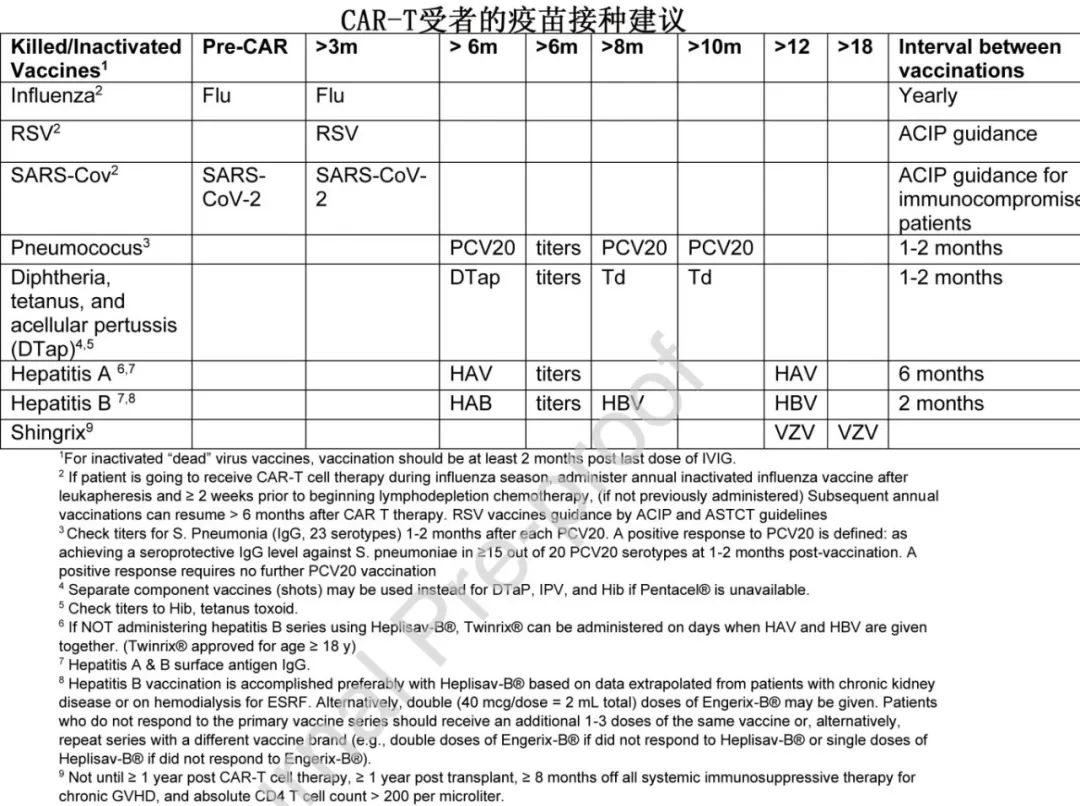
问题9.3:CAR-T细胞治疗后什么时候开始疫苗接种?
•如果 CAR-T 细胞是最终治疗且患者处于缓解期,灭活疫苗可考虑在 CAR-T 治疗后≥6个月接种,活和非活佐剂疫苗可考虑在 CAR-T 细胞治疗不再被视为免疫功能低下后≥1年接种。对于地方性或季节性感染(如流感和SARS-CoV-2),应在 CAR-T 细胞治疗后3个月左右开始接种疫苗。
问题9.4:如何处理既往 HCT 受者且未完成 HCT 后疫苗接种的 CAR-T受者?
•对于无 HCT 史或完成HCT 后全部疫苗接种的患者,如果患者对首个CAR-T细胞治疗疫苗系列(肺炎球菌结合疫苗、DTaP、甲型肝炎或乙型肝炎疫苗)产生血清保护效价,则无需额外接种疫苗。
•未完成HCT后系列疫苗接种,但对CAR-T细胞治疗后首次疫苗有阳性反应的患者应按照指示完成HCT后系列疫苗的其余部分。对首次CAR-T后细胞疫苗无反应的患者应推迟额外的疫苗接种,直到有证据表明免疫重建有所改善。
问题9.5:CAR-T细胞治疗后如何考虑 SARS-CoV-2 疫苗接种?
•尽管只有三分之一的患者对 SARS-CoV2 疫苗接种产生高水平的抗体,但 T 细胞反应似乎更频繁,延迟接种可能不会改善免疫原性。因此,目前可用的 mRNA SARS-CoV-2 疫苗系列应早在 CAR T 细胞治疗后3个月开始。患者应充分再接种基础免疫(目前 mRNA 疫苗接种3剂)和加强免疫。可能建议使用额外的加强免疫;疫苗接种时间表见疾病控制中心网站。
问题9.6:CAR-T细胞治疗后如何考虑 RSV 疫苗接种?
•两种呼吸道合胞病毒 (RSV) 疫苗最近批准用于≥60岁患者,但在 CAR-T 受者中的免疫原性和有效性尚不清楚。
问题10:预防和治疗CAR-T治疗后的感染性并发症的未来方向是什么?
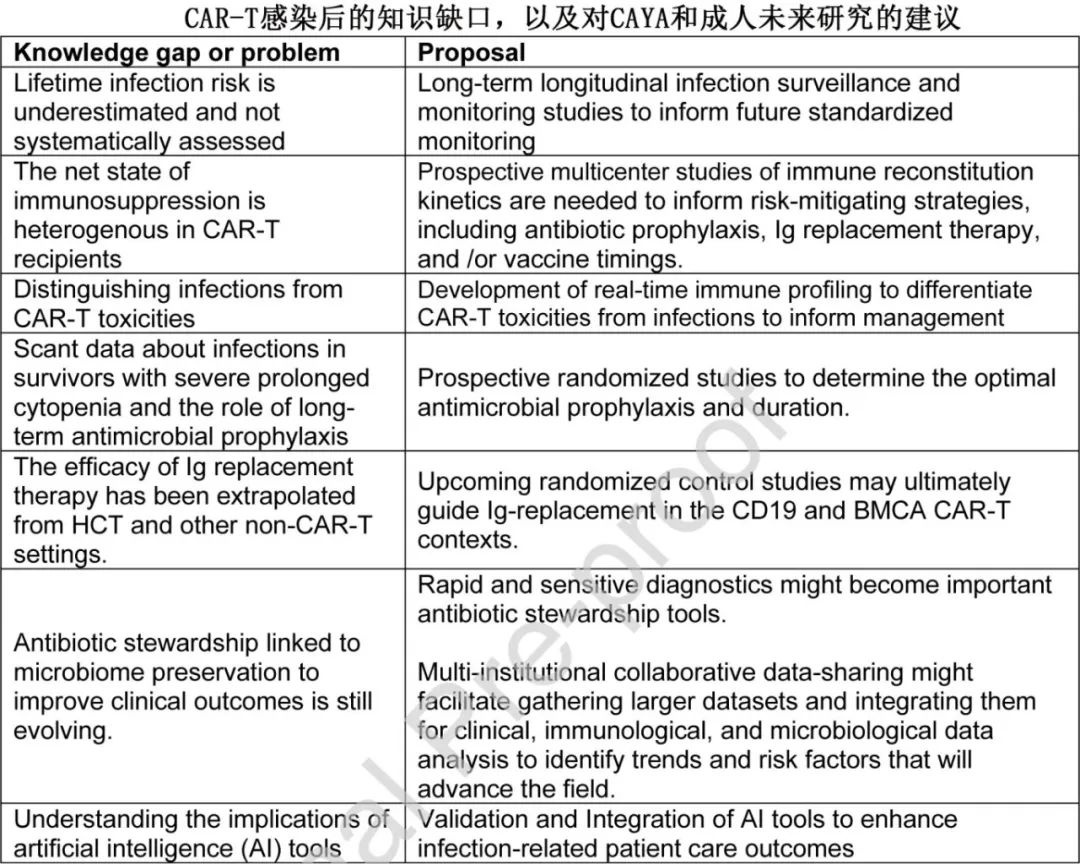
这些最佳实践考虑的证据主要来自回顾性、非对照研究,缺乏CAR-T细胞治疗后的长期随访,因此,相关的终生感染风险尚不完全清楚。CAR-T细胞治疗后的免疫抑制受多种因素的影响,免疫重建的速度各不相同。未来的研究领域和CAR-T细胞治疗知识缺口包括:
•缺乏关于感染监测或感染预防类型和持续时间的前瞻性研究。
•IgG补充的功效和最佳使用。
•确定接种疫苗的最佳时间和时间表。
•微生物群的考虑和抗生素的最佳使用。
•需要加强诊断,包括基于组学的方法,以便更好地了解免疫现象和感染风险。
•整合人工智能(AI)工具,以提高与感染相关的患者结局。
参考文献
Zainab Shahid , Tania Jain , Veronica Dioverti , Martini Pennisi , Lekha Mikkilineni , Swetha Kambhampati , Nirali N Shah , Sanjeet Dadwal , Genovefa Papanicolaou , Mehdi Hamadani , Paul A. Carpenter , Gabriela Maron Alfaro , Susan K. Seo , Joshua A. Hill , Best Practice Considerations by The American Society of Transplant and Cellular Therapy: Infection Prevention and Management after Chimeric Antigen Receptor T Cell Therapy for Hematological Malignancies, Transplantation and Cellular Therapy (2024), doi: https://doi.org/10.1016/j.jtct.2024.07.018

