TLR9激动剂与肿瘤免疫治疗
时间:2024-08-07 11:00:16 热度:37.1℃ 作者:网络
前言
模式识别受体(PRRs)是启动和维持天然免疫的核心分子,PRRs主要包括TLRs、RGR家族和cGAS-STING等。他们检测局部感染和/或组织损伤,从而防止全身感染,监视恶性细胞产生。在癌症患者中,对PD-1抑制剂产生积极响应的肿瘤表现出CD8+T细胞浸润并表达干扰素反应信号(如PD-L1),I型干扰素反应对诱导抗肿瘤免疫至关重要。
对病毒感染产生I型干扰素的主要天然免疫细胞是浆细胞样树突状细胞(pDC),其表达Toll样受体7(TLR7)和TLR9,并且经常以失活状态存在于肿瘤中。TLR7可被大多数RNA序列激活,而TLR9则被非甲基化CpG二核苷酸特异性激活,肿瘤内注射TLR激动剂可诱导干扰素反应信号和抗肿瘤CD8+T细胞,从而改善对PD-1抑制剂的耐药。因此,将TLR9激动剂与经批准的PD-1阻断疗法相结合是靶向癌症免疫逃避的有效方法。
CpG-ODN
CpG 寡聚脱氧核苷酸(CpG-ODN)是一种免疫调节合成寡核苷酸,通过特异性地刺激TLR-9,诱导细胞免疫和体液免疫,增强机体免疫应答。根据化学结构和生物学活性,CpG-ODNs可分为 A,B 和 C 3种类型。
B 型 CpG是发现最早、研究得最清楚的类型。它由一个或多个CpG基序组成,通常位于硫代磷酸酯骨架上。与天然磷酸二酯酶核苷酸相比,这种主链增强了对核酸酶消化的抵抗力,为其提供了更长的体内半衰期(30–60分钟,而磷酸二酯酶为5–10分钟)。B型CpG触发pDC分化并产生TNF-α,并刺激B细胞增殖和分泌IgM。
A 型 CpG以含有CpG 二核苷酸的回文序列为核心,两端为 poly G尾,磷酸二酯键骨架为部分硫代修饰。这类 CpG通过回文序列和 poly G 形成高级结构,能够活化 pDC 诱生大量 I 型干扰素,但对B细胞活性很弱。B型CpG与A型CpG的不同活性很大程度上是由于CpG/TLR9复合物在pDC内体中的保留时间不同。B型CpG通过早期内体快速转运到晚期内体,而A型CpG在早期内体中保留的时间更长。
C型CpG在完全由硫代磷酸核苷酸组成方面类似于B型,但在包含回文CpG基序方面类似于A型,因此可以形成茎环结构或二聚体。它兼具 A 和 B 型 CpG的活性,既能活化pDC,又能活化 B 细胞。
CpG在肿瘤的临床研究
涉及CpG的临床试验数量最多的是在肿瘤学领域。一种主要的方法是将CpG与肿瘤相关抗原(TAAs)或肿瘤细胞结合。例如,在黑色素瘤患者的MART-1肽疫苗中添加CpG导致抗原特异性CD8+T细胞的频率增加10倍。在I/II期试验中,通过在MAGE-3疫苗中添加CpG,抗MAGE-3抗体滴度得到增强,其中一名患者产生了持久的客观反应。CpG也作为转移性肾细胞癌患者的疫苗佐剂进行研究。初步结果显示,用自体肿瘤细胞、CpG和GM-CSF接种疫苗,然后用IFN-α和CpG维持治疗,在七名患者中有三名病情部分缓解或稳定。
游离CpG诱导肿瘤特异性CTL的能力也在研究中。该概念涉及将CpG递送给接受过细胞毒性肿瘤治疗(包括放疗、化疗或使用单克隆抗体治疗)的患者。在这种条件下,CpG促进肿瘤细胞释放的肿瘤抗原的摄取,并改善随后的免疫反应。对恶性胶质瘤和淋巴瘤患者的初步研究支持TLR9激动剂可以协同增强传统的抗肿瘤策略的疗效。迄今为止,这种组合显示出良好的临床益处和安全性。
CpG的另一种给药方法涉及肿瘤内注射。该策略旨在激活癌症微环境中存在的DC,从而促进原位抗原的呈递。在进行的几项临床试验中, CpG在肿瘤内递送以治疗恶性皮肤肿瘤或淋巴瘤,这些试验产生了有希望的结果。这种策略在一半的基底细胞癌或黑色素瘤患者中诱导了肿瘤的完全或部分缓解,肿瘤内给予CpG(单独或与放射治疗联合)通过改善淋巴瘤和黑色素瘤病人中肿瘤特异性CD8+T细胞的产生,诱导了全身肿瘤消退。
安全性方面,CpG 佐剂会引起轻微至中度的副反应,包括注射位点疼痛、肿胀、硬结、红疹等局部反应以及流感样症状等系统症状,几天内会得到缓解,可能是由其免疫刺激特性导致的。
HP007鸡尾酒疗法
HP007为华普生物技术公司自主开发的新型C型CpG,作为TLR9激动剂类的抗肿瘤新药,其可与TLR9受体结合,激活pDCs、CD8+T细胞和NK细胞,从而调动免疫系统的抗肿瘤活性以有效清除肿瘤细胞和阻止肿瘤转移。
今年在美国圣地亚哥举行的美国癌症研究协会(AACR)2024年年度会议报告中,SYNC-T作为一种研究性疗法,在肿瘤部位进行冷冻设备诱导肿瘤死亡,模拟原位肿瘤疫苗接种,并使用SV-102的一种固定剂量的药物组合,包括HP007、PD-1抗体、CTLA-4抗体和CD40激动性抗体。SV-102同时阻断了两种不同的免疫抑制机制,并激活了两种截然不同但又互补的免疫增强机制,使疫苗诱导的T细胞能够激活并产生系统性抗肿瘤免疫反应。
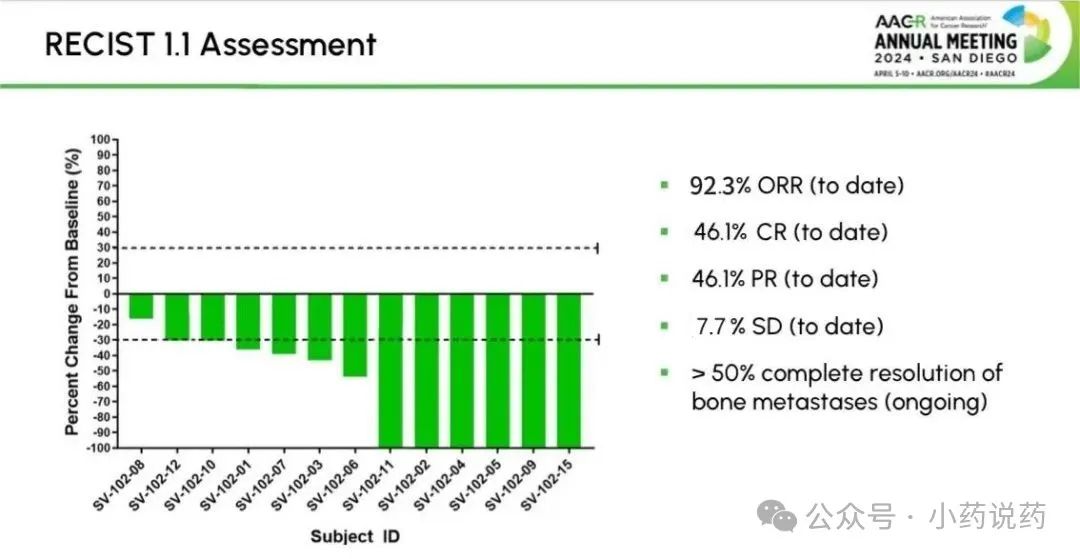
SV-102在转移性去势耐受性前列腺癌患者中表现出卓越的临床反应,在13名可评估的患者中,12人出现了客观响应,其中6人为完全响应(CR),6人部分响应(PR),总响应率(ORR)达92.3%。在数据分析时,另外两名可评估的患者病情稳定。6名患者出现轻度至中度治疗相关不良事件,包括发烧、僵硬、疲劳、发汗、血尿、尿路感染、急性尿潴留和肝酶升高。
Vidutolimod联合pembrolizumab
Vidutolimod(CMP-001)是一种CpG-a寡核苷酸,包装在由噬菌体外壳蛋白Qβ形成的病毒样颗粒内。在最近公布的一项1b期临床研究(NCT02680184)中,评估了肿瘤内注射Vidutolimod联合pembrolizumab的疗效和安全性,显示出克服晚期黑色素瘤患者的PD-1抑制剂耐药性的潜力。
在本研究的剂量递增阶段,有44名曾接受抗PD-1治疗的晚期黑色素瘤患者入组。44名患者中有11名(25%;95% CI,13%–40%)在使用RECIST v1.1的疗效评估标准进行评估时获得PR或CR,其中4名CR,7名PR。
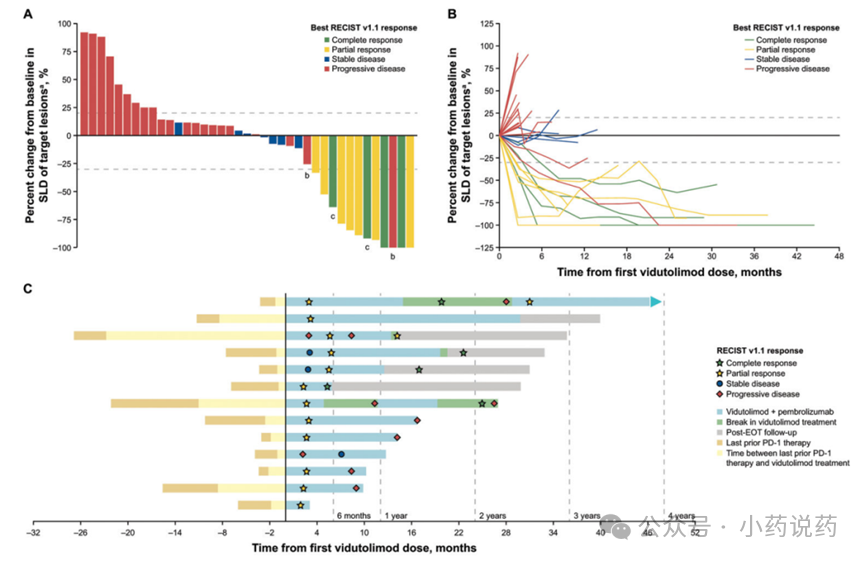
在有响应的患者中,每个受试者的平均反应持续时间(DOR)为19.5个月,包括5例反应>23个月的患者。中位缓解时间为2.5个月,中位无进展生存期(PFS)为2.8个月(95% CI, 2.7-5.4)。
安全性方面,两名患者因TRAEs停止治疗,两名患者因PD相关不良事件停止治疗。最常见的TRAEs(≥25%) 为流感样症状、低血压、注射部位疼痛和关节痛,这些都是模式识别受体激活的预期副作用。最常报告的3/4级TRAE是低血压(16%,n=7)。不良事件或TRAE的严重程度和发生率没有明显的剂量关系。
CpG肿瘤研究的其它进展
目前,除了HP007和Vidutolimod外,还有几个TLR9激动剂处于在研阶段。
Tilsotolimod是另外一个非常有希望的TLR9激动剂,由Idera Pharmaceuticals开发,获得了美国FDA的快速通道,联合Ipilimumab用于治疗抗PD-1抗体难治性黑色素瘤,以及孤儿药物资格指定用于治疗IIb-IV期黑色素瘤。在I/II期临床试验中,ORR为22%,疾病控制率为71%,中位总生存期(OS)为21个月。目前处于黑色素瘤的关键3期临床(NCT03445533)阶段。
D-101是另一个TLR9激动剂,在黑色素瘤和头颈部鳞癌(NCT02521870)、淋巴瘤(NCT02266147)中都进行了临床研究,显示增加了肿瘤浸润淋巴细胞数量。目前主要和免疫检查点抑制剂联用,处于临床2期阶段。
此外,还有MGN1703,是由Mologen AG研发的TLR9激动剂,目前招募的临床包括HIV和晚期实体瘤。PF-3512676是Pfizer在10多年前开发的TLR9B型激动剂,但是因为III期试验阴性结果,已经终止开发。
参考文献
1.Overcoming PD-1 Blockade Resistance WithCpG-A Toll-Like Receptor 9 Agonist Vidutolimod in Patients With MetastaticMelanoma. Cancer Discov. 2021 Dec 1; 11(12): 2998–3007.
2. AACR News Release:A Biologic Drug-Device Combination Immunotherapy Shows Promise for Patients with Metastatic Prostate Cancer. April 7. 2024
3. Recent progress concerning CpG DNA and its use as a vaccine adjuvant. Expert Rev Vaccines. 2014 Feb; 13(2): 299–312.

