Nature Genetics:揭示人类体细胞线粒体DNA嵌合性:探索遗传变异的新视角
时间:2024-07-28 17:03:12 热度:37.1℃ 作者:网络
引言
线粒体DNA (mtDNA) 是一种重要的遗传物质,其在能量代谢、细胞信号传导、凋亡和生物合成等多种细胞功能中扮演关键角色。然而,我们对正常人类体细胞中的线粒体DNA嵌合性(mosaicism)的理解仍然非常有限。通过研究正常组织中的线粒体DNA嵌合性,可以了解到体细胞在个体的一生中会积累基因组变化。尽管近年来的测序研究记录了核基因组中的突变和携带突变的正常细胞的频繁克隆竞争,但正常人类组织中线粒体DNA嵌合性的景观仍未得到充分探索。线粒体携带着其自身的16.6 kb长的环状DNA,突变可以在发育和衰老过程中体细胞中获得,从而塑造体细胞组织中的遗传嵌合性。
总体而言,揭示体细胞嵌合性是具有挑战性的,因为大多数获得的变化局限于个体体内的单个或极少数细胞。捕捉线粒体DNA嵌合性比捕捉核DNA (nDNA) 更复杂,因为单个细胞中包含数百到数千个线粒体DNA拷贝,即使在单个细胞中,新获得的线粒体DNA突变也仅限于一小部分线粒体DNA拷贝。
7月22日Nature Genetics的研究报道“Mitochondrial DNA mosaicism in normal human somatic cells”,通过对来自31名供体的三种细胞类型的2096个克隆的基因组进行分析,共鉴定出6451个具有异质性水平(heteroplasmy level)大于0.3%的线粒体DNA变异。这些变异大多数是独特的,表明其在年龄增长过程中随机获得,但其中6%的变异在多个胚胎谱系中共享,暗示它们起源于受精卵中的异质性。
该研究揭示了线粒体DNA变异的突变谱呈现复制链偏差,这表明线粒体DNA复制是主要的突变过程。研究评估了线粒体DNA的突变率(5.0 × 10−8每碱基对)和每年10-20次的更替频率,这些是塑造生命过程中线粒体DNA嵌合性景观的基本组成部分。研究发现,趋向同质性的线粒体DNA截断突变的扩展受到显著抑制。
该研究通过单细胞测序技术,详细揭示了健康体细胞中线粒体DNA的变异情况,为我们理解线粒体DNA嵌合性的起源、动态变化及其功能后果提供了重要见解。这些发现不仅深化了我们对线粒体DNA突变过程的理解,也为未来研究线粒体相关疾病提供了宝贵的基础数据。

体细胞在个体的一生中会积累基因组变化。尽管近年来的测序研究记录了核基因组(nuclear genome, nDNA)中的突变和携带突变的正常细胞的频繁克隆竞争,但正常人类组织中线粒体DNA嵌合性的景观仍未得到充分探索。线粒体DNA突变可以在发育和衰老过程中体细胞中获得,从而塑造体细胞组织中的遗传嵌合性。了解这些变化对于揭示老化过程、疾病机制以及潜在的治疗方法具有重要意义。
该研究通过对来自31名供体的三种细胞类型(结直肠上皮细胞、成纤维细胞和造血干细胞及祖细胞)的2096个克隆的基因组进行分析,共鉴定出6451个具有异质性水平(heteroplasmy level)大于0.3%的线粒体DNA变异。这些变异包括碱基替换和插入缺失(InDels)。
研究人员通过构建每个供体的早期胚胎系统发育树(phylogeny),追踪线粒体DNA变异的发育起源。每个系统发育树的第一个分支接近生命的第一个细胞分裂,通过共享的体细胞核DNA突变来确定。为了保证测序的准确性,研究团队在实验中采用了多项技术措施,包括对单细胞进行全基因组测序(whole-genome sequencing, WGS)以及建立并应用特定基因位点的背景噪声矩阵。
在实验过程中,研究团队将三种细胞类型分离并扩增为克隆,从中提取DNA进行高深度测序。为了确保测序的可靠性,他们在分析过程中使用了高达6931×的平均线粒体DNA测序深度(范围从188×到40421×),使得在单个克隆中能够稳健地评估线粒体DNA至异质性水平约0.3%。为了系统地分析数据,研究团队还建立并应用了一个特定位点的背景噪声矩阵。
线粒体DNA变异的突变谱
研究共鉴定出6451个嵌合性线粒体DNA变异,其中大部分变异是独特的,表明其在年龄增长过程中随机获得。然而,约6%的变异在多个胚胎谱系中共享,暗示它们起源于受精卵中的异质性。这些变异的突变谱主要由转换突变(transition mutations)组成,尤其是C>T和T>C碱基替换。这些变异表现出极高的复制链偏差,表明线粒体DNA复制是主要的突变过程。例如,研究发现在线粒体DNA的突变谱中,转换突变(C>T和T>C)占主导地位,这些突变展示了极高的复制链偏差。这种偏差表现在重链(heavy strand)和轻链(light strand)上的突变频率差异。例如,在重链上,突变的胞嘧啶(C>T)占92.5%,而在轻链上,突变的胸腺嘧啶(T>C)占63.4%。
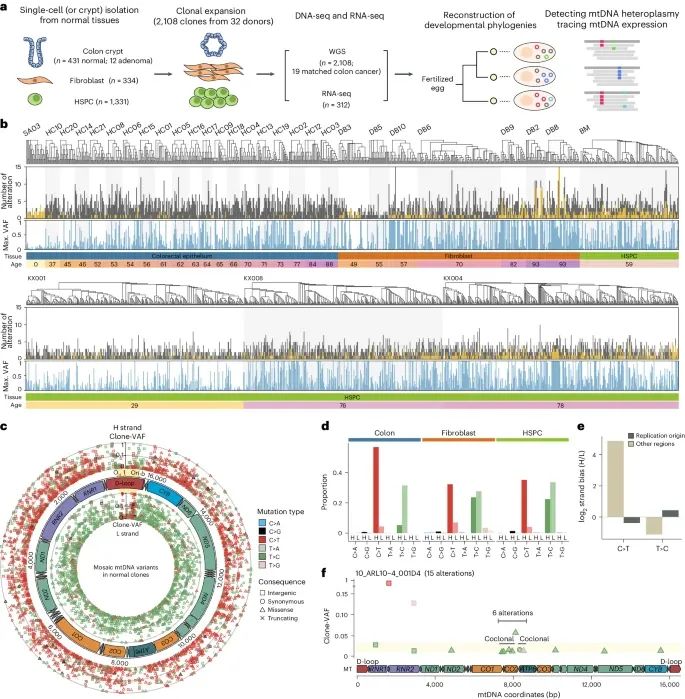
正常细胞中线粒体DNA异质性的全景(Credit: Nature Genetics)
a. 实验设计: 研究人员从正常组织中分离单个细胞,通过克隆扩增这些细胞并进行全基因组测序(WGS)和RNA测序(RNA-seq),以检测线粒体DNA异质性并追踪线粒体DNA表达。这些克隆来自于31名供体的2096个克隆,包括结直肠上皮细胞(431个克隆),成纤维细胞(334个克隆)和造血干细胞及祖细胞(HSPCs,1331个克隆)。此外,还分析了19个匹配的结直肠癌组织样本和12个来自一个患有MUTYH相关息肉病个体的腺瘤性息肉克隆。
b. 线粒体DNA异质性的全景:从31名供体的2096个克隆中识别出的线粒体DNA异质性变异的分布。每个供体的发育系统发育树、总变异数、最大克隆变异频率(clone-VAF)、组织类型和供体年龄均在图中展示。黄色标记表示在一个供体的多个克隆中共享的变异。
c. 线粒体DNA变异的突变谱: 突变类型主要为C>T和T>C碱基替换,占总突变的95%。这些变异分为重链(heavy strand)和轻链(light strand),其中重链突变占据外圈,轻链突变占据内圈。突变类型和后果以颜色和形状表示。重链复制起始区域(Orib-OH)在图中用黄色高亮显示。
d. 突变谱的链不对称性: 在重链复制起始区域之外(m.192-16,196),突变的胞嘧啶(C>T)主要位于重链上(92.5%),而突变的胸腺嘧啶(T>C)主要位于轻链上(63.4%)。
e. 突变谱的链偏向性: C>T和T>C碱基替换在重链复制起始区域(Orib-OH; m.16,197-191)周围的链偏向性。图中显示,重链和轻链突变数量的对数比值在不同区域的变化,说明了突变的链不对称性。
f. 克隆变异频率和变异分布:成纤维细胞克隆(10_ARL10-4_001D4)中线粒体DNA变异的克隆变异频率(clone-VAF)分布和相位情况。在这个克隆中,共检测到15个变异,其中6个变异显示出共同克隆性,集中在一个区域内,暗示这些变异可能是由一次单一突变事件产生的。
线粒体DNA的突变率和更替频率
研究评估了线粒体DNA的突变率为5.0 × 10^−8每碱基对,并发现线粒体DNA每年有10-20次的更替频率。这些参数是塑造个体生命过程中线粒体DNA嵌合性景观的基本组成部分。研究还发现,趋向同质性的线粒体DNA截断突变(truncating mutations)的扩展受到显著抑制,这表明这些突变在功能上可能存在劣势。
为了验证这些数据,研究团队进行了计算机模拟,并发现这些估算的突变率和更替频率与线粒体DNA在正常细胞中的表现一致。这些数据为进一步理解线粒体DNA在个体衰老和疾病发展中的作用提供了基础。
线粒体DNA异质性在受精卵中的起源
通过研究不同发育谱系和组织中的共享模式,研究团队将嵌合性线粒体DNA变异的起源分为两类:受精卵中的异质性(HetFE variants)和体细胞谱系中获得的后合子突变(postzygotic mutations)。例如,m.16400 C>T替换在供体DB2的14个成纤维细胞克隆中共享,而在其他供体的克隆中非常罕见。这些变异的模式强烈暗示最早的共同祖先细胞(可能是受精卵)携带这些异质性变异。
研究团队进一步分析了这些变异在发育过程中的传递模式,发现受精卵中的异质性变异可以在多个发育阶段被检测到,并在多个组织中保持一致。这表明,这些变异在早期发育阶段即已存在,并在个体的整个生命过程中持续存在。
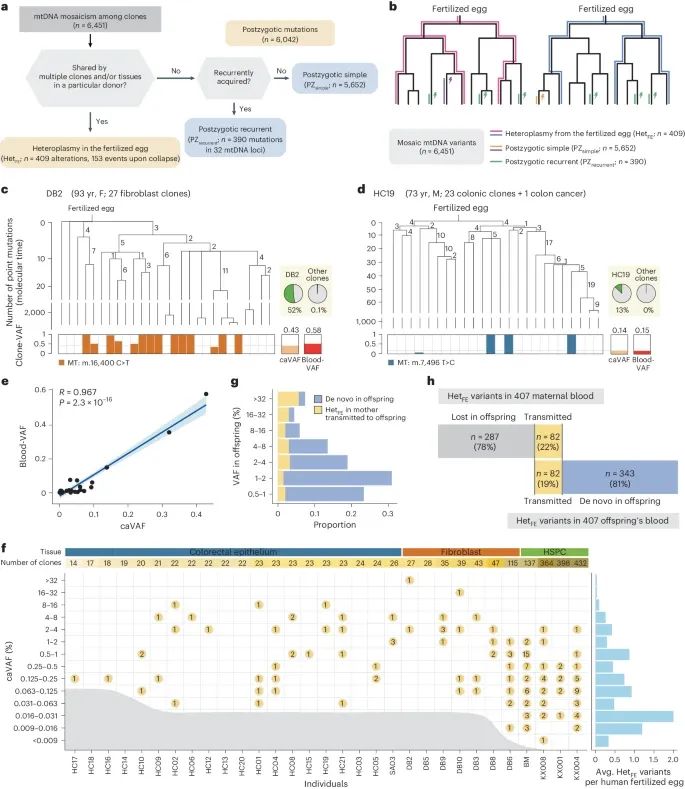
受精卵起源的线粒体DNA变异(Credit: Nature Genetics)
a. 线粒体DNA变异的分类: 研究将嵌合性线粒体DNA变异分为两类:受精卵中的异质性变异(HetFE variants)和体细胞谱系中获得的后合子突变(postzygotic mutations)。
b. 不同起源的线粒体DNA变异共享模式:受精卵中的异质性变异在多个克隆和/或组织中共享,而后合子突变则主要局限于单个或少数克隆。
图c和d提供了受精卵起源的变异的具体例子:
m.16400 C>T替换(图c): 这个变异在供体DB2的14个成纤维细胞克隆中共享(占27个克隆的51.9%),而在其他供体的克隆中非常罕见(仅在2个克隆中检测到,频率为0.1%)。这种变异在早期克隆系统发育树的第一个节点上共享,暗示其来源于受精卵。
m.7496 T>C替换(图d): 这个变异在供体HC19的正常结肠克隆和匹配的结肠癌组织中共享(占23个克隆的13.0%),也强烈表明其来源于受精卵。
e. 血液中的异质性水平与克隆平均变异频率的相关性:研究发现,这两者之间具有高度相关性(R = 0.967, P = 2.3 × 10−16),表明血液中的变异水平能够反映出受精卵中的初始异质性水平。
f. 受精卵起源变异的分布:大多数供体(80.6%,即31名供体中的25名)携带一个或多个caVAF超过0.03%的受精卵起源变异。12名供体(39%)的caVAF超过4%。图中还显示了每个供体克隆数量与检测灵敏度的关系。
g. 母婴血液样本中的异质性变异:从294个家庭(包括407对母子)的多克隆血液样本中发现的异质性变异的VAF分布。研究发现,子女血液中的异质性变异中约20%在母亲的血液中也存在,这表明这些变异可能通过母系线粒体传递。
h. 母婴血液样本中异质性变异的分类: 展示了母亲和子女血液中检测到的异质性变异的分类。这些变异包括在母亲血液中检测到的受精卵起源变异(HetFE variants)以及在子女血液中检测到的受精卵起源变异,进一步支持了这些变异的母系传递模式。
线粒体DNA变异的动态变化
研究发现,线粒体DNA变异在不同细胞类型中的表现存在显著差异。例如,供体DB10的m.16256 C>T突变在39个克隆中展现出不同的变异频率,一些克隆几乎达到同质性,而另一些则几乎没有突变。这种现象可能是由于早期胚胎发育中的瓶颈效应以及个体一生中线粒体DNA的不断更替所致。
通过分析不同年龄段供体的线粒体DNA变异,研究团队发现,线粒体DNA变异在个体的生命过程中表现出动态变化。这种变化不仅体现在变异的频率上,也体现在变异的分布和扩展模式上。例如,年轻供体的线粒体DNA变异表现出更高的异质性,而老年供体的变异则趋向于同质性。
线粒体DNA变异的选择压力
为了理解体细胞中线粒体DNA变异的选择压力,研究团队计算了非同义/同义突变比率(dN/dS ratio)。结果表明,大多数线粒体DNA突变在功能上是中性的。然而,截断突变的克隆变异频率显著低于同义突变,且没有突变超过90%的克隆变异频率,这表明功能失活的线粒体DNA在达到同质性时存在扩展限制。
研究还发现,尽管截断突变在达到高变异频率时受到限制,但某些截断突变在RNA表达水平上表现出显著上调。这一现象可能是由于当蛋白质产物功能失常时,转录物降解受到抑制,导致这些变异在RNA水平上的积累。
线粒体DNA拷贝数和结构变异
研究发现,线粒体DNA拷贝数在不同个体的克隆间存在巨大差异,即使在同一个个体中也是如此。尽管如此,线粒体DNA和核DNA基因的表达水平在克隆间并未显著改变,表明线粒体DNA拷贝数在静止阶段并不是限制线粒体基因转录的瓶颈。
例如,在供体KX004的造血干细胞克隆中,线粒体DNA拷贝数的范围从约20到3700。尽管拷贝数的差异很大,但研究发现,不同克隆间线粒体和核基因的表达水平并没有显著变化,表明在静止阶段,线粒体DNA拷贝数不是基因表达的限制因素。
此外,研究还发现两个结直肠克隆中存在显著的线粒体DNA结构变异(SVs),包括10951 bp和3389 bp的缺失。这些缺失在基因表达中表现出显著降低,表明这些区域在功能上是重要的。
肿瘤形成中的线粒体DNA变异
在19个匹配的结直肠癌组织中,研究发现可检测的线粒体DNA突变数量和总变异频率均显著高于相同供体的正常克隆。这表明在肿瘤发生和克隆演化过程中,线粒体DNA的突变率和更替率可能增加。进一步的研究表明,与正常克隆相比,结直肠癌中功能失活的线粒体DNA突变积累增加,表明这些突变在癌症中的作用可能更加重要。
在研究过程中,研究团队还发现线粒体DNA拷贝数在癌组织中表现出偏向增加或减少的趋势。通过对结直肠癌细胞和匹配的正常克隆进行全基因组测序,研究发现癌细胞中的线粒体DNA拷贝数显著高于正常细胞。这一现象在一定程度上反映了肿瘤细胞对能量需求的增加以及线粒体功能的改变。
该研究通过对2096个健康正常克隆的全基因组测序,详细揭示了单细胞中线粒体DNA嵌合性的景观。这一系统允许追踪线粒体DNA变异的胚胎起源。研究发现,人类受精卵中频繁存在异质性线粒体DNA变异,且这些变异常常显示出显著的异质性水平(即VAF > 30%)。
通过检测受精卵中的异质性变异,研究确定了塑造线粒体DNA嵌合性景观的两个关键参数之一,即体细胞中线粒体DNA的更替率。然后,应用该更替率到后合子突变的景观中,揭示了另一个关键参数,即每次线粒体DNA复制的绝对突变率。尽管它们在理解老化过程和疾病机制方面的重要性,这些参数首次被系统地量化。
研究结果不仅加深了我们对线粒体DNA突变过程的理解,也为未来研究线粒体相关疾病提供了宝贵的基础数据。这些发现有望推动我们在治疗线粒体疾病以及理解老化和癌症等复杂生物学过程中的进展。
参考文献
An J, Nam CH, Kim R, Lee Y, Won H, Park S, Lee WH, Park H, Yoon CJ, An Y, Kim JH, Jun JK, Bae JM, Shin EC, Kim B, Cha YJ, Kwon HW, Oh JW, Park JY, Kim MJ, Ju YS. Mitochondrial DNA mosaicism in normal human somatic cells. Nat Genet. 2024 Jul 22. doi: 10.1038/s41588-024-01838-z. Epub ahead of print. PMID: 39039280.
https://www.nature.com/articles/s41588-024-01838-z


