重庆新桥医院AM:蓝光触发止血肽水凝胶用于治疗胃肠道出血
时间:2024-07-23 15:00:25 热度:37.1℃ 作者:网络
在紧急情况下,非静脉曲张性上消化道出血(NVUGIB)的内镜下止血被认为是金标准干预措施。然而,目前的内镜下止血在处理大直径或深层病变时非常具有挑战性,这些病变极易再次出血。重庆新桥医院杨仕明/樊超强&曼尼托巴大学邢孟秋/徐凯歌报道了一种新型止血肽水凝胶(HPH),由自组装肽序列CFLIVIGSIIVPGDGVPGDG(PFV)和明胶甲基丙烯酸酯(GelMA)组成,可通过蓝光内窥镜(BLE)触发,用于非静脉曲张性上消化道出血治疗,无需担心再次出血。PFV一接触GelMA溶液,立即通过溶剂诱导的自组装形成β-折叠纳米纤维,形成HPH凝胶。HPH纳米纤维网络通过包裹血细胞和激活血小板及凝血因子,即使在凝血病患者的血液中也能诱导超快速凝血。除了在动脉和肝脏损伤模型中展现出卓越的止血性能外,HPH在猪NVUGIB模型中在60秒内实现即时出血管理,防止了再出血风险。这项工作首次展示了一种通过BLE进行NVUGIB干预的非凡止血剂,拓宽了潜在的应用场景,包括凝血病患者,并展现出有希望的临床前景。该研究以题为“Blue Laser Triggered Hemostatic Peptide Hydrogel for Gastrointestinal Bleeding Treatment”的论文发表在《Advanced Materials》上。

方案1描述了止血肽水凝胶(HPH)的制备过程、体外凝血效果和通过蓝光内窥镜(BLE)在非静脉曲张性上消化道出血(NVUGIB)中的止血效果。制备过程包括新型止血肽序列PFV与甲基丙烯酰化明胶(GelMA)的结合,通过溶剂诱导的自组装和光引发剂引发的光交联快速形成凝胶。体外实验显示HPH能够在3秒内迅速凝固血液,包括来自肝硬化患者的血液,显示出在凝血病患者中的潜在应用。在体内大鼠肝脏损伤模型中,HPH显著减少了失血并缩短了止血时间。最重要的是,在猪NVUGIB模型中,HPH在60秒内通过BLE实现了快速止血,并且止血效果在食管、胃和十二指肠中持续了48小时。
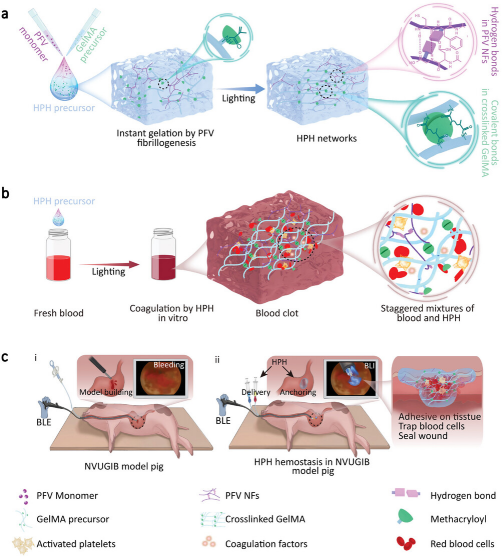
方案1. HPH体外和体内的制备和止血过程
【PFV水凝胶的形成】
实验通过离心、紫外-可见吸收光谱、透射电子显微镜(TEM)、共聚焦激光扫描显微镜(CLSM)和扫描电子显微镜(SEM)等技术,观察了PFV在有机相(OP)和混合相(MP)中的行为。结果表明,在有机相中PFV保持流体状态,而一进入水相即迅速形成具有β-折叠结构的纳米纤维,进而形成稳定的水凝胶。通过硫黄素T(ThT)荧光实验进一步确认了PFV形成的纳米纤维具有典型的β-折叠结构。这些发现表明,PFV肽具有在水相中迅速自组装形成β-折叠纳米纤维的能力,为生物医学应用如水凝胶的制备提供了基础。

图1. PFV水凝胶的形成
【PFV自组装的分子动力学(MD)模拟】
图2通过分子动力学模拟进一步探究了PFV肽在从有机相(OP)到水相(AP)转变过程中的自组装机制。模拟结果显示,PFV在所有系统中初始时都以单体状态存在,没有特殊二级结构。随着模拟的进行,PFV在有机相中保持单体状态,而在混合相(MP)和水相(AP)中逐渐聚集形成纳米纤维。溶剂可及表面面积(SASA)分析表明,PFV在水相中更容易聚集,形成更紧凑的纳米簇。氢键数量的增加在自组装过程中起到了关键作用,尤其是在水相中,氢键的数量显著增加,推动了PFV分子的聚集。模拟结果还显示,PFV分子通过氢键连接形成纤维,并且形成了明显的β-折叠结构。这些发现证实了PFV肽具有在水相中通过疏水作用和氢键协同作用自组装成β-折叠纳米纤维的能力。
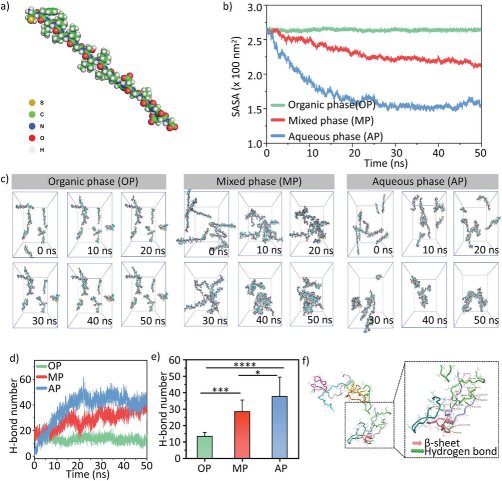
图2. PFV自组装的分子动力学(MD)模拟
【止血混合水凝胶(HPH)的制备】
实验通过调整PFV溶液和GelMA溶液的不同体积比例,观察了在有无光照条件下的凝胶形成情况,发现1:1的比例在光照前就能形成稳定的凝胶。通过扫描电子显微镜(SEM)观察到,光交联后的GelMA具有典型的光滑多孔壁结构,而HPH则在GelMA多孔结构的基础上,表面和内部都形成了PFV纳米纤维网络。流变学测试表明,HPH在光交联后的存储模量(G')显著高于损失模量(G″),显示出比PFV凝胶更好的机械性能,且其G'是GelMA和FG的数倍,表明HPH具有出色的机械强度。此外,剪切强度测试显示HPH与GelMA的粘附性能相当,而FG的粘附性能则显著较低。综上所述,HPH通过PFV纳米纤维与GelMA的结合,不仅保持了PFV的止血效果,还显著提高了凝胶的机械性能和粘附性,显示出在临床止血应用中的潜力。
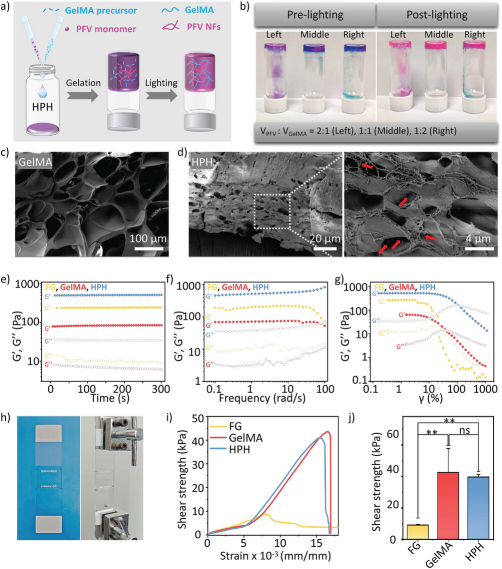
图3. 止血混合水凝胶(HPH)的制备
【HPH的体外止血性能及机理】
实验通过将HPH与含抗凝剂的人血混合,观察了不同条件下的血液凝固情况,包括对照组、FG、GelMA(±光照)、HPH(±光照)。结果显示,HPH即使在无光照条件下也能显著促进血液凝固,而光照后的HPH展现出与FG相当的优异止血效果。通过在96孔板中监测健康志愿者血液的凝血时间,HPH(±光照)和PFV显示出比FG更快的凝血速度,表明PFV在HPH系统中对快速止血至关重要。此外,HPH还能在几秒内有效促进凝血功能障碍的肝硬化患者血液的凝固,显示出其在临床应用中的广泛潜力。通过扫描电子显微镜(SEM)分析,观察到HPH处理的样本中形成了大量纳米纤维网络,这些网络包裹了血细胞并激活了血小板,这是HPH快速凝血效果的原因之一。同时,对健康志愿者和肝硬化患者血液样本的SEM分析进一步证实了HPH通过物理包裹和生物激活血小板及凝血因子(II、V、VII和X)来促进血液凝固。这些结果表明HPH不仅因为形成纤维网络物理包裹血细胞,而且通过PFV激活血小板和多种凝血因子,展现出显著的体外止血能力。

图4. HPH的体外止血性能及机制
【HPH对动脉损伤模型的止血作用】
实验通过在新西兰白兔的颈动脉上建立出血模型,然后应用不同的止血剂(包括GelMA、PFV、HPH和FG),并观察止血效果。结果表明,GelMA、PFV和FG在高动脉压力下止血效果不佳,有明显的出血现象。相比之下,HPH能够牢固地粘附在伤口上,有效封闭伤口,没有进一步出血,证明了其在颈动脉出血模型中出色的止血效果。通过扫描电子显微镜(SEM)对治疗后的颈动脉样本进行分析,发现HPH处理的样本在颈动脉表面形成了由粘附的GelMA和密集的PFV纤维网络构成的显著屏障,这些屏障与红细胞和少量活化血小板相结合,为HPH在颈动脉出血模型中有效止血提供了证据。此外,还在SD大鼠的腹主动脉出血模型中评估了HPH的止血能力,结果与颈动脉出血模型一致,HPH处理的伤口成功止血,而其他对照组均失败。这些结果表明,HPH在体内动脉出血模型中展现出显著的止血效果,这主要归功于其超快的止血能力和强大的组织粘附性。
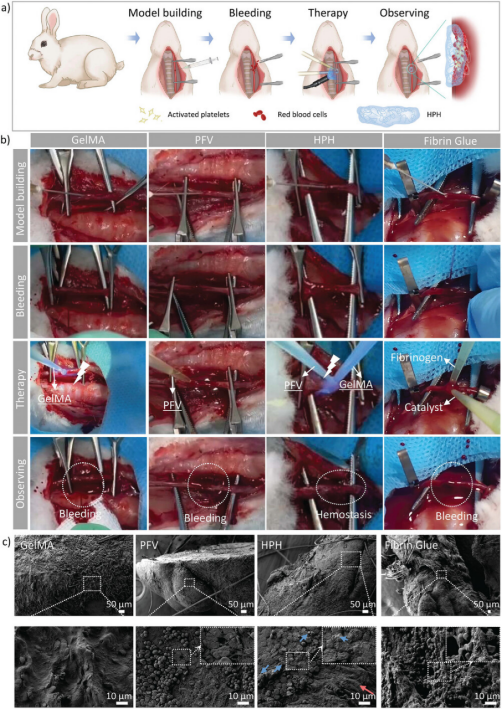
图5. HPH对动脉损伤模型的止血作用
【HPH对肝损伤模型的止血作用】
实验通过在SD大鼠的肝脏上制造一个直径4毫米的圆形伤口来模拟出血情况,然后应用HPH并进行额外的光照处理。结果表明,与对照组、GelMA和FG组相比,HPH能够迅速有效地停止肝脏出血,显著减少了血液流失,并缩短了止血时间。通过测量血液流失量和止血时间,HPH组展现出比FG组更少的血液损失(减少了92.7%)和更短的止血时间(缩短了96.0%)。此外,通过扫描电子显微镜(SEM)对体外肝脏组织样本进行观察,发现HPH处理的样本中存在大量的PFV纳米纤维网络包裹红细胞和活化血小板,以及GelMA形成的类似水泥的堵塞结构,这表明HPH通过物理堵塞伤口、形成纤维网络包裹血细胞以及激活/聚集血小板的协同作用来实现有效止血。CLSM成像和H&E染色进一步证实了HPH在肝脏损伤处形成物理屏障的能力,以及其在实现有效止血方面的强大粘附性。
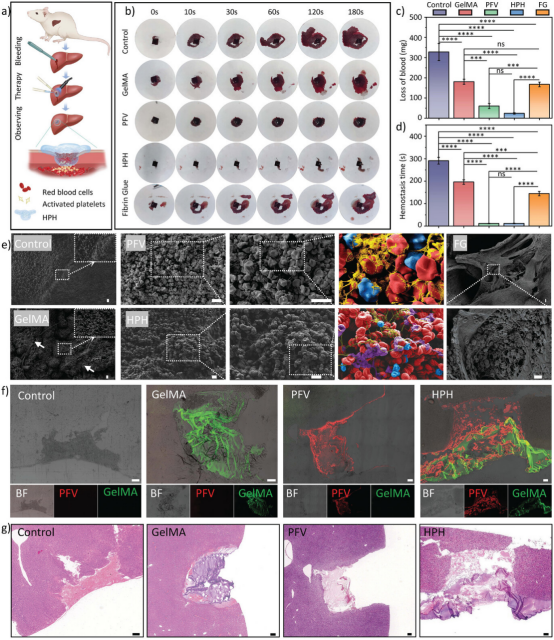
图6. HPH对肝损伤模型的止血作用
【猪NVUGIB中HPH的止血特性】
实验首先验证了HPH在BLE照射下能够快速凝胶化,形成具有良好机械强度和强组织粘附性的凝胶,以抵抗消化道恶劣环境。在体外实验中,HPH展现了在模拟胃液和肠液中的高耐受性,证明了其在消化道环境中的稳定性。在体内实验中,HPH通过内窥镜双腔导管精确送达出血部位,并在BLE照射下实现快速凝胶化,有效实现了对食道、胃和十二指肠出血的即时止血,且在48小时的监测期内未观察到再出血现象。通过扫描电子显微镜(SEM)和能量色散X射线光谱(EDS)分析,证实了HPH在止血后能在组织上稳定锚定,形成物理屏障和激活血小板,从而有效阻止出血。
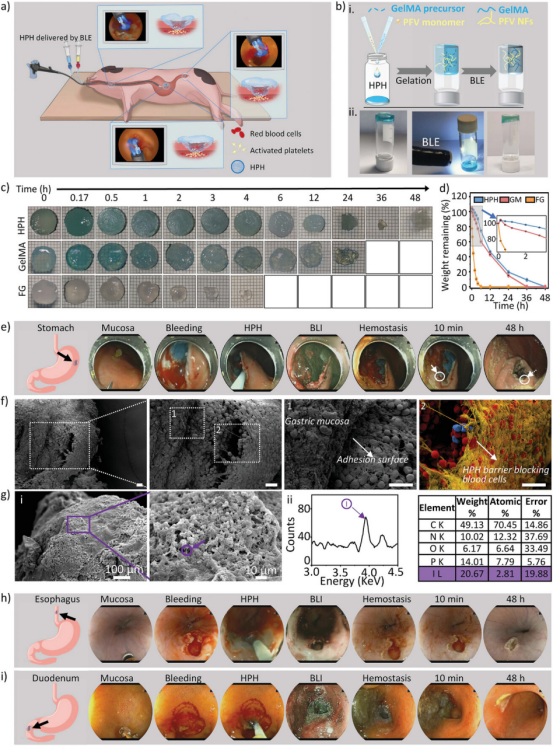
图7. 猪NVUGIB中HPH的止血特性
【小结】
该研究报道了一种新型止血肽水凝胶(HPH),该材料由自组装肽序列CFLIVIGSIIVPGDGVPGDG(PFV)和明胶甲基丙烯酸酯(GelMA)组成,可通过蓝光内窥镜(BLE)触发,用于非静脉曲张性上消化道出血(NVUGIB)的治疗。研究发现,PFV与GelMA溶液接触后能迅速形成β-折叠纳米纤维,通过溶剂诱导的自组装形成HPH凝胶。HPH纳米纤维网络能够通过包裹血细胞和激活血小板及凝血因子,实现超快速凝血,甚至对凝血病患者的血液也有效。在动脉和肝脏损伤模型中,HPH展现出卓越的止血性能,并在猪NVUGIB模型中在60秒内实现即时出血管理,有效防止再出血风险。这项工作首次展示了一种通过BLE进行NVUGIB干预的非凡止血剂,拓宽了其在包括凝血病患者在内的更广泛临床应用前景。
原文链接:
https://doi.org/10.1002/adma.202405290


