Adv Sci:西南大学薛鹏/重庆医科大学刘国栋合作开发了新型纳米花作为多功能肿瘤微环境调节剂
时间:2024-07-14 17:00:17 热度:37.1℃ 作者:网络
鉴于肿瘤微环境(TME)对治疗反应和临床结局有不利影响,稳健的TME调节剂可能显著提高肿瘤患者的疗效,增加患者的生存获益。
2024年7月10日,西南大学薛鹏及重庆医科大学刘国栋共同通讯在Advanced Science 在线发表题为“Gold Nanodots-Anchored Cobalt Ferrite Nanoflowers as Versatile Tumor Microenvironment Modulators for Reinforced Redox Dyshomeostasis”的研究论文,该研究开发了具有聚乙二醇修饰的Au纳米点锚定的CoFe2O4纳米花(CFAP),以响应TME信号,旨在在超声(US)照射下加剧氧化还原失衡,从而实现有效的抗肿瘤治疗。
CFAP被肿瘤细胞摄取后,具有葡萄糖氧化酶(GOx)样活性,可促进葡萄糖消耗,促进H2O2的产生。CFAP中Co(II)/Co(III)和Fe(II)/Fe(III)多价元素对H2O2生成·OH表现出较强的Fenton类活性。另一方面,CFAP的能带结构更有利于US驱动的1O2生成,这依赖于e−/h+对的增强分离和延迟重组。此外,过氧化氢酶模拟CFAP可以与细胞质H2O2反应产生分子氧,这可能会增加消耗O2的反应的产物产量,如葡萄糖氧化和声敏化过程。除了大量产生活性氧外,CFAP还能够耗尽谷胱甘肽以破坏细胞内氧化还原平衡。严重的免疫原性细胞死亡和CFAP对实体肿瘤的有效抑制表明了这种异质结构的临床效力,并可能启发更多相关的疾病治疗设计。

生理氧化还原平衡深刻影响肿瘤的发生、分化、增殖、转移、凋亡、自噬,甚至产生治疗耐药性,促进肿瘤的发展。鉴于此,智能诱导氧化还原失衡具有抑制肿瘤生长和扩散的特殊希望。活性氧(ROS)系统和抗氧化防御(AOD)系统的精心配合,有助于维持肿瘤的氧化还原平衡。适度内源性生成的ROS可介导细胞信号转导,参与肿瘤发生、肿瘤传播和转移。而当细胞内ROS水平超过阈值时,会对蛋白质、脂质和核酸产生不可逆的破坏,被认为是氧化损伤。内质网(ER)应激和线粒体呼吸链电子渗漏可使胞浆内ROS含量增加。除了这些代谢活动外,刺激反应性催化反应也可以使细胞质丰富过量的ROS。例如,声动力疗法(SDT)在超声(US)触发的声致敏下通过大量ROS产生来消除肿瘤细胞,具有最小的侵入性和最大的组织穿透深度的优点。
迄今为止,已经开发了许多纳米级无机声敏剂,包括TiO2、BiVO4、MnWOx等,以及它们的异质结和Schottky结,可以将周围的H2O或O2转化为细胞毒性ROS。这些高性能助剂的结构设计准则在于能带内e−/h+对的快速分离和延迟重组。另外,化学动力疗法(CDT)采用多价金属离子(如Fe2+/3+, Cu1+/2+, Mn2+/3+, Co2+/3+)作为Fenton剂,通过将内源性H2O2转化为羟基自由基(·OH)来损伤肿瘤细胞。综上所述,SDT和CDT通过一体化纳米剂结合可能会增强ROS的产生,从而放大致命的氧化损伤。另一方面,AOD系统可以清除过量的ROS,恢复细胞氧化还原的动力学平衡,AOD紊乱可能会加剧氧化还原失衡,加重细胞损伤。谷胱甘肽(GSH)系统是一种主要的硫醇抗氧化系统,它可以根据氧化状态在还原和氧化状态之间循环。GSH消耗不仅可以保护ROS免于消除,还可以在脂质过氧化物积累时触发铁下垂。为此,建议合理设计稳定的纳米平台,通过灵活的操作机制来促进氧化还原失衡。
癌症在复杂、动态的肿瘤微环境(TME)中发展,通过复杂的信号网络支持肿瘤的生长、存活、增殖、血管生成、侵袭和转移。肿瘤酸性与代谢重编程和有氧糖酵解参与有关,较低的pH值可提高蛋白酶表达和金属蛋白酶活性,促进肿瘤细胞的迁移和侵袭。肿瘤内急性缺氧主要是由异常血管化导致的血供不足引起的,血供不足通过激活缺氧诱导因子(HIF)信号通路加速肿瘤进展。过氧化氢产生的增加发生在功能失调的线粒体中,它通过慢性炎症使TME受精,从而促进肿瘤的复发和转移。相应的,由于ROS防御机制的作用,GSH水平同时升高以抵消过表达的H2O2。除了这些TME线索在加强肿瘤发生方面的关键作用外,它们还阻碍了许多治疗方式并削弱了疗效。例如,TME中的缺氧总是影响氧依赖程序的治疗效果(例如SDT和葡萄糖衰竭引起的肿瘤饥饿)。
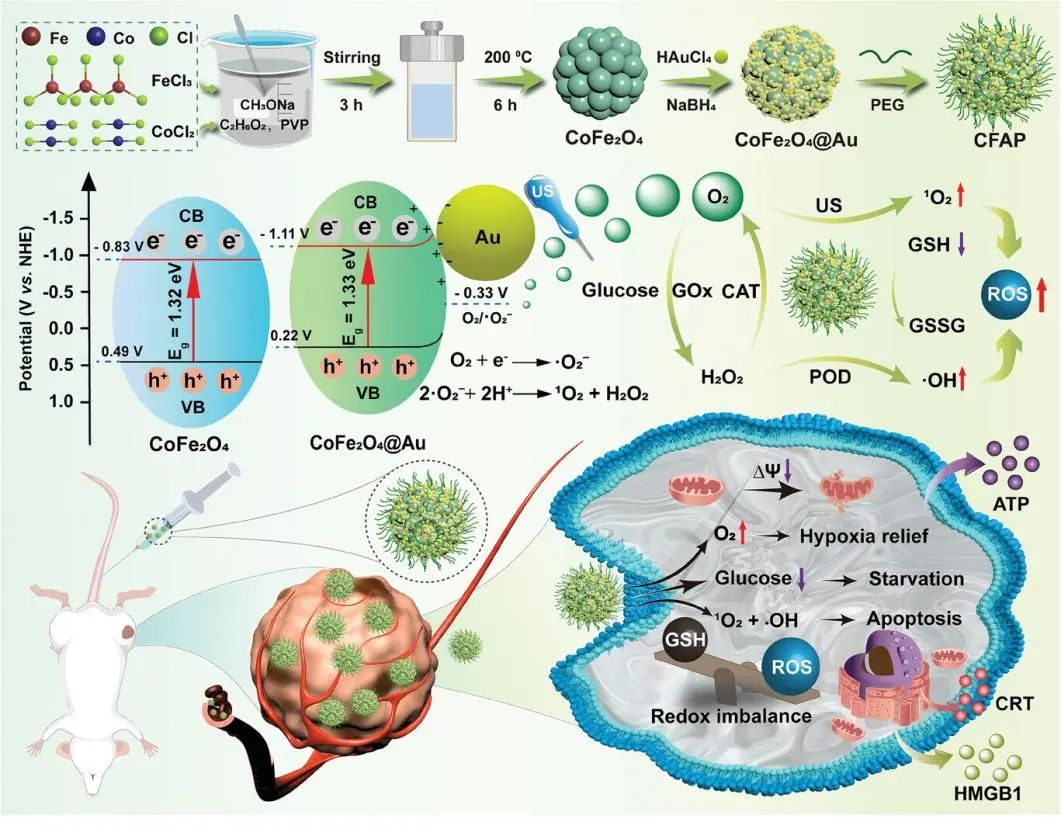
CFAP作为TME调节剂的合成路线及其诱导强化氧化还原稳态失调的操作机制图(图源自Advanced Science )
此外,过量的GSH可以促进氧化应激抵抗,这不利于ROS相关的治疗。由于TME在加速肿瘤发展和治疗耐药方面的重要性,调节TME信号的策略对于提高治疗效果是非常必要的。合格的候选人被认为具有以下三个特征。首先,它们应该能够通过缺氧逆转、酸性中和和降低氧化还原平衡等级来正常化或反向调节这些TME信号。其次,它们可以与这些异常的TME因子反应产生细胞毒性物质,导致多种类型的细胞死亡。第三,它们对正常细胞是惰性的,对身体的新陈代谢没有影响。为此,基于纳米技术的靶向和重编程异常TME的新方法正在不断地探索基础研究和实际应用。
钴铁氧体(CoFe2O4)作为一种明显的过渡金属硫系催化剂,在可再生能源转化和环境污染物清除中起着重要作用。此外,铁和钴都是人体健康的必需元素,它们分别是血红蛋白和维生素B12的产生所必需的。利用US驱动下e−/h+对的快速分离,以及Fe2+/Fe3+和Co2+/Co3+的氧化还原对作为Fenton试剂的优势,本课课组证明了纳米CoFe2O4对肿瘤细胞的杀伤作用。然而,通过优化CoFe2O4的能带结构,延缓e−/h+对的重组,加速Fenton反应中心的电荷转移,仍有望进一步提高ROS的产率。此外,ROS诱导的氧化应激本身不足以诱导不可逆的细胞死亡,这可能进一步导致肿瘤在初始治疗后复发或复发。
考虑到上述情况,本研究开发了聚乙二醇化金(Au)纳米点锚定CoFe2O4纳米花(CFAP)作为多用途的TME调节剂,旨在增强抗肿瘤的氧化还原失衡(方案1)。通过在CoFe2O4的邻近表面上原位成核和生长Au纳米点合成CoFe2O4@Au Schottky结。共轭Au可以作为电子清除剂,有效延缓e−/h+对的重组,显著提高US辐照下的电荷利用效率。此外,声敏化过程中加速的电荷转移促进了多价Fe2+/Fe3+和Co2+/Co3+氧化还原对介导的类fenton反应。这种增强的SDT和CDT容易产生大量的ROS进行氧化损伤。
此外,CoFe2O4@Au具有GSH过氧化物酶(GPx)活性,可消耗细胞内GSH,加剧氧化还原失衡。另一方面,微小的金纳米点作为葡萄糖氧化酶(GOx)模拟酶,通过葡萄糖剥夺来实现肿瘤饥饿,可以有效地协同氧化还原平衡失调治疗。重要的是,CoFe2O4@Au固有的过氧化氢酶样活性催化H2O2分解成O2,由此产生的缺氧缓解倾向于加速葡萄糖消耗,促进SDT过程。CFAP诱导的细胞凋亡/铁凋亡可引起有效的免疫遗传细胞死亡(ICD),从而刺激抗肿瘤免疫,用于全身肿瘤治疗。与以往CoFe2O4的研究相比,CFAP的创新点可以简单概括为以下几点。首先,CFAP提供了一种实用的设计钴铁氧体的策略,旨在优化其能带结构以获得更高的治疗效果。其次,CFAP使其他治疗方式能够与CoFe2O4诱导的氧化还原失衡协同作用,这对于完全根除肿瘤至关重要。第三,CFAP对许多TME线索有反应,因此可以在没有苛刻反应条件的情况下工作。从多个角度对最终产物的形态、能带结构和催化活性进行了全面表征。在细胞水平和BALB/c小鼠携带4T1肿瘤模型上验证了CFAP的良好治疗效果。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202406683


