周晓燕教授点评 | 乳腺癌BRCA基因检测面面观:从适用人群到检测方法,从样本类型到报告解读
时间:2024-07-11 13:00:54 热度:37.1℃ 作者:网络
乳腺癌是女性最常见的恶性肿瘤之一,且发病率逐年递增。随着精准医疗理念的不断深化,PARP抑制剂不断探索对于携带BRCA突变乳腺癌患者的靶向治疗,为其治疗开启了全新的篇章。近期,AACR会议就发布了两项相关研究的喜人进展。
PARTNER研究结果显示[1],奥拉帕利与含铂化疗联合应用于胚系BRCA(gBRCA)突变乳腺癌患者的新辅助治疗后,3年EFS(无事件生存期)率和3年OS(总生存期)率对比化疗组分别为:96% vs 80%(p=0.007),100% vs 88%(p=0.012);无论pCR(病理完全缓解)状态如何,联合治疗都能显著改善所有生存终点。PETRA研究则展示了新一代PARP抑制剂Saruparib(AZD5305)的强大潜力,其在HER2-/HRR缺陷型(指BRCA1/2/ PALB2/ RAD51C/D致病性突变)转移性乳腺癌患者中表现出良好的疗效和耐受性[2],为BRCA突变乳腺癌患者的治疗提供了新希望,也为将来的研究提供了方向。
那么乳腺癌中的BRCA基因突变率如何?哪些人群需要做BRCA基因检测?又该选择哪种检测方法?怎样解读报告呢?
1 BRCA基因检测意义及适用人群?
乳腺癌易感基因(breast cancer susceptibility gene)BRCA包括BRCA1和BRCA2,是重要的抑癌基因,其编码产物参与DNA损伤中的同源重组修复,致病性BRCA1/2基因突变会导致同源重组缺陷(HRD),使基因组不稳定性显著增加[3]。
了解BRCA基因突变状态,有助于做好高风险人群的遗传咨询管理,包括制定筛查方案、评估家属遗传风险等。
根据突变来源,BRCA基因变异分为胚系突变(来源于精子或卵母细胞的生殖细胞突变,机体所有细胞都带有突变,可遗传给后代)和体细胞突变(指发生于肿瘤细胞中的BRCA基因突变,非遗传性)。携带致病性BRCA1/2基因突变的女性在乳腺癌、卵巢癌、输卵管癌、胰腺癌及黑色素瘤等方面的发病风险增加,男性则是罹患乳腺癌、前列腺癌、胰腺癌等的风险增加[4,5]。
表1.BRCA1/2基因致病性变异与14种癌症风险之间的关系[5]
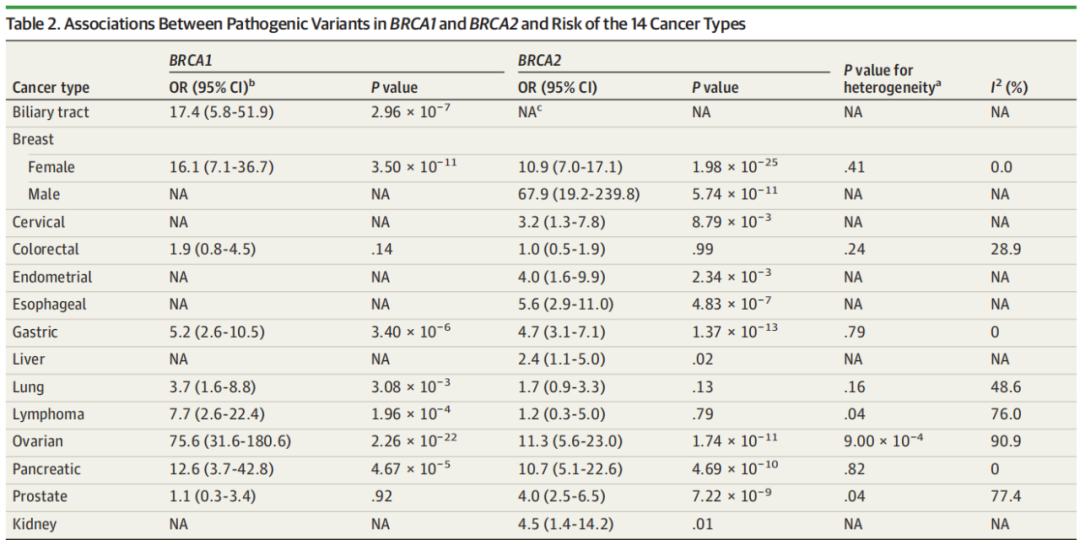
致病性BRCA1/2基因变异在中国普通人群中的发生率在0.29%到1.10%之间,高于其他东亚国家[4];而我国乳腺癌患者中,gBRCA的变异率约为5~10%,其中三阴乳腺癌和HR+/HER2型乳腺癌是gBRCA突变的主要亚型;在有家族史的人群中则可达到~18%[6-9]。
基于此,《美国国家综合癌症网络(NCCN)乳腺癌、卵巢癌和胰腺癌遗传评估指南(2024.V4》、以及《基于中国人群的BRCA胚系突变筛查专家共识(2024年版)》等多个国内外指南/专家共识推荐了gBRCA基因检测优先人群,主要特征包括确诊年龄≤45岁;高风险家族史;三阴性乳腺癌(TNBC);卵巢癌、前列腺癌、胰腺癌病史;男性乳腺癌等;至于无家族史或未明确家族史的人群则以自愿为原则,鼓励其进行基因突变的筛查[10]。
在人群中,尤其是已有肿瘤家族史的高危人群中,BRCA基因检测可以发挥“预防性管理”作用,通过评估其遗传风险,有助于降低此类特殊遗传性疾病的死亡率和社会影响。
了解BRCA基因突变状态,有助于指导乳腺癌患者的治疗方案选择。
目前,国内外权威指南和专家共识均推荐符合一定条件的乳腺癌患者进行BRCA基因突变检测,并根据检测结果采取相应治疗措施。
手术是早期乳腺癌的一个重要治疗手段。gBRCA致病突变乳腺癌携带者与未携带者相比,对侧乳腺癌风险显著增高4~5倍,不同个体间差异较大[11]。因此,《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》[12]明确指出,gBRCA突变是保乳手术的相对禁忌证。因此保乳手术前应当进行BRCA基因检测,明确BRCA突变状态,以便合理选择手术方式。
对于晚期乳腺癌,临床需要化疗、靶向治疗、免疫治疗等多种治疗手段有机结合。其中,靶向治疗由于具备特异性强、疗效显著、毒副反应小等优点,已成为乳腺癌治疗的研究热点。已有多项研究证实,对于gBRCA突变、HER2阴性晚期乳腺癌,靶向药PARP抑制剂的应用能够给患者带来生存获益。因此,明确BRCA基因突变状态能为乳腺癌患者的靶向治疗选择提供参考[7]。
表2.乳腺癌患者推荐进行BRCA基因检测的专家共识[13]。

《遗传性乳腺癌治疗管理:美国临床肿瘤学会、美国放射肿瘤学会与外科肿瘤学会联合指南(2021)》、《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》等国内外指南一致推荐BRCA突变乳腺癌患者使用奥拉帕利、他拉唑帕利进行靶向治疗。目前,这两种靶向药已被FDA批准用于gBRCA突变HER2阴性晚期或转移性乳腺癌患者的靶向治疗。
对于手术前或手术后接受过化疗治疗的gBRCA突变高风险HER2阴性早期乳腺癌患者而言,奥拉帕利作为辅助治疗可显著改善治疗疗效[9],表明在确诊时进行BRCA突变检测可以识别出适合接受奥拉帕利辅助治疗的早期乳腺癌患者。
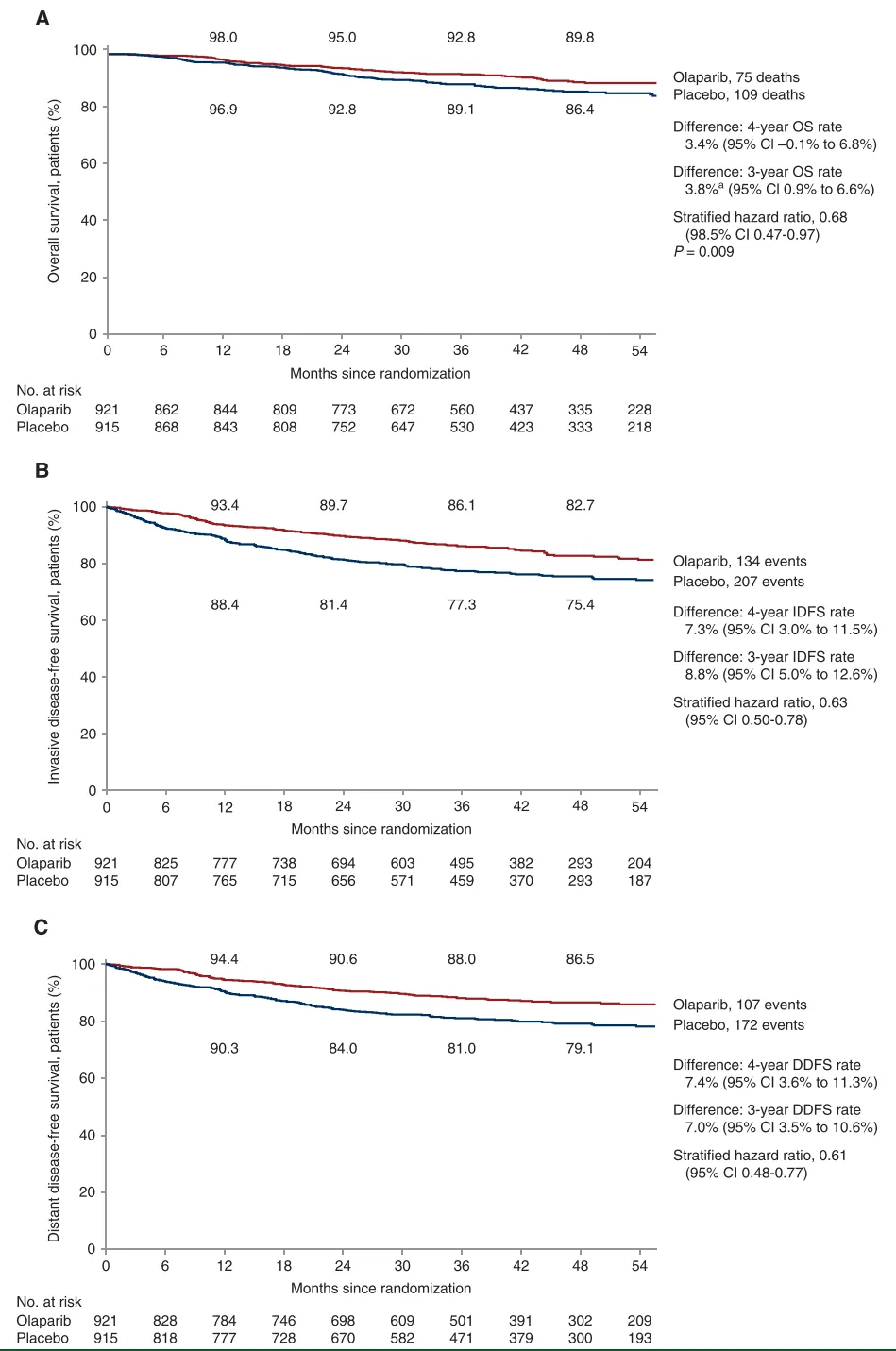
图1.OlympiA研究中奥拉帕利和安慰剂治疗的Kaplan-Meier生存估计[9]。
对于既往接受过化疗的gBRCA突变HER2阴性晚期乳腺癌患者,他拉唑帕利单药治疗可以显著提高患者的PFS和ORR率[10],将疾病进展风险降低46%,表明基于gBRCA突变状态,可以有效筛选可从他拉唑帕利单药治疗中潜在获益的HER2阴性晚期乳腺癌患者。
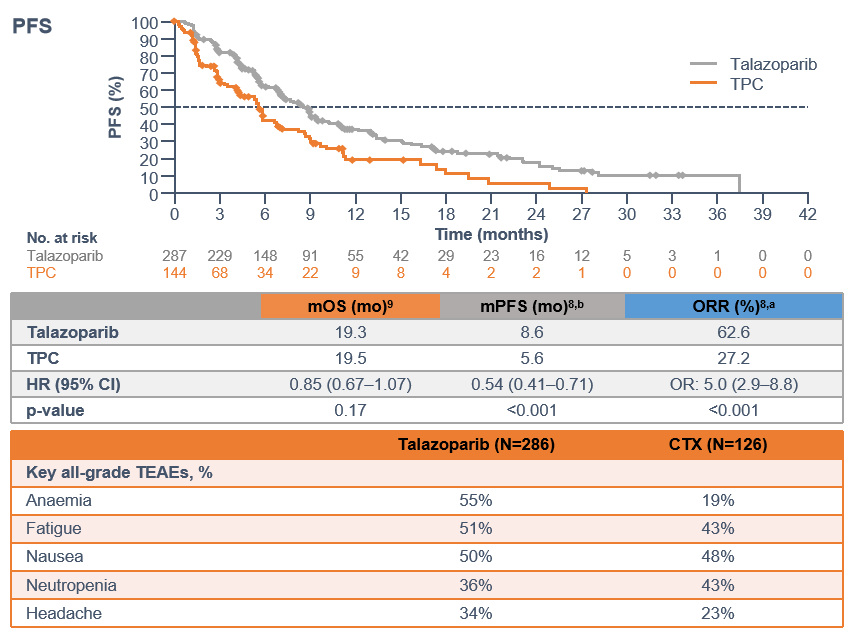
图2.EMBRACA试验中他拉唑帕利和标准治疗组的结果比较[10]。
除单药治疗外,已有多项临床研究表明,gBRCA突变HER2阴性晚期乳腺癌患者还可以从PARP抑制剂联合免疫治疗、化疗等多种治疗方案中获得一定生存获益。
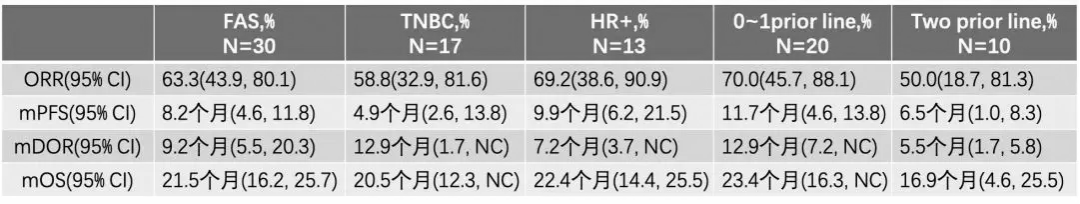
MEDIOLA试验证实奥拉帕利联合PD-L1抑制剂(度伐利尤单抗)在gBRCA突变HER2阴性乳腺癌治疗中具有一定疗效。研究分析了30例可评估疗效的患者,包括18例晚期三阴性乳腺癌(TNBC)。结果显示,接受联合治疗的患者12周ORR达63.3%,中位缓解持续时间(DOR)为9.2个月,中位PFS为8.2个月,中位总生存期(OS)为21.5个月[14]。
表3.MEDIOLA试验主要研究结果。
III期BROCADE3试验采用PARP抑制剂(维利帕利)联合含铂化疗(卡铂+紫杉醇)治疗gBRCA突变HER2阴性晚期乳腺癌,显著提高了患者的无进展生存期。数据显示,试验组PFS为14.5个月,对照组为12.6个月,试验组的疾病进展风险降低了29%;试验组中位OS为33.5个月,对照组中位OS为28.2个月[15]。
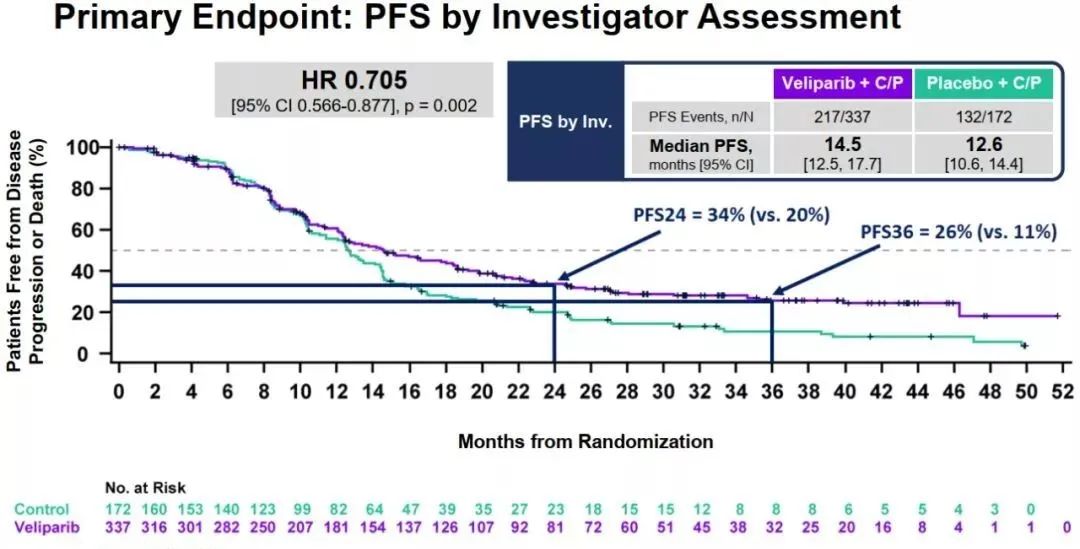
图3.BROCADE3试验主要研究终点PFS分析。
了解BRCA基因状态,有助于对肿瘤患者的预后判断。
肿瘤预后判断需要考虑多种临床病理及分子指标。对于卵巢癌患者,BRCA基因突变状态是一个指示患者预后的重要因子;但对于乳腺癌患者而言,BRCA基因状态是否与其预后直接相关从目前研究中尚不能得到一致结论[16],因此仍需更多研究证据来明确。
2 BRCA突变类型及检测方法的选择
BRCA突变类型多样,包括单核苷酸变异(SNV)、小片段插入/缺失(InDel)、拷贝数变异(CNV)和大片段重排(LGR)等,同时其内含子发生的变异也可能影响蛋白质功能。此外,BRCA突变分散遍布于2个基因序列的全长,很难找到固定的突变热点,即使存在突变热点,在不同地域及不同种族之间差异也很大。因此,BRCA基因检测必须同时覆盖全部外显子以及外显子和内含子连接区域±20 bp[12]。
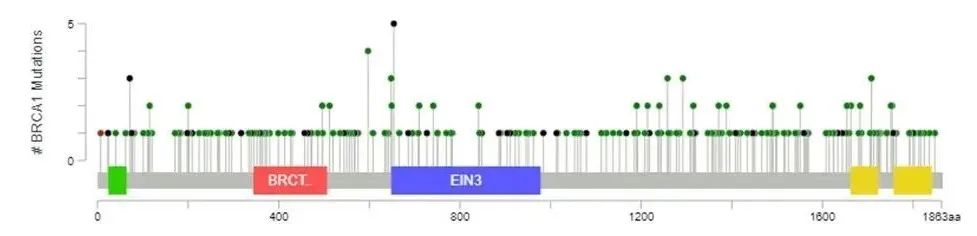
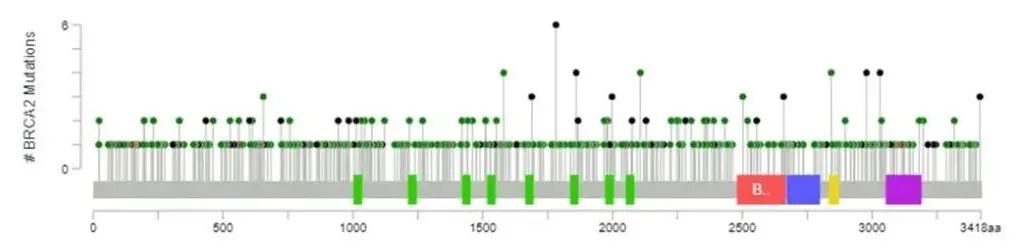
图4.BRCA突变的分布。
鉴于BRCA突变具有以上特点,目前在临床实践中优先使用的BRCA突变检测技术为NGS,并且已有可用的商业化试剂盒。NGS具有速度快、通量高、灵敏度高、准确率高、覆盖范围广、可检测未知突变等优势,可以保证BRCA突变得到充分的筛查[17]。
当然,NGS技术也有局限性,即对于LGR类的变异无法全面覆盖,而利用多重连接探针扩增技术(MLPA)能很好得检出LGR。因此,当NGS发现可疑BRCA LGR变异或有明显家族史但NGS阴性的患者,推荐使用MLPA进行验证或补充检测[16],但由于其通量低、成本高等限制,尚难以在临床应用中普及。
Sanger测序在BRCA突变检测中一般用于:(1)肿瘤组织中检测到BRCA突变时进一步验证其是否为胚系突变;(2)对BRCA胚系突变者的亲属进行检测以明确是否携带相同突变。
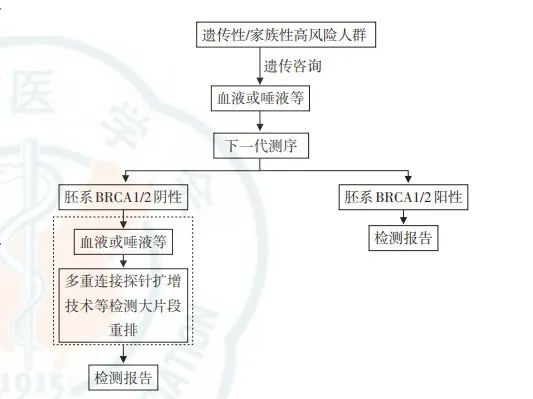
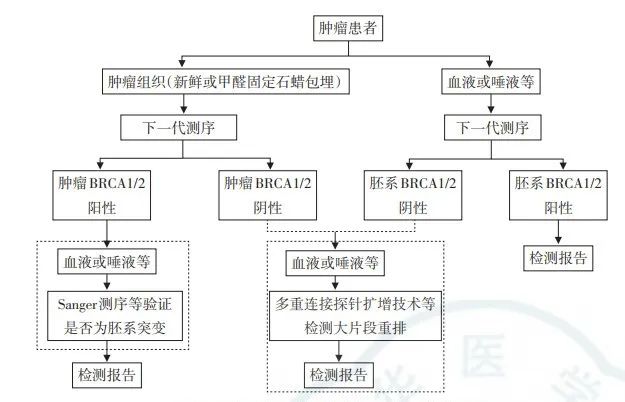
图5.高风险人群及乳腺癌患者的BRCA基因检测临床路径[16]。
3 如何选择送检样本类型?
上文提到,gBRCA突变起源于生殖细胞,存在于机体的每一个细胞中;BRCA体细胞突变仅存在于肿瘤细胞中。
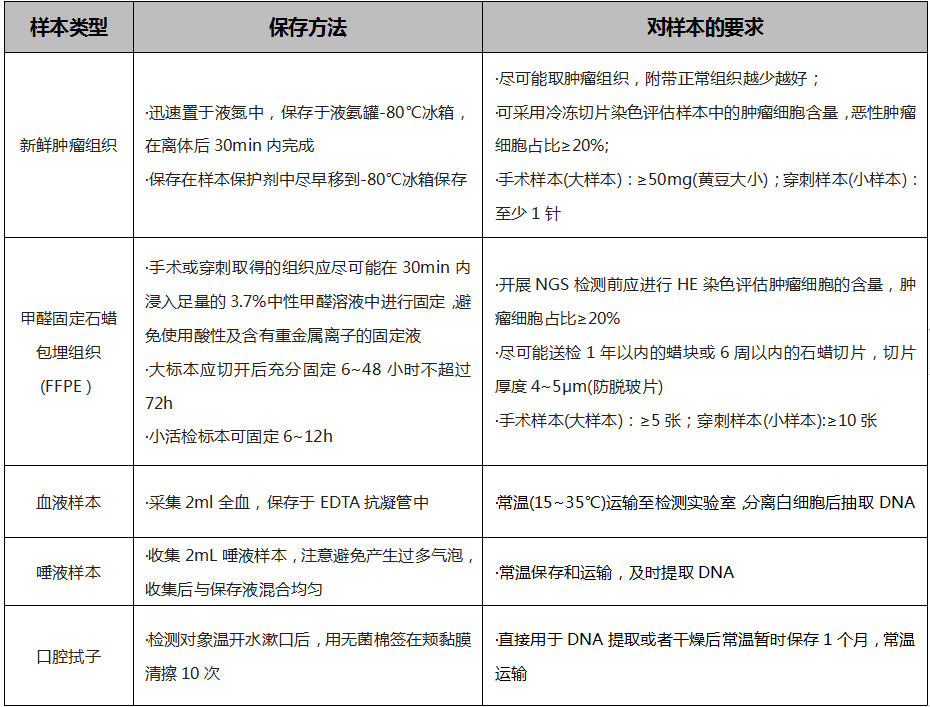
乳腺癌gBRCA突变的NGS检测一般使用血液、唾液、口腔拭子样本,目前以血液(白细胞)样本为主。BRCA体细胞突变检测一般使用手术或穿刺获得的组织样本,对于突变检测阳性的患者需要进一步行胚系突变分析,以区分胚系及体细胞突变[16]。
表4.BRCA突变检测的样本要求[16]。
4 怎样解读BRCA基因检测报告?
一份完整的NGS基因检测报告内容应至少包括受检人信息、样本信息、检测结果、参考范围、基因变异分类的详细解释、检测方法和覆盖区域、检测方法的局限性、发布报告的实验室标识与联系信息、检测人及审核者签名等模块。
临床医生面对一份NGS临检报告时,应关注其样本主要质控参数、可报告范围、检测方法及局限性等相关内容。检测方法和覆盖区域部分应明确描述使用的是何种BRCA检测方法以及该方法覆盖的指定序列区域。

图6.NGS报告中对检测方法的说明示例及样本主要质控参数示例[18]。
BRCA基因检测报告解读的关键步骤之一是对阳性结果的判定进行解读。BRCA基因突变解读需要依据各类信息进行综合评判。
首先需要明确检测到的BRCA突变是胚系突变还是体细胞突变。
基于美国医学遗传学与基因组学学会(ACMG)推荐的gBRCA突变解读流程,可将胚系突变的致病性分为5类(如图6)。gBRCA突变检测报告结果应列出在该受检者中发现的所有3~5类基因突变,并列出总体BRCA1/2状态,解读重点关注该突变对于某种遗传疾病的致病性。
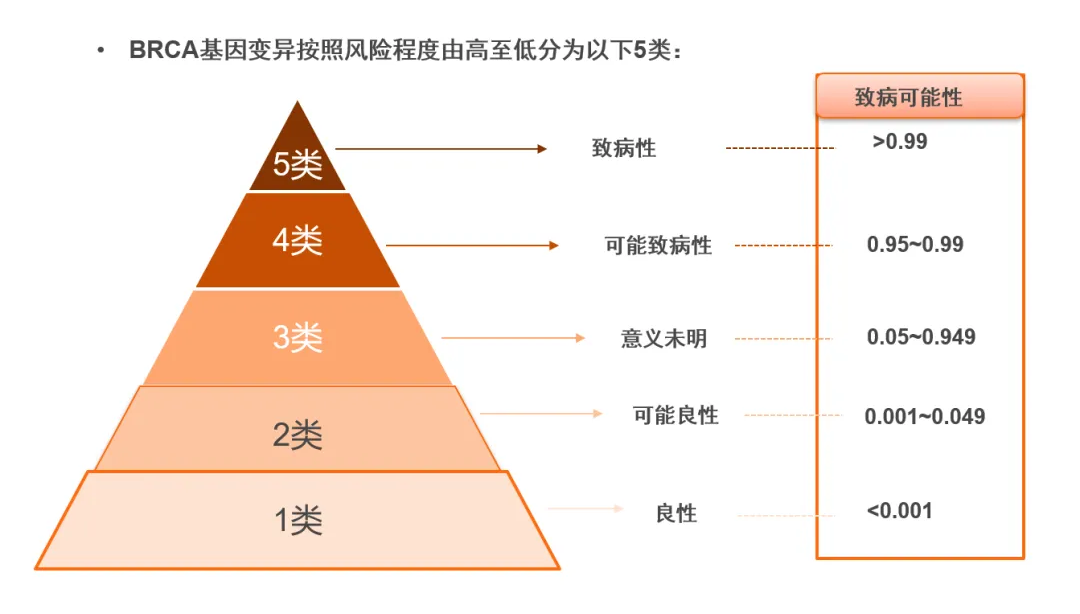
图7.gBRCA突变按照致病风险程度由高至低分为5类。
对于BRCA体细胞突变的解读,在国内影响范围最广的是2017年由美国分子病理学协会(AMP)/美国临床肿瘤学会(ASCO)/美国病理学家协会(CAP)联合制定的解读和报告标准与指南(图7)。BRCA体细胞突变检测报告结果应列出在该患者中发现的所有Ⅰ~Ⅲ级变异,解读应关注该突变对临床实践的影响,如对某种靶向药物敏感性的预测、对疾病的诊断或预后判断的价值等。
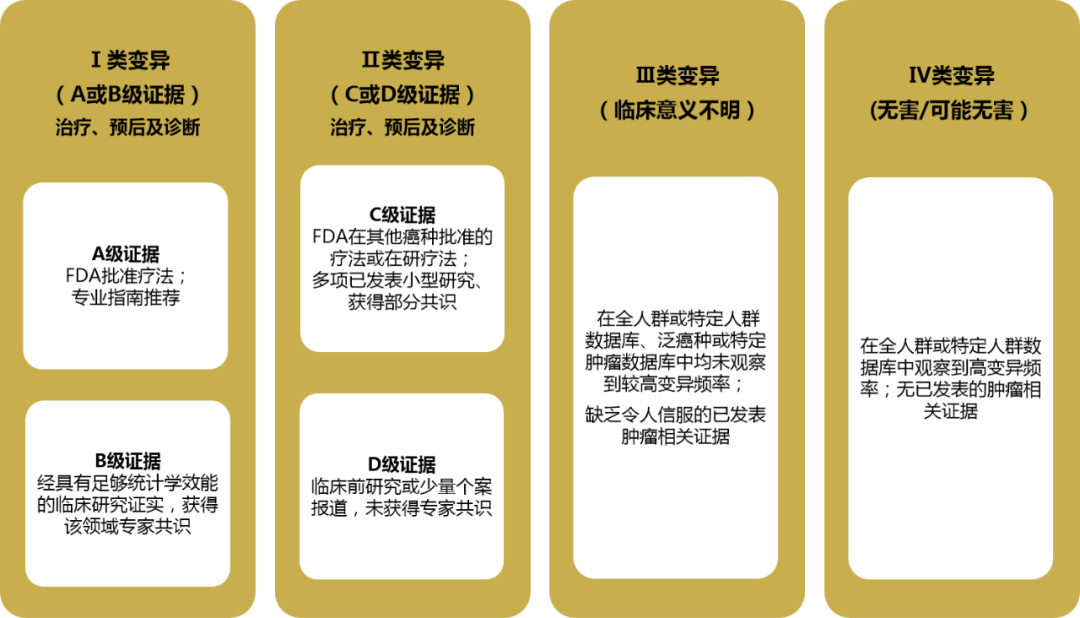
图8.AMP/ASCO/CAP指南中基于证据的突变分类[18]。
总结与展望
BRCA基因检测有助于乳腺癌治疗不再局限于传统的治疗方式。规范化BRCA基因检测有助于诊断更多的BRCA突变乳腺癌患者,可以选择联合PARP抑制剂的治疗方案,有望更大化患者的临床获益。在早期的BRCA突变型乳腺癌治疗中,多款PARP抑制剂在单药新辅助治疗方向,以及联合(化疗、免疫治疗)新辅助治疗方向初见成效,PARP抑制剂联合免疫(新)辅助治疗BRCA突变早期乳腺癌患者已成为未来研究方向,目前已经有多个临床研究处于II/III期。
随着临床研究的不断深入和更多分析工具的研发,BRCA基因检测将更多地用于乳腺癌风险评估、遗传管理,渗透到从新辅助治疗、手术方案选择、术后放化疗到靶向用药的全程个体化治疗。
专家点评
周晓燕 教授
复旦大学附属肿瘤医院
BRCA基因突变不仅增加了患者罹患肿瘤的风险,也与乳腺癌患者的治疗选择密切相关。PARP抑制剂打开了BRCA突变乳腺癌治疗的新格局,目前已有两种PARP抑制剂奥拉帕利和他拉唑帕利获批用于BRCA突变、HER2阴性晚期乳腺癌的挽救治疗和早期乳腺癌的辅助治疗,其中奥拉帕利等PARP抑制剂已经在国内可及。
但目前仍有许多问题待解决,如转移性乳腺癌患者通常无法像其他肿瘤类型患者一样观察到从PARP抑制剂治疗中长期获益;长期使用单药治疗所导致的PARP耐药无法避免。已有研究通过研发新型PARP抑制剂和探索更优的药物组合来解决上述问题。近期AACR公布的PETRAI/IIa期研究,展示了新一代高选择性PARP-1抑制剂Saruparib的安全性,期待其进一步为乳腺癌患者带来临床获益。此外,PARP抑制剂联合化疗、免疫治疗等在一些临床研究中也显示了明确疗效。
BRCA基因的规范检测和报告解读决定了NGS检测能否为肿瘤患者带来切实的临床获益。这需要多方密切配合,以更好的服务于临床治疗决策。我们也期待通过多方合作,共同推动乳腺癌患者的规范基因检测,掌控乳腺癌治疗主动权,最大化患者的临床获益。
PARP抑制剂作用机制:[16]
BRCA1/2基因 突 变 与 聚 腺 苷 二 磷 酸 核 糖 聚 合 酶(PARP)抑制剂的合成致死效应:PARP是一种修复DNA单链损伤至关重要的酶,当PARP抑制剂选择性抑制PARP介导的DNA单链损伤修复途径时,未修复的DNA单链损伤经过复制后将转化为DNA双链断裂。正常细胞可通过同源重组修复DNA双链断裂,然而在BRCA基因突变的肿瘤细胞中,因为同源重组修复功能的缺陷,DNA双链断裂得不到修复,DNA损伤不断积累,最终导致细胞死亡,即合成致死效应。
参考文献:
[1] CT011 - The PARTNER trial: Neoadjuvant olaparib in germline BRCA mutated breast cancer (gBRCA); "gap"’ scheduling with carboplatin and paclitaxel, a step closer to cure. 2024 AACR.
[2] CT014.PETRA: first-in-human Phase 1/2a trial of the first-in-class next-generation poly(ADP-ribose) polymerase-1 selective inhibitor (PARP1i) saruparib (AZD5305) in patients (pts) with advanced solid tumors with BRCA1/2, PALB2 or RAD51C/D mutations. 2024 AACR.
[3] Watkins JA, Irshad S, Grigoriadis A, Tutt AN. Genomic scars as biomarkers of homologous recombination deficiency and drug response in breast and ovarian cancers. Breast Cancer Res. 2014 Jun 3;16(3):211.
[4] LEI H J, ZHANG M, ZHANG L Y, et al. Overview on populationscreening for carriers with germline BRCA mutation in China[J]. Front Oncol, 2022, 12: 1002360
[5] MOMOZAWA Y, SASAI, USUI Y, et al. Expansion of cancer risk profile for BRCA1 and BRCA2 pathogenic variants[J]. JAMA Oncol, 2022, 8(6): 871-878.
[6] Zhong X, Dong Z, et al. Prevalence and Prognostic Role of BRCA1/2 Variants in Unselected Chinese Breast Cancer Patients. PLoS One. 2016 Jun 3;11(6):e0156789.
[7] Zhang J, Sun J, et al. Comprehensive analysis of BRCA1 and BRCA2 germline mutations in a large cohort of 5931 Chinese women with breast cancer. Breast Cancer Res Treat. 2016 Aug;158(3):455-62.
[8] Lang GT, Shi JX, Hu X, et al. The spectrum of BRCA mutations and characteristics of BRCA-associated breast cancers in China: Screening of 2,991 patients and 1,043 controls by next-generation sequencing. Int J Cancer. 2017 Jul 1;141(1):129-142.
[9]Sun J, Meng H, et al. Germline Mutations in Cancer Susceptibility Genes in a Large Series of Unselected Breast Cancer Patients. Clin Cancer Res. 2017 Oct 15;23(20):6113-6119.
[10] 中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2024年版)
[11] Ye F,et al. Outcomes and risk of subsequent breast events in breast-conserving surgery patients with BRCA1 and BRCA2 mutation. Cancer Med. 2020 Mar;9(5):1903-1910.
[12]中国抗癌协会乳腺癌专业委员会等,《《中国癌症杂志》2023年第33卷第12期
[13] 中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2018年版),《中国癌症杂志》2018年第28卷第10期,DOI: 10.19401/j.cnki.1007-3639.2018.10.011.8
[14] Domchek SM, Postel-Vinay S, Im SA, et al. Olaparib and durvalumab in patients with germline BRCA-mutated metastatic breast cancer (MEDIOLA): an open-label, multicentre, phase 1/2, basket study. Lancet Oncol. 2020;21(9):1155-1164. DOI:https://doi.org/10.1016/S1470-2045(20)30324-7
[15]Diéras V, Han HS, Kaufman B, et al: Veliparib with carboplatin and paclitaxel in BRCA-mutated advanced breast cancer (BROCADE3): A randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. August 27, 2020.
[16] 基于下一代测序技术的BRCA1/2基因检测指南(2019版),中华病理学杂志,2019,48(9) : 670-677.
[17]中国抗癌协会肿瘤标志物专业委员会,上海市抗癌协会肿瘤标志物专业委员会. 基于中国人群的BRCA胚系突变筛查专家共识(2024年版)[J]. 中国癌症杂志, 2024, 34 (2): 220-238.
[18] 吴一龙,等. 肿瘤二代测序临床报告解读共识,循证医学2022年第22卷第2期


