临床研究|NAFLD更名前后的人群分布变化及MASLD肝纤维化的危险因素分析
时间:2024-07-11 13:00:39 热度:37.1℃ 作者:网络
非酒精性脂肪性肝病(NAFLD)是一种以肝细胞发生脂肪变性≥5%并排除其他肝病病因为特征的慢性肝病。与NAFLD不同,代谢相关脂肪性肝病(MAFLD)是2020年由国际专家小组提出的包容性诊断。有研究表示,新的MAFLD标准比NAFLD能够识别更多的高危人群。最近,由多学会的德尔菲共识提出脂肪变性肝病(SLD)概念,并分为多个亚型,如代谢功能障碍相关脂肪性肝病(MASLD)(通用名为代谢相关脂肪性肝病)、MASLD合并酒精性肝病(MetALD)及隐源性SLD等。
MASLD是对既往NAFLD的新定义,是存在至少一个代谢危险因素(MRF)而不是基于排除的、阴性的诊断。关于脂肪肝的命名充满争议和挑战,尽管目前尚无任何药物获批用于该疾病,但定义的变化是否会影响目前验证诊断生物标志物和药物开发的努力,是一个令人担忧的问题。进一步讲,代谢标准可能会影响流行病学和临床研究中患者的识别。因此,新的MASLD定义确定的患者群体是否与既往NAFLD队列相同需要进一步研究。此外,目前尚不清楚MASLD患者发生肝纤维化的风险是否会随着MRF种类的增加而不同。因此,评估MASLD的人群分布以及晚期肝纤维化仍是需要解决的重要问题。为此,本研究纳入515例经肝穿刺活检人群,建立了一个病理肝细胞发生脂肪变性≥5%的队列。探讨从NAFLD到MAFLD的人群分布,并根据SLD亚组以及MASLD的MRF种类分别分组评估肝纤维化的差异,并分析MASLD合并晚期肝纤维化的危险因素。
1资料与方法
1.1 研究对象
收集2019年1月—2022年1月徐州医科大学附属医院和无锡市第五人民医院收治的515例经肝穿刺活检显示脂肪变性≥5%患者的临床资料。排除标准:(1)肝细胞发生脂肪变性<5%患者;(2)合并其他血液恶性疾病或肿瘤者;(3)年龄<18岁者;(4)重复记录者;(5)临床资料不全者。
1.2 诊断标准
NAFLD诊断符合2012年亚洲太平洋地区工作组制定的非酒精性脂肪肝定义与治疗指南:肝脏影像学或组织学表现为弥漫性脂肪肝表现,同时排除长期大量饮酒、长期应用药物及病毒型肝炎等其他引起肝脏脂肪变性的原因。
MAFLD诊断标准依据2020年共识声明:基于肝组织活检或影像学检查提示存在脂肪肝,加上超重或肥胖、2型糖尿病(T2DM)及代谢功能障碍3项条件之一。其中,代谢功能障碍定义为至少存在2种及以上代谢异常:(1)男性腰围≥90 cm,女性腰围≥80 cm(中心性肥胖);(2)血压≥130/85 mmHg或正在服用抗高血压药;(3)甘油三酯(TG)≥1.7 mmol/L或正在接受特定药物治疗;(4)高密度脂蛋白胆固醇(HDL-C)男性<1.0 mmol/L,女性<1.3 mmol/L;(5)糖尿病前期[空腹血糖(FPG)5.6~6.9 mmol/L或糖化血红蛋白5.7%~6.4%];(6)稳态模型评估-胰岛素抵抗评分≥2.5;(7)C反应蛋白水平≥2 mg/L。
MASLD诊断标准根据2023年德尔菲共识:基于影像学或肝活检证实存在SLD(肝细胞发生脂肪变性≥5%);其次,至少存在5种MRF中的1种:(1)BMl≥25 kg/m2(亚洲人23 kg/m2)或腰围>94 cm(男性)/80 cm(女性)或种族调整;(2)FPG≥5.6 mmol/L或2 h-PG≥7.8 mmol/L或糖化血红蛋白≥5.7%或T2DM或治疗中的T2DM;(3)血压≥130/85 mmHg或降压药物治疗;(4)TG≥1.7 mmol/L或降脂药物治疗;(5)HDL-C男性<1.0 mmol/L,女性<1.3 mmol/L或降脂药物治疗。
1.3 资料收集
收集患者临床资料和实验室指标,包括年龄、性别、BMI、ALT、AST、GGT、Alb、总胆固醇(CHOL)、TG、LDL-C、HDL-C、FPG。计算NFS和FIB-4评分。根据NASH CRN纤维化分期系统对肝纤维化程度进行分层。肝纤维化F3~4期定义为晚期肝纤维化。
2结果
2.1 一般资料
515例SLD患者中有297例(57.7%)符合NAFLD诊断,467例(90.7%)符合MAFLD诊断,有2例既不符合NAFLD也不符合MAFLD诊断,被归为其他特定原因的SLD(不参与分组)。297例NAFLD患者中275例(92.6%)为MASLD,22例(7.4%)为隐源性SLD;467例MAFLD患者中216例(41.9%)被诊断为和其他病因共存的MASLD,且这些患者均符合单一MAFLD诊断。
515例患者中男264例,女251例,平均年龄47(35~55)岁,BMI 25.4(23.3~27.5)kg/m2。513例患者分为3组:MASLD组(n=275,53.6%)、合并组[MASLD合并其他肝病(表1),n=216,42.1%]和隐源性SLD组(n=22,4.3%)。3组间性别、BMI、GGT、TG、CHOL、LDL-C、HDL-C、FPG、NFS、FIB-4、F3~4比较差异均有统计学意义(P值均<0.05)。与MASLD组、隐源性SLD组相比,合并组患者晚期肝纤维化(F3~4)占比最高(P<0.001)(表2)。
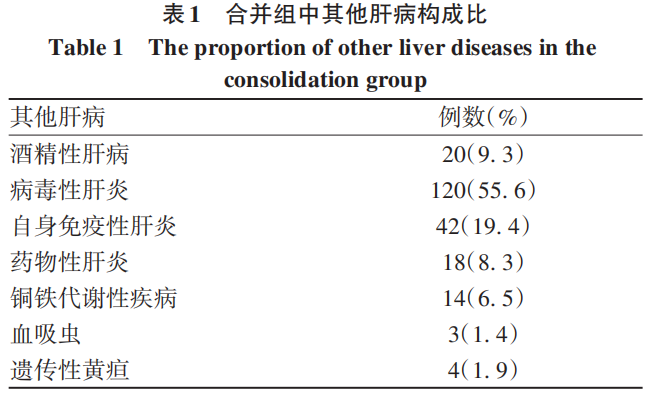
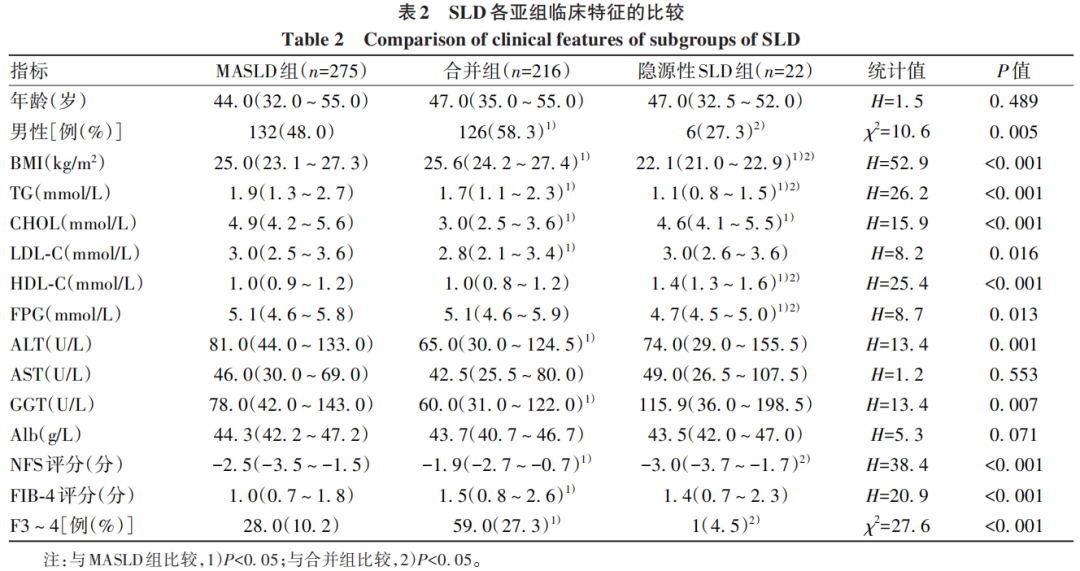
2.2 MASLD组不同MRF种类亚组间临床特征的比较
根据存在不同数量和类型的MRF将275例MASLD组患者分为4个亚组(TG和HDL-C归于1种MRF条件)。随着MRF种类的增加,患者年龄更大,更有可能是女性,更可能合并高血压、糖尿病,并具有更高的代谢相关参数水平,包括BMI、血脂和血糖水平(P值均<0.05)。MASLD患者随MRF种类的增加,无创纤维化评分(NFS和FIB-4评分)更高,合并晚期纤维化比例更高(P<0.05)(表3)。
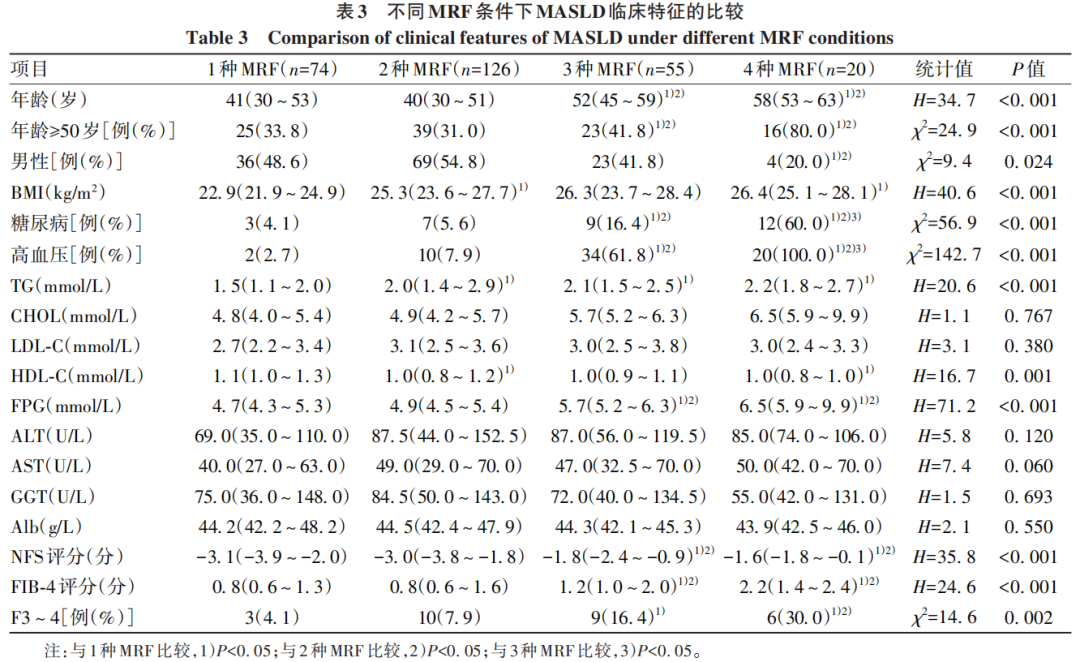
2.3 MASLD患者合并晚期肝纤维化的风险因素分析
单因素Logistic回归分析发现,年龄≥50岁和MRF种类与晚期纤维化的发生有关(P值均<0.05);多因素Logistic回归分析显示,年龄≥50岁和MRF种类增加是MASLD合并晚期肝纤维化的独立危险因素(P值均<0.05)(表4)。
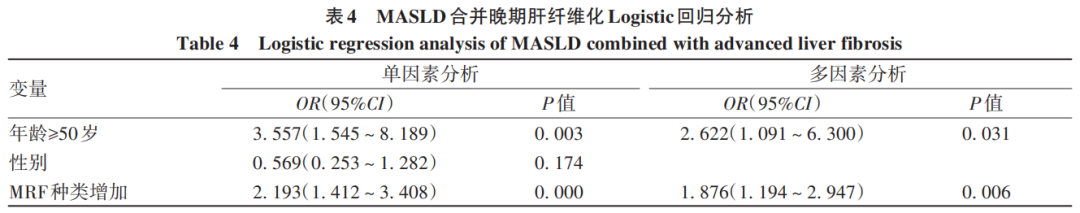
3讨论
目前,NAFLD已成为全球最常见的慢性肝病。从NAFLD到MAFLD再到MASLD命名,都在为尽早识别高危人群以及新药的开发做努力。肝纤维化是评估NAFLD预后的重要指标。而肝活检仍是目前准确诊断纤维化严重程度的金标准。因此,本研究通过建立SLD病理队列,描述从NAFLD到MASLD的人群分布和SLD各亚组肝纤维化的差异,以及不同代谢条件下诊断的MASLD的临床特征。结果表明,病理诊断的NAFLD中92.6%的人群符合MASLD诊断;MASLD与酒精性肝病、病毒性肝炎等其他肝病共存时合并晚期肝纤维化比例更高;诊断MASLD时随MRF种类增加,晚期肝纤维化增多。
本研究中,SLD的主要病因是MASLD以及与其他肝病共存的MASLD,少数隐源性SLD。SLD分组能够完全覆盖肝脏发生脂肪变性的病因,并且新的定义允许多种病因的脂肪变性共存。既往研究表明,非NAFLD的MAFLD患者的全因死亡率、心血管疾病相关病死率和其他原因病死率高于其他脂肪肝患者,可能原因为非NAFLD的MAFLD患者合并酒精性肝炎、病毒性肝炎等病因。本研究中MASLD与酒精性肝病、病毒性肝炎等其他肝病共存组符合非NAFLD的MAFLD诊断,与既往研究一致。未来的临床研究应进一步明确多病因合并脂肪肝的临床特征。尤其在应用MASLD诊断标准之前必须排除肝脂肪变性的其他原因,以确保不会遗漏具有双重病理特征的儿童。
NAFLD常被认为是代谢综合征(MetS)的肝脏表现,有研究表明,随着MetS组分的增加,NAFLD患者疾病进展速度加快。此外,一项前瞻性研究证明MetS的存在与NAFLD患者较高的病死率有关。因此,代谢状况有助于对NAFLD患者进行危险分层。在一项基于美国数据库研究中,根据MAFLD定义,患有2种及以上代谢疾病的患者比伴随一种代谢疾病的患者肝肾损伤的程度更高,但该研究的MAFLD人群存在一定的混杂因素。而新的MASLD命名方法依赖于5种MRF临床表型的阳性识别,在胰岛素抵抗相关的潜在心脏代谢异常背景下,有助于从肝脏和整体角度采取主要的治疗措施。本研究发现病理诊断MASLD人群与既往的NAFLD诊断保持一致性,随着MRF种类的增加,MASLD患者更可能是女性,年龄、BMI、血脂血糖水平随之增加,且合并晚期肝纤维化的患者比例大幅度增加。值得注意的是,在MASLD患者MRF分组比较中,转氨酶的水平无差异,可能是由于研究纳入的病理人群本身即具有一定的肝损伤。此外,本研究显示年龄和MRF种类的增加均为MASLD合并晚期肝纤维化的独立危险因素。随着年龄的增长,肝血流量、肝体积和肝功能下降,NAFLD患病率和肝外并发症的风险以及总体与疾病特异性死亡率均将增加。MRF种类的增加亦将加快MASLD患者病情进展的速度。因此,对年龄≥50岁、合并多种MRF的MASLD患者都应及早筛查和预防纤维化的发生。
综上所述,本研究支持新的MASLD定义下既往NAFLD研究的结果仍然有效。MASLD诊断标准与MRF密切相关,需关注MASLD的MRF,针对患者代谢风险和肝纤维化程度制订治疗方案。然而,本研究为横断面研究,研究结果仍需前瞻性研究证明。且本研究只纳入病理诊断的SLD人群,后续有必要扩大样本量,开展进一步的研究和分析。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240611



