针对小细胞肺癌靶向DLL3的新疗法
时间:2024-07-07 06:01:02 热度:37.1℃ 作者:网络
前言
小细胞肺癌(SCLC)是一种侵袭性、高级别的神经内分泌癌(NEC),每年占癌症诊断的13%–15%。被诊断为小细胞肺癌的患者预后很差,5年生存率从局限性疾病的27%到转移性疾病的3%不等。大多数患者无法通过现有的治疗手段实现长期疾病控制。
目前小细胞肺癌的一线SOC治疗是以铂为基础的化疗,同时对局限期小细胞肺癌(LS-SCLC)患者进行放疗,然后对出现完全缓解的患者进行预防性颅骨照射,以及对广泛期SCLC(ES-SCLC)患者使用PD-L1抑制剂联合化疗。拓扑替康是20多年来唯一被批准用于SCLC二线治疗的药物,直到2020年,一种RNA聚合酶抑制剂lurbinectedin被加速批准用于治疗复发性SCLC。目前的治疗效果改善有限,一线化疗后几乎不可避免地出现耐药性和复发,这推动了对更有效治疗方法的不断探索。
Delta样配体3(DLL3)是一种Notch抑制性配体,是一种SCLC非常有吸引力的治疗靶点,因为它在SCLC细胞表面过表达,而在正常细胞上几乎没有表达。目前正在开发几种DLL3靶向疗法用于治疗小细胞肺癌和其他神经内分泌癌,包括抗体偶联药物(ADC)、T细胞结合器(TCE)和嵌合抗原受体(CAR)疗法。
DLL3与小细胞肺癌
在寻找小细胞肺癌治疗靶点的过程中,转录因子achaete-scute同源物1(ASCL1)因其作为神经内分泌分化的关键调节因子及其驱动小细胞肺癌形成的能力而引起了人们的特别关注。ASCL1在一些小细胞肺癌中的表达增加,ASCL1通过调节包括MYCL1、RET、SOX2、NFIB和BCL2在内的几种原癌基因以及DLL3基因的表达来驱动SCLC疾病进展和细胞存活,DLL3基因编码抑制SCLC细胞中Notch信号传导的抑制性配体。
Notch途径是一种进化上保守的途径,小细胞肺癌中的Notch信号传导与多种致癌细胞过程有关,如细胞增殖、神经内分泌细胞可塑性、分化、化疗耐药性和免疫微环境的调节。DLL3是一种非典型的Notch配体,其过表达促进SCLC细胞的生长并增强其迁移和侵袭能力。DLL3还通过促进细胞增殖和获得对铂双联化疗的耐药性,在NECs中建立转移和治疗耐药性表型。
高达85%的人类小细胞肺癌肿瘤在细胞表面表达DLL3蛋白。除了SCLC,DLL3还广泛表达于其他NECs中,如肺(大细胞NEC的某些分子亚型)、胃肠胰、膀胱、前列腺和宫颈NECs。DLL3的高水平表达与这些肿瘤的恶化和较差的生存结果相关。
DLL3靶向ADC
Rova-T是一种DLL3靶向ADC,其包含DLL3特异性人源化单克隆抗体(SC16),该抗体通过可裂解的二肽连接子与吡咯并二氮茚(PBD)二聚体毒素偶联。Rova-T与细胞表面DLL3的结合引起ADC靶标复合体的内化,Rova-T的VA连接子随后被溶酶体相关的组织蛋白酶B切割,将PBD释放到细胞质中。PBD随后进入细胞核,交联DNA,并通过凋亡诱导肿瘤细胞死亡。
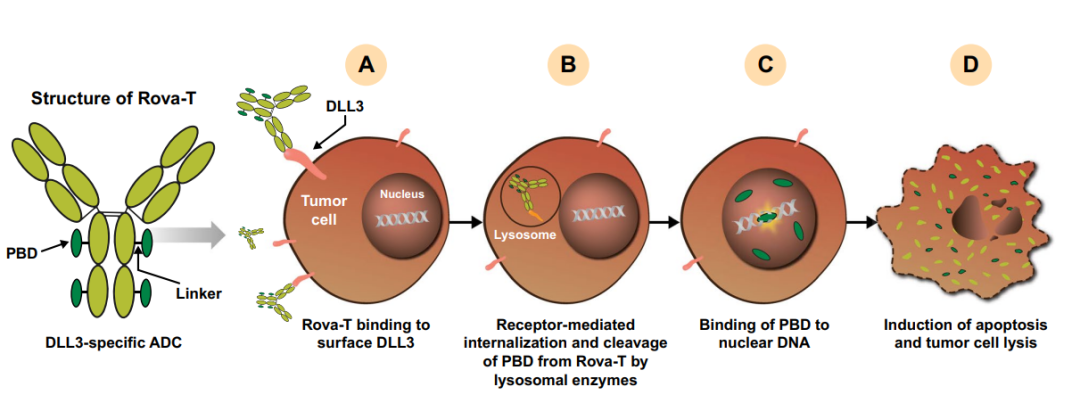
Rova-T已开展了至少10项临床试验,包括两项3期临床。Rova-T的首次人体(FIH)研究在二三线治疗的患者中产生了18%的客观响应率(ORR),1年生存率为36%,这一结果令人印象深刻。
在2期TRINITY研究中,Rova-T在339名DLL3表达的SCLC中ORR为12.4%,中位总生存期(OS)为5.6个月。在DLL3高表达的患者中ORR略高,为14.3%,中位无进展生存期(PFS)为3.8个月,中位OS为5.7个月。
TAHOE(Rova-T对比拓扑替康作为二线治疗)和MERU(Rova-T作为一线治疗后的维持治疗)3期研究因未达到预先指定的中期PFS和/或OS主要终点而提前终止。在TAHOE研究中,Rova-T组的中位OS为6.3个月,拓扑替康组为8.6个月。在MERU研究中,Rova-T组的中位OS为8.8个月,安慰剂组为9.9个月;将分析限制在DLL3高表达患者没有改善疗效。这些临床发现和其他考量导致Rova-T的开发中断。
此外,安全性方面,Rova-T在铂类化疗后复发性小细胞肺癌患者中的1-3期临床研究中,在38%-64%的SCLC患者中观察到3级治疗相关AE(TEAE),在1.7%-7.1%的患者中观察到5级TEAE。血小板减少、胸腔积液、光敏反应和贫血是Rova-T最常见的TEAE。
DLL3靶向T细胞结合器
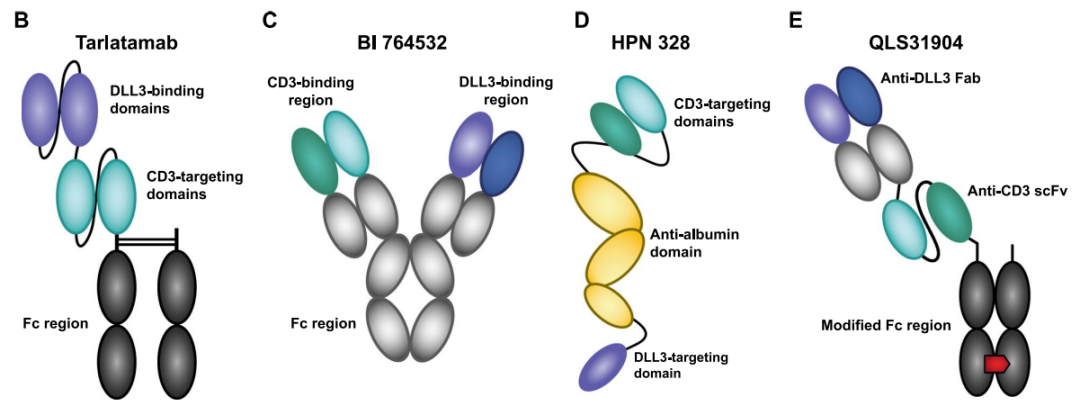
T细胞结合器具有双重特异性,使它们能够同时与T细胞上的CD3复合物和肿瘤上的靶抗原结合。这种双重结合使肿瘤细胞与自体T细胞紧密接触,触发免疫突触的形成和T细胞的激活,最终导致肿瘤细胞凋亡和T细胞反应的扩增。目前,有多款靶向DLL3的TCE正在开发中,tarlatamab是最领先的,已于2023年进入第3阶段临床。
Tarlatamab
Tarlatamab分子由两个单链可变片段(scFv)组成,并包括一个稳定的、无效应器功能的Fc结构域,以增加半衰期。目前,有六项正在进行的临床研究正在评估Tarlatamab,其中包括5项针对SCLC患者的试验和一项针对神经内分泌前列腺癌(NEPC)患者的1期试验。
Tarlatamab的FIH研究招募了107名经过至少一种先前治疗的进行性或复发性小细胞肺癌患者,10个剂量水平范围从0.003 mg到100 mg。从3mg队列开始采用分步给药,以减轻先前队列中观察到的CRS。从0.3毫克剂量水平开始出现响应,在25名患者中发现了确认的应答(ORR:23.4%),其中包括2名患者(1.9%)的完全应答和23名患者(21.5%)的部分应答(PR),30名患者(28%)为疾病稳定(SD)。疾病控制率为51.4%,中位PFS为3.7个月,中位OS为13.2个月。在确诊的应答者中,中位反应时间为1.8个月,中位持续时间(DOR)为12.3个月,这表明大多数应答者最早在第一次扫描时就可以观察到响应,其反应持续时间与其他SCLC治疗试验中观察到的反应持续时间相比是令人鼓舞的。
安全性方面,正在进行的DeLLphi-300 FIH试验(NCT03319940)中,90.7%(97/107)的患者经历了任何级别的TRAE,30.8%(33/107)经历了≥ 3级的TRAE。4名患者(3.7%)因TRAE中断治疗,未发现5级TRAE。细胞因子释放综合征(CRS)是最常见的TRAE,在52.3%(56/107)的患者中可见。Tarlatamab相关CRS的特征是短暂的轻度发烧和/或低血压,通常不需要血管升压药支持,通常发生在第一个治疗周期。通过支持性护理,可以控制与Tarlatamab相关的CRS。此外,除了CRS,53名患者(49.5%)发生了与治疗相关的神经系统不良事件,其严重程度大多为1级,其中最常见的不良事件是味觉障碍(22.4%)、头痛(10.3%)、意识模糊(5.6%)和头晕(5.6%)。
HPN328
HPN328是一种三特异性T细胞激活构建体(TriTAC),包括三个人源化抗体衍生的结构域:结合肿瘤细胞上DLL3的N端结构域、结合人血清白蛋白的中间结构域(用于半衰期延长)和结合CD3的C端结构域。
HPN328 1期试验的初步结果已经公布。18名SCLC和其他NECs患者接受了0.015mg/周至12.0 mg/周的剂量治疗,并采用了更高剂量的阶梯给药。总的来说,11名SCLC患者中有3名(27%)PR,包括一名SCLC患者,33%的SD。22%的患者出现1-2级CRS;在测试的剂量水平下没有观察到3级以上的CRS事件,目前尚未达到最大耐受剂量。
其他TCE
其它的DLL3/CD3 TCE还包括BI 764532和QLS31904。BI 764532是一种双特异性DLL3/CD3抗体,具有IgG骨架。QLS31904是另一种TCE,包括抗DLL3的特异性Fab片段、抗CD3的scFv片段和修饰的Fc区,以支持异二聚体。
BI 764532和QLS31904已进入1期临床试验,正在DLL3阳性SCLC和其他神经内分泌肿瘤患者中进行评估,尚未有临床数据公布。
DLL3靶向CAR疗法
CAR-T细胞疗法在治疗血液系统恶性肿瘤中中非常成功,这也促使人们聚焦其在实体瘤中的应用。DLL3作为一种治疗SCLC有前景的特异性靶点,一系列DLL3靶向小细胞肺癌CAR疗法正在开发和测试。
靶向DLL3的CAR-T疗法
AMG 119是一种CAR-T细胞疗法,包括编码抗DLL3的结构域、CD28和4-1BB共刺激结构域以及CD3胞内结构域。在临床前研究中,AMG 119对表达DLL3的SCLC细胞表现出特异性细胞毒性活性,并在SCLC异种移植物模型中表现出抗肿瘤活性。
AMG 119在5名复发/难治性小细胞肺癌患者中的1期临床试验显示,无剂量限制性毒性或≥4级的AE。一名患者出现PR,靶病变直径总和比基线减少43%,而另一名患者减少16%,多发性肝转移消失。这些初步数据为DLL3靶向小细胞肺癌的CAR-T细胞疗法的进一步开发提供了基础。
其他针对SCLC的DLL3靶向CAR-T细胞疗法,如LB2102和ALLO-213,正在开发中,但尚未启动临床试验。
靶向DLL3的CAR-NK疗法
CAR-NK细胞在临床前研究中显示出强大的特异性裂抗肿瘤解活性,并具有额外的优势,如更好的安全性和“现成”的可用性。用抗DLL3的scFv结构域、NKG2D跨膜结构域和2B4-CD3结构域组成的CAR-NK细胞表现出特异性抗肿瘤活性,并在免疫缺陷小鼠的肺转移肿瘤模型中诱导了肿瘤消退。DLL3-CAR-NK细胞在复发/难治性ES-SCLC患者中的1期临床试验最近开始招募患者(NCT05507593)。
DLL3靶向疗法的未来展望
DLL3作为生物标志物
Rova-T、tarlatamab和其他药物在临床前研究中显示出对表达DLL3的细胞和肿瘤的特异性。可以合理地假设,预选具有高DLL3表达的患者将提高DLL3靶向治疗的疗效。事实上,在Rova-T的FIH研究中,一项探索性亚组分析显示,DLL3高表达的患者相比DLL3低表达患者具有改善的ORR(35%对0%)和疾病控制(90%对60%)。然而,随后对Rova-T的临床研究,包括仅招募DLL3高表达患者的研究和分析DLL3高表达患者亚群的研究,并没有证实DLL3表达是预测治疗反应的生物标志物。
这可能有几种解释,如FIH研究中的患者数量有限,以及用于测量DLL3表达IHC技术的差异]。另一种理论认为,DLL3高表达患者缺乏反应可能与外周循环中Rova-T降解导致肿瘤部位药物浓度不理想有关。此外,使用肿瘤活检IHC作为评估肿瘤DLL3表达的技术具有某些缺点,如缺乏同期肿瘤活检——这是快速进展的癌症(如SCLC)中的一个潜在问题。原发性肿瘤和转移瘤之间DLL3表达的可变性也可能混淆结果。
最近的技术进步,如SCLC患者循环无细胞DNA中肿瘤特异性甲基化模式的检测和定量,可以潜在地预测疾病进展,促进临床试验中的患者分层,可能有助于优化治疗策略以最大限度地提高临床效益。
SCLC的亚型
有人提出,根据转录因子ASCL1、NeuroD1、YAP1和POU2F3的表达水平,SCLC可分为四种亚型,分别为SCLC-A、SCLC-N、SCLC-Y和SCLC-P。在随后的IHC研究中,YAP1蛋白在各亚型中的表达均较低,从而产生了一种包括SCLC-A、SCLC-N、SCLC-P和SCLC-I亚型的改良分类方法,其中SCLC-I指的是其他三种转录因子表达水平较低但与人白细胞抗原相关的基因表达水平较高的炎症状态。在IMpower133试验中,与其他亚型患者相比,SCLC-I亚型患者的OS有改善的趋势(18个月vs 10个月)。可以预期,SCLC亚型将在临床前研究中使用的PDX模型的选择中发挥重要作用,作为临床试验中的患者选择标准,并可能作为额外的预测标志。
与其他治疗方法的组合策略
将TCE和ADC与其他疗法相结合,可能会提供一种有效策略来降低耐药性,提高治疗效果。检查点抑制剂已被探索与ADC和TCE结合使用。一项1/2期研究评估了Rova-T与ICIs nivolumab和ipilimumab联合治疗严重预处理的ES-SCLC患者的疗效,与Rova-T(ORR:18%)或nivolumab单药治疗(ORR:11.6%)相比,组合策略的ORR为30%。
将常规化疗与靶向免疫疗法相结合是另一种产生协同作用的方法,有可能增强TCE的抗肿瘤作用。一项评估tarlatamab联合卡铂、依托泊苷和PD-L1抑制剂作为ES-SCLC患者一线治疗的研究已经启动(NCT05361395)。
小结
DLL3是目前SCLC和其他NETs非常有前景的治疗靶点,DLL3靶向的TCE在复发/难治性小细胞肺癌患者的早期临床研究中显示出令人鼓舞的初步疗效和安全性。而DLL3靶向ADC仍需要优化来提高治疗指数,包括优化给药、治疗间隔、治疗持续时间、连接子设计和毒素。尽管存在许多挑战,但DLL3靶向药物的临床数据已经为转移性小细胞肺癌患者带来了新的希望。
参考文献:
1.Emerging therapies targeting the delta-like ligand 3 (DLL3) in small cell lung cancer. J Hematol Oncol. 2023; 16: 66.

