Cell:多年磨一剑!华中科技大学马丁/高庆蕾/方勇等合作发现卵巢癌免疫治疗全新靶点
时间:2024-07-07 06:00:52 热度:37.1℃ 作者:网络
同源重组缺陷(HRD)在癌症中普遍存在,使肿瘤细胞对聚ADP核糖聚合酶(PARP)抑制敏感。然而,HRD及其相关治疗对肿瘤微环境(TME)的影响仍然是难以捉摸的。
2024年7月5日,华中科技大学同济医学院附属同济医院马丁院士与高庆蕾教授、方勇教授团队联合美国德克萨斯大学M.D. Anderson癌症中心梁晗教授团队共同在国际顶级期刊Cell 上发表了题为“Neoadjuvant PARPi or Chemotherapy in Ovarian Cancer Informs Targeting Effector Treg Cells for Homologous-Recombination-Deficient Tumors”的研究论文,该研究生成了单细胞基因表达和T细胞受体谱,以及来自>100个高级别浆液性卵巢癌(HGSOC)样本的验证性多模态数据集,主要来自II期临床试验(NCT04507841)。
新辅助单药治疗PARP抑制剂(PARPi)尼拉帕尼在RECIST v.1.1和GCIG CA125中分别获得了62.5%和73.6%的有效率。该研究发现效应调节性T细胞(eTregs)是HRD和新辅助治疗的关键应答者,与其他肿瘤反应性T细胞,特别是最终耗竭的CD8+ T细胞(Tex)共同发生。TME-wide干扰素信号与癌细胞上调MHC II类和共抑制配体相关,可能驱动Treg和Tex命运。在有或没有PARP抑制的HRD小鼠模型中,消耗eTregs显著抑制肿瘤生长而无明显毒性,强调了以eTregs为重点的治疗HGSOC和其他HRD相关肿瘤的潜力。

作为基因组不稳定性的主要驱动因素,同源重组缺陷(HRD)在人类癌症中经常发生(例如,在卵巢癌中约为50%)。它引起了广泛的兴趣,因为它具有合成致死率,其中这种缺陷使肿瘤容易受到聚(ADP-核糖)聚合酶(PARP)的抑制。多种PARP抑制剂已被批准用于卵巢癌、乳腺癌、前列腺癌和胰腺癌的治疗,还有更多的PARP抑制剂正在开发或用于各种实体和血液恶性肿瘤的治疗。
尽管最近的研究已经开始揭示HRD与人类癌症(包括卵巢癌)的肿瘤微环境(TME)之间的相互作用,但解码HRD和PARP抑制对TME的相互作用仍然是当务之急。这种表征的实际障碍,包括先前的治疗暴露和异质患者群体,阻碍了对TME可塑性的更深入理解和新型有效癌症治疗方法的发展。由于高级别浆液性卵巢癌(HGSOC)具有最高的HRD患病率,并且通常需要新辅助治疗来实现最佳减体积,因此它是表征HRD对治疗初期TME和PARP抑制引起的后续变化的影响的典型疾病。
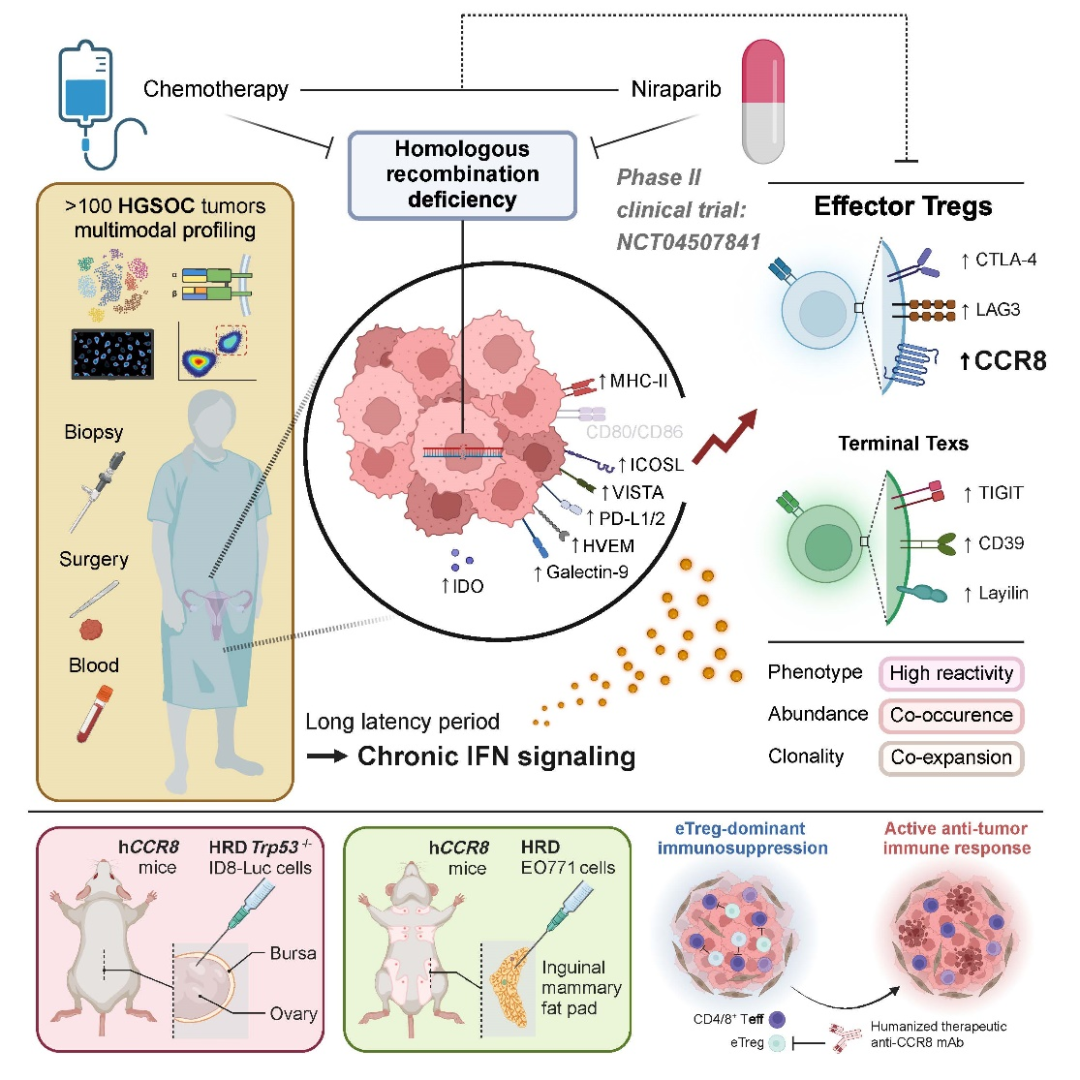
文章模式图(图源自Cell )
努力解决这一知识缺口将对理解为什么免疫检查点抑制剂(ICIs)在HGSOC中缺乏治疗益处的证据具有重要意义。在整个III期临床试验中,在化疗和/或靶向治疗(如贝伐单抗)中添加PD-1/PD-L1靶向药物(包括纳武单抗、avelumab和atezolizumab)未能在各种疾病环境中获得生存益处。在较小的队列中,纳武单抗联合靶向CTLA-4的伊匹单抗比单独纳武单抗显著提高无进展生存期。重要的是,在上述试验中,作为经典ICI生物标志物的PD-L1阳性评分并未显示出与缓解率(RR)一致的趋势。这些临床观察表明,除了PD-1/PD-L1信号外,HGSOC中存在复杂的免疫调节机制,需要对关键免疫因子进行全面的研究。
该研究利用临床研究中的大量样本来评估PARP对HRD HGSOC (NCT04507841)的抑制作用。同时,该研究从接受新辅助化疗(NACT)的患者中收集样本。这些样本的单细胞和大量多模态分析产生了有价值的数据,使该研究能够描述HRD和同源重组精通(HRP)肿瘤之间的TME差异以及新辅助治疗后它们的表型进化。
华中科技大学同济医学院附属同济医院交流学习博士/MD Anderson癌症中心博士研究生罗伊凯、华中科技大学同济医学院附属同济医院助理研究员夏宇、副教授刘眈、武汉市中心医院副主任医师李雄、同济医院博士研究生李华裔、博士后刘家豪、博士研究生周东晨以及普瑞基准科技(北京)有限公司董宇博士为该论文共同第一作者。同济医院高庆蕾教授、MD Anderson癌症中心梁晗教授、同济医院方勇教授和马丁院士为该论文共同通讯作者。同时,该成果还受到再鼎医药(上海)有限公司、同济医院兰培祥教授、同济医学院杨想平教授、美国加州大学旧金山分校彭方略博士和美国Broad研究所陈则宇博士等大力支持和帮助。
参考消息:
https://www.cell.com/cell/fulltext/S0092-8674(24)00653-6


