Nature Metabolism:NIH高斌教授团队揭示酒精代谢新概念:肝-肠轴调控解毒与饮酒行为
时间:2024-06-27 15:00:20 热度:37.1℃ 作者:网络
导 读
酒精使用障碍(alcohol use disorder, AUD)影响全球数百万人,导致高的发病率和死亡率,但药物治疗选择有限。肝脏被视为乙醇代谢产物乙醛(acetaldehyde, AcH)的主要解毒场所,而乙醛脱氢酶2(ALDH2)是参与AcH解毒的主要代谢酶,因此被认为是治疗AUD的靶点。
几十年来,肝脏在酒精代谢中的显著作用已为人所知。酒精在肝脏中的分解主要通过两步酶促反应进行。酒精脱氢酶(ADH)负责将乙醇转化为毒性中间产物乙醛(acetaldehyde, AcH)。然后,乙醛脱氢酶 ALDH,主要是ALDH2,将乙醛转化为更低毒性的乙酸,以进一步消除。早期研究数据推测,饮酒后大约90%的乙醇和~95%的乙醛在肝脏中进行代谢解毒。然而,美国国立卫生研究院(NIH)高斌教授团队的前期研究结论挑战了这一传统观念:相比较全身Aldh2基因敲除小鼠而言,肝脏特异性Aldh2基因敲除小鼠急性酒精灌胃后,血液中AcH的清除率仅部分减少~30%(Guillot, A., et al. PNAS, 2019)。这项发现引发了一个根本性问题——如果肝脏不是饮酒后酒精代谢及AcH清除唯一的场所,那么循环中大部分的AcH是如何从体内清除的呢?
近期,高斌团队最新研究发现,除了肝脏之外的多个器官(包括肠道)中选择性敲除Aldh2并未或仅略微提高血清AcH水平,而同时删除肝脏和肠道中的Aldh2则能起到协同作用,使饮酒后血清AcH水平接近全身Aldh2基因敲除小鼠的水平。机制研究提示,乙醇摄入后,肝脏生成的大部分AcH经胆汁排泄进入肠道,并通过肠上皮ALDH2进一步代谢,而肠道微生物在肠道腔内AcH的清除中起较小作用。团队通过基因编辑小鼠模型,多种动物活体手术模型,结合改变胆汁合成与分泌的饮食喂养模型,研究发现:肝-肠轴相较于单独的肝脏作用,能够协调促进系统AcH的清除并参与调控饮酒行为。联合靶向肝脏和肠道的ALDH2,以及干预胆汁的流动和分泌,可能成为新型治疗AUD的策略。
2024年6月20日,该研究以“Coordinated action of a gut–liver pathway drives alcohol detoxification and consumption”为题,发表在国际代谢领域著名学术期刊Nature Metabolism。期刊特邀学者撰写题为“Gut–liver highway of ALDH2 in drinking”的评论性文章于同日上线。美国国立卫生研究院酒精滥用与中毒研究所(NIH/NIAAA)终身研究员高斌教授为本项研究通讯作者,助理研究员付耀杰博士、Bryan Mackowiak博士为本项研究的共同第一作者。

肝脏和肠道的ALDH2协同作用有助于血液中乙醛的清除
为了寻找除肝脏以外,参与酒精代谢与系统AcH清除的器官,团队建立了10种不同器官特异性Aldh2敲除小鼠的小鼠模型,并检测急性酒精灌胃后,血清中乙醇(EtOH)与AcH的水平。结果显示,全身Aldh2基因敲除小鼠(Aldh2E2a-/-)血清中的AcH水平增加了18.11倍,而肝细胞中Aldh2基因敲除小鼠(Aldh2Hep-/-)和脂肪细胞中Aldh2基因敲除小鼠(Aldh2Adipo-/-)的血清中AcH水平分别增加了2.88倍和1.83倍。肠上皮细胞特异性Aldh2敲除小鼠(Aldh2Villin-/-)的血清中AcH水平有上升的趋势,但没有达到统计学显著性。令人惊讶的是,内皮细胞(Aldh2Tek-/-)、平滑肌(Aldh2MyhErt-/-)、骨骼肌(Aldh2Mck-/-)、皮肤(Aldh2K14Ert-/-)、胆管细胞(Aldh2Sox9Ert-/-)、肾脏(Aldh2Podocin-/-)和肺(Aldh2SftpcErt-/-)中Aldh2基因敲除并未导致血清中乙醇或AcH水平升高。而在肝脏和肠道中Aldh2双重敲除小鼠中,无论接受低剂量(2g/kg)或高剂量(5g/kg)乙醇灌胃后,血清中AcH均显著升高,且明显比单独在肝脏或肠道中Aldh2敲除小鼠更高。这表明,肠道和肝脏中的ALDH2协同促进了系统性的AcH清除。
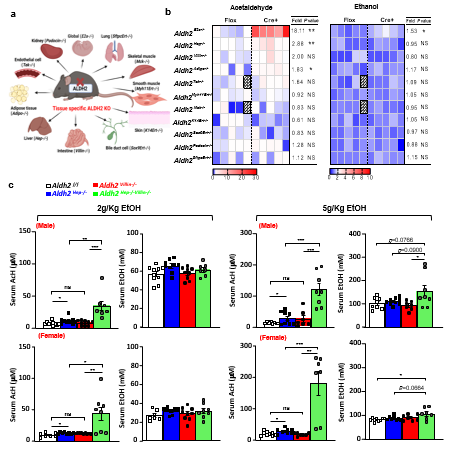
图1:肝脏和肠道通过ALDH2协同促进循环乙醛的清除。
来源:原文图1
胆汁排泄介导肝脏中的乙醛(AcH)分泌到肠道腔
肝细胞具有高度极性,有窦道(基底侧)和小管道(顶侧)膜,两者之间由紧密连接隔开。肝细胞不仅通过窦道膜向循环中分泌物质,还通过小管道膜将物质排泄到胆管中,进入胆囊,然后释放到十二指肠中。团队研究发现酒精灌胃后,胆囊容积增大,胆汁中的AcH水平约为血清中的5倍,而胆汁和血清中的酒精水平相近。此外,通过检测酒精灌胃后不同肠段局部AcH水平,胃肠道腔中检测到了高浓度的AcH,且AcH在十二指肠中浓度最高。肝脏Aldh2 敲除(Aldh2Hep-/-)小鼠肝脏组织,胆汁,和十二指肠腔内含物中的AcH水平比野生型(WT)小鼠更高。另外,通过胆管结扎(BDL)实验,团队证明了通过阻断肝脏到十二指肠腔的胆汁分泌,能著降低了十二指肠腔中的AcH水平。
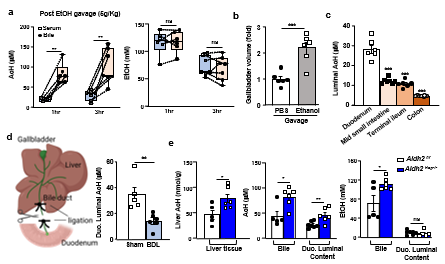
图2:胆汁流动是从肝脏清除乙醛进入肠道腔的关键途径。
来源:原文图2
干预胆汁排泄可调解饮酒行为
进一步,利用黑暗中饮酒行为实验(Drinking in the dark, DID)与双瓶选择(2- bottle choice, 2-BC)实验,团队评估了调节胆汁流动后小鼠饮酒行为的变化。首先,将UDCA饮食(利胆剂:可提高胆汁分泌与排泄)或对照饮食喂养的小鼠进行比较,发现:UDCA饮食的小鼠在DID实验中消耗的酒精比对照饮食的小鼠更多,并表现出比对照饮食的小鼠更强的酒精偏好。为减少肝内胆汁排泄,团队构建了Mdr2基因敲除小鼠(Mdr2-/-)并进行了DID或2-BC实验。与对照组小鼠相比,Mdr2-/-小鼠在DID实验中酒精消耗更少,并且在2-BC实验中在高乙醇浓度(9%,12%和15%)下,表现出较低的酒精偏好。
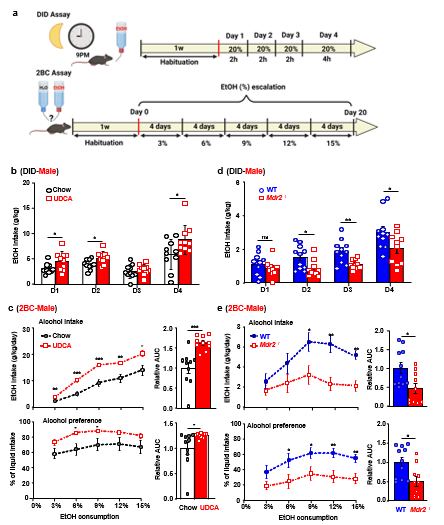
图3:干预胆汁排泄可调解饮酒行为
来源:原文图6
肝脏和肠道的ALDH2协同调解饮酒行为
以上数据清楚地表明,肝脏中的AcH通过胆汁排泄高效清除,提示肝脏和肠道协同清除AcH。接下来,团队检测了酒精灌胃后,肝脏-肠道Aldh2双重敲除(简写为:dKO小鼠),Aldh2单器官基因敲除小鼠, 以及野生型小鼠(WT小鼠)的门静脉血、胆汁,十二指肠腔中,小脑的AcH水平。数据提示:相比于Aldh2单器官基因敲除以及WT小鼠,dKO小鼠在各种样本中都检测出最高的AcH水平。另外,代谢指标测试数据表明,与WT小鼠相比,急性酒精灌胃后,dKO小鼠呼吸熵和碳水化合物氧化水平显著抑制,并与Aldh2单器官基因敲除小鼠表现出明显不同的代谢模式。最后,通过2-BC 与DID实验,团队发现:dKO小鼠与其他组小鼠相比,饮酒行为/酒精偏好受到明显抑制,酒精摄入量显著减少 。
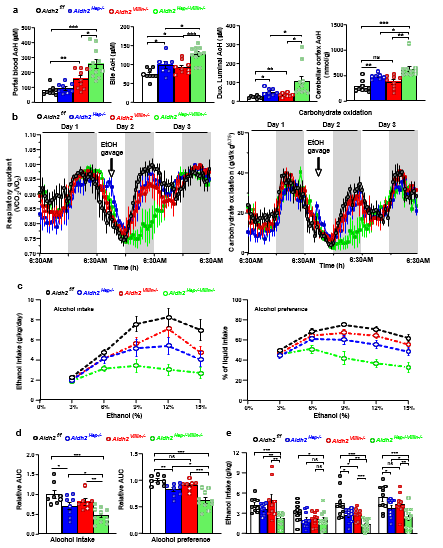
图4:肝脏和肠道的ALDH2协同调解饮酒行为
来源:原文图7
总而言之,该项研究表明,肝-肠轴相较于单独的肝脏作用,能够协调作用促进系统AcH的清除和调控饮酒行为。联合靶向肝脏和肠道ALDH2,以及胆汁流动和分泌的调控,可能是治疗AUD的潜在策略。
引证本文
Fu, Y., Mackowiak, B., Lin, YH. et al. Coordinated action of a gut–liver pathway drives alcohol detoxification and consumption. Nat Metab (2024).
https://doi.org/10.1038/s42255-024-01063-2
参考文献
1. Guillot, A., Ren, T., Jourdan, T., Pawlosky, R. J., Han, E., Kim, S. J., ... & Gao, B. (2019). Targeting liver aldehyde dehydrogenase-2 prevents heavy but not moderate alcohol drinking. PNAS, 116(51), 25974-25981.


