Circulation:内皮细胞对自噬的反应异质性驱动了肺动脉高压中小血管的肌化
时间:2024-06-15 16:00:15 热度:37.1℃ 作者:网络

背景
肺动脉高压(PH)是一种严重的心肺疾病,特征是肺小动脉的异常狭窄和重构,最终导致右心衰竭和死亡。内皮细胞(EC)在PH中的角色尤其重要,EC的凋亡和对凋亡抵抗细胞的增殖是该病的显著标志。然而,为何某些内皮细胞会死亡而另一些会增殖,以及这种差异如何促进血管重构,目前仍不清楚。本文假设这种差异性反应可能与以下几个因素相关:(1)不同的内皮细胞亚群(即肺动脉内皮细胞PAECs与微血管内皮细胞MVECs);(2)两种内皮细胞亚型的自噬激活;(3)导致MVECs被PAECs替代,从而引发远端血管的肌化。
方法
研究通过小鼠肺组织的单细胞RNA测序来评估不同内皮细胞亚群对慢性缺氧的反应。在人类和大鼠的PAECs和MVECs中,以及野生型小鼠或自噬基因Atg7缺陷的小鼠(Atg7EN-KO)的精确切割肺切片中,评估内皮细胞的增殖与凋亡反应、自噬激活及其作用。通过结构或表面标记物评估PH患者和动物模型肺组织中毛细血管前微血管内PAECs和MVECs的丰度。
结果
在体外和体内实验中,PAECs对缺氧作出增殖反应,而MVECs则发生凋亡。单细胞RNA测序分析支持这些发现,缺氧诱导动脉内皮细胞呈现抗凋亡、增殖性表型,而毛细血管内皮细胞则倾向于细胞死亡。这些不同的反应在缺氧的Atg7EN-KO小鼠或ATG7沉默后得到预防,但通过自噬刺激可再现。在来自小鼠、大鼠或PH患者的肺组织中,毛细血管前微动脉中的PAECs数量增加,而MVECs相对减少,表明微血管内皮细胞被大血管内皮细胞取代。通过基因或药物抑制自噬可在体内预防内皮细胞替代。缺氧PAECs而非MVECs的条件培养基促进肺动脉平滑肌细胞在血小板源性生长因子依赖方式下的增殖和迁移。自噬抑制在临床前模型中减轻了PH的发展和远端血管肌化。
具体而言,研究中发现PAECs在缺氧环境中表现出显著的增殖活性,而MVECs则显著凋亡。单细胞RNA测序结果进一步证实,缺氧诱导动脉内皮细胞呈现出抗凋亡、增殖性的表型,而毛细血管内皮细胞则表现出细胞死亡的倾向。这种差异反应在Atg7EN-KO小鼠中得到预防,表明自噬在这一过程中起关键作用。
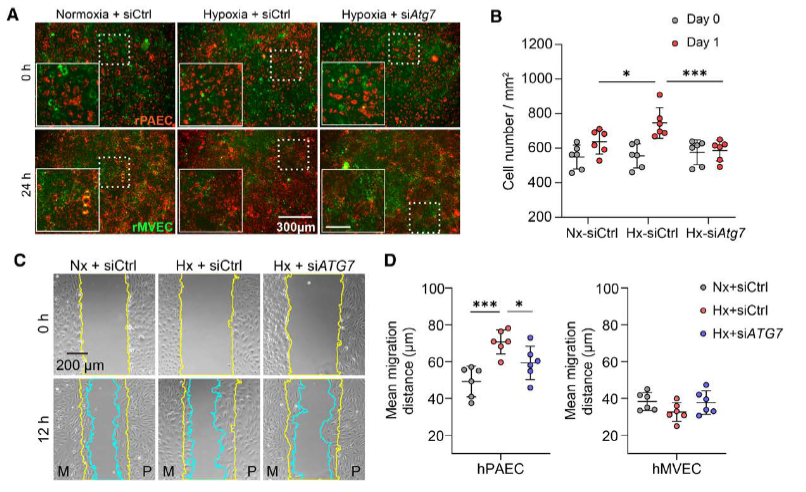
在对肺组织的进一步分析中发现,PH患者和动物模型的毛细血管前微动脉中PAECs的数量增加,而MVECs相对减少,表明MVECs被PAECs取代。这一替代过程可通过基因或药物抑制自噬在体内得到预防。这些发现表明,自噬激活不仅促进了PAECs的增殖,还导致了MVECs的凋亡,最终导致MVECs被PAECs取代。
结论
本研究揭示了缺氧通过自噬激活同时诱导PAECs增殖和MVECs凋亡的机制。这些差异性反应导致毛细血管前肺动脉微动脉中MVECs被PAECs逐步替代,形成了一个宏观血管环境,进而促进肺动脉平滑肌细胞的增殖和迁移,最终驱动远端血管肌化和PH的发展。这一发现为PH的治疗提供了新的视角,提示通过抑制自噬可能是预防或减轻PH进展的有效策略。未来需要更多的研究来进一步验证这些发现并探索潜在的治疗方法。
参考文献:
Zhang Q, Yaoita N, Tabuchi A, Liu S, Chen SH, Li Q, Hegemann N, Li C, Rodor J, Timm S, Laban H, Finkel T, Stevens T, Alvarez DF, Erfinanda L, de Perrot M, Kucherenko MM, Knosalla C, Ochs M, Dimmeler S, Korff T, Verma S, Baker AH, Kuebler WM. Endothelial Heterogeneity in the Response to Autophagy Drives Small Vessel Muscularization in Pulmonary Hypertension. Circulation. 2024 Jun 14. doi: 10.1161/CIRCULATIONAHA.124.068726. Epub ahead of print. PMID: 38873770.


