戚锐锋/冷越:晚期乳腺癌HER2异质性探讨
时间:2024-06-12 17:00:18 热度:37.1℃ 作者:网络
编者按:乳腺癌的诊疗基于分子分型进行差异化管理,分子分型已经深植临床实践。肿瘤异质性是恶性肿瘤的特征之一,同一肿瘤中存在不同的癌细胞亚群,基因组学(如基因组、体细胞突变和表观遗传修饰等)和肿瘤生物学(转录组、蛋白质组、代谢组等)存在显著差异,在乳腺癌HER2评估过程中,发现HER2过表达和扩增情况呈现不同的异质性模式。
本期「专家组稿」由河北医科大学第四医院崔彦芝教授担任执行主编,与新疆巴州人民医院戚锐锋教授、 冷越医生共同分享《晚期乳腺癌HER-2异质性探讨》,为医者和患者提供更多参考。
乳腺癌在我国女性恶性肿瘤中的发病率高居第1位,根据传统的组织病理结果中激素受体(hormone receptor, HR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)及细胞周期调节蛋白-67(Ki-67)表达水平,临床上乳腺癌主要分为4种预后不同的亚型:Luminal A型、Luminal B型、人表皮生长因子受体2(HER-2)阳性型和三阴型乳腺癌(triple-negative breast cancer, TNBC)。HER2阳性乳腺癌约占全部乳腺癌的 20%~25%[1],HER-2是乳腺癌重要的驱动基因和预后指标,也是抗HER-2药物治疗的主要疗效预测指标。现分享一例her-2异质性晚期乳腺癌诊治情况及相关文献复习。
基本情况:患者女性,56岁,汉族,绝经后。
主因:发现左乳房占位1年余”2023-03就诊。
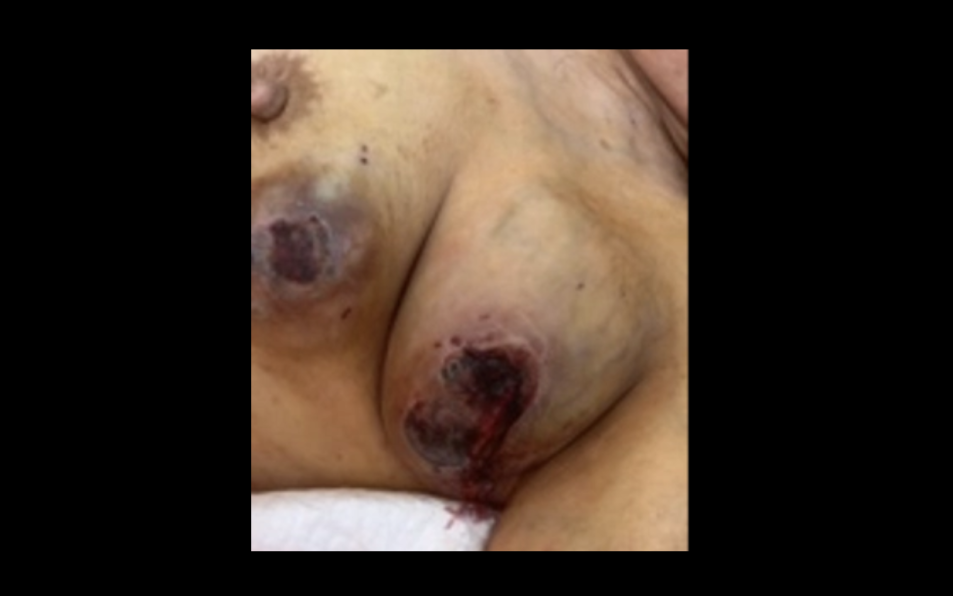
查体:左侧腋窝及左乳腺可见破溃肿物,质硬,活动度差。既往体健无特殊。左腋窝肿物破溃出血明显。给予介入栓塞止血并活检。
辅助检查:乳腺彩超(2023-03-11):左乳实性占位(BI-RADS 6类);左乳乳腺上方至腋窝实性包块,考虑转移。
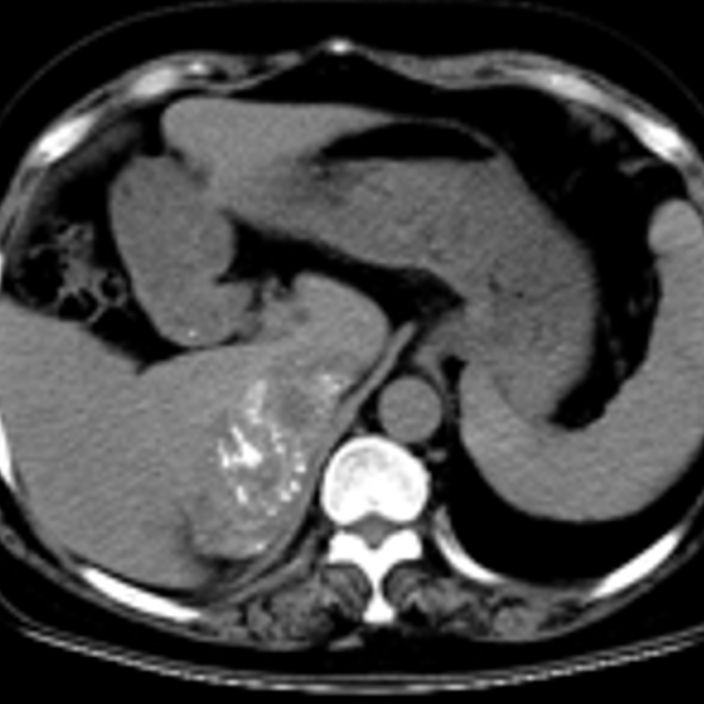
增强CT(2023-03-11):1.左乳恶性腺肿瘤伴左侧腋窝、左胸廓入口处多发淋巴结转移。2.左肺下叶及右肺上叶结节灶,考虑转移瘤可能。3.双侧肾上腺区占位灶,考虑转移可能性大。4.右侧附件区结节灶,与子宫分界不清,考虑是子宫肌瘤?转移结节?
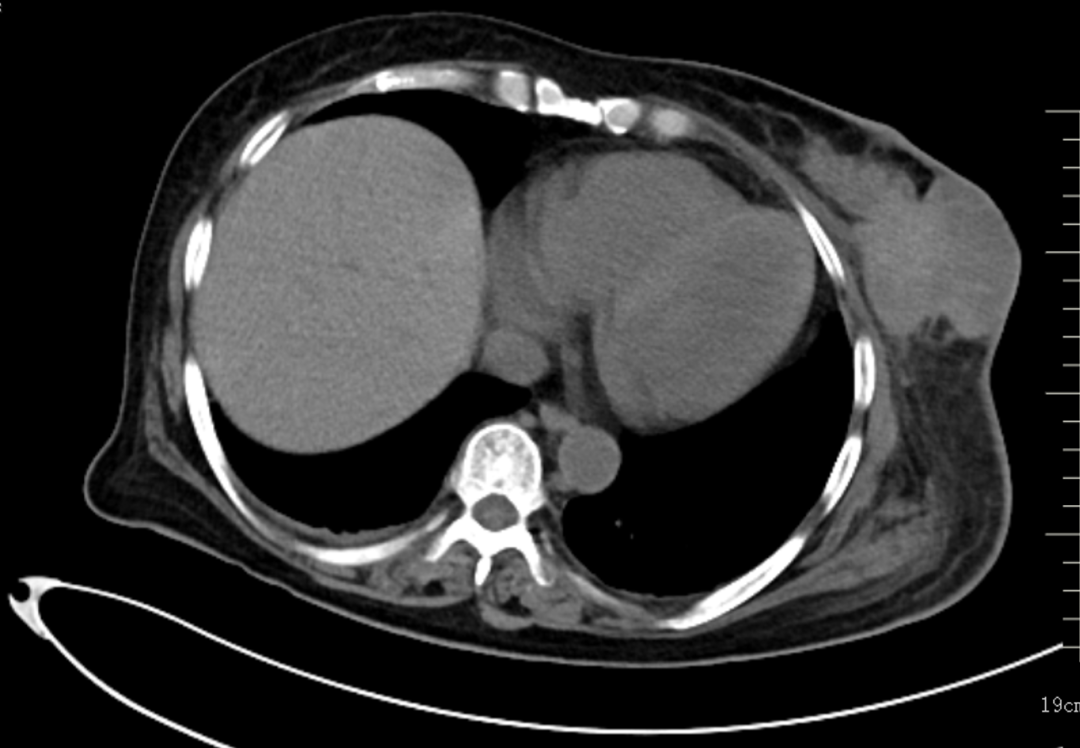
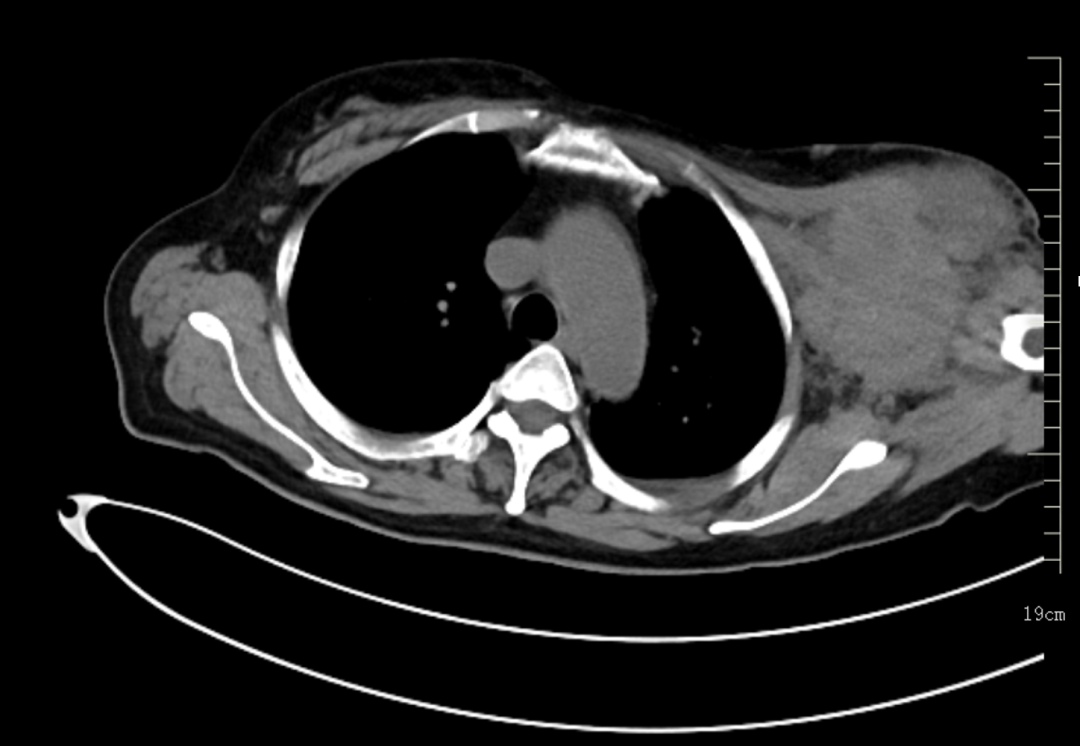
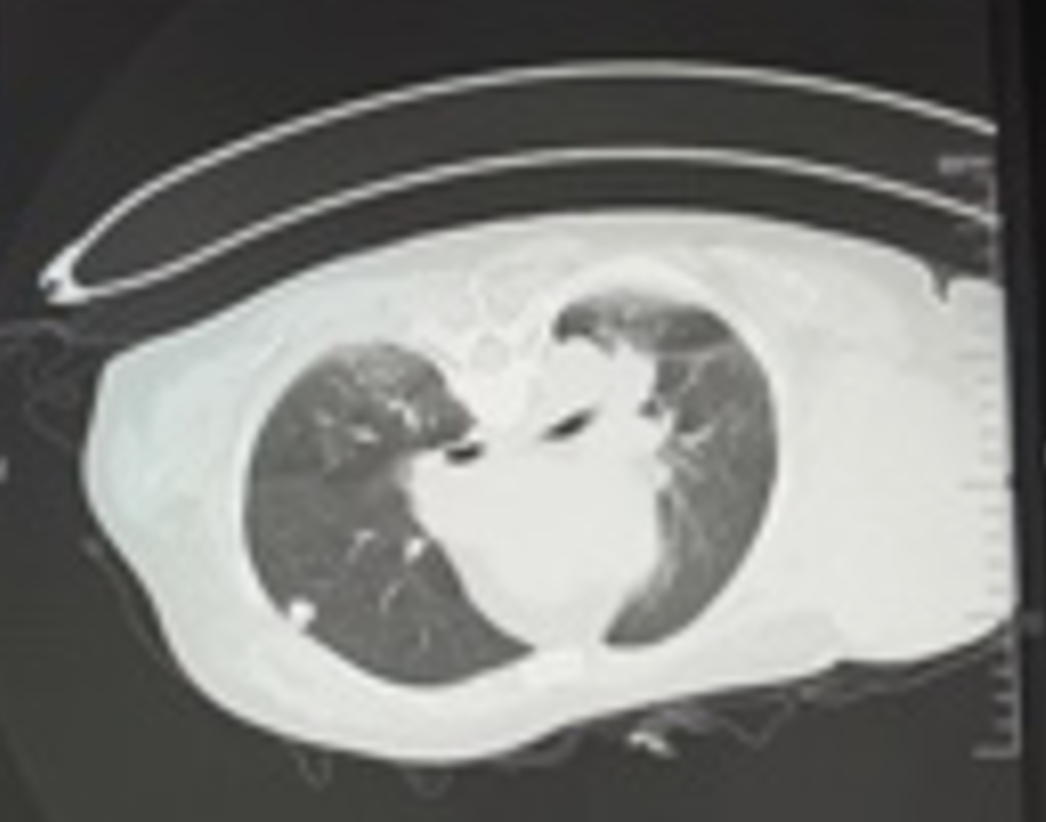
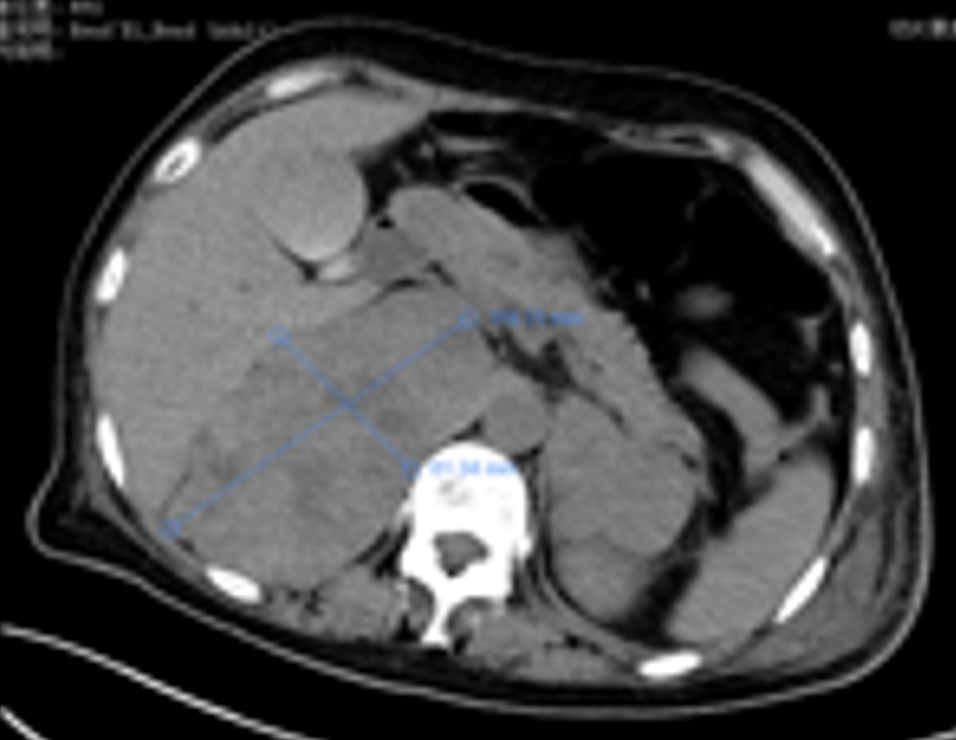

2023-03-09穿刺活检病理:(左侧腋窝)纤维组织内查见癌组织,免疫组化:ER(3+,>95%)、PR(+,约5%)、Her-2(2+)、Calponin(-)、CK5/6(-)、EGFR(-)、ki-67指数约(20%)、P63(-)、AR(弱+)、GATA3(+)、S-100(-)、Syn(部分+)、CgA(-)、CD56(-)。支持浸润性乳腺癌。FISH:未扩增。(左侧乳腺)浸润性癌伴局灶实性乳头状结构。免疫组化:ER(3+,>95%)、PR(+,约5%)、Her-2(2+)、Calponin(-)、CK5/6(-)、EGFR(-)、ki-67指数约(热点区约50%)、P63(-)、AR(弱+)、GATA3(+)、S-100(-)、Syn(部分+)、CgA(-)、CD56(-)。病理诊断:(左侧)乳腺浸润性癌(非特殊类型,WHO Ⅱ级)。FISH:未扩增。
诊断:左侧乳腺恶性肿瘤(浸润性癌 Luminal B型 cT4N3M1 IV期)
左侧腋窝淋巴结、双肺、肾上腺转移
一线治疗:化疗,TAC×2周期(2023-03-28、2023-04-19)
2023-05-7复查胸腹CT:左乳及左腋窝转移淋巴结较前略缩小,其余病灶变化不大。
疗效评价:SD(缩小)。因IV骨髓抑制伴发热,未再继续该方案。
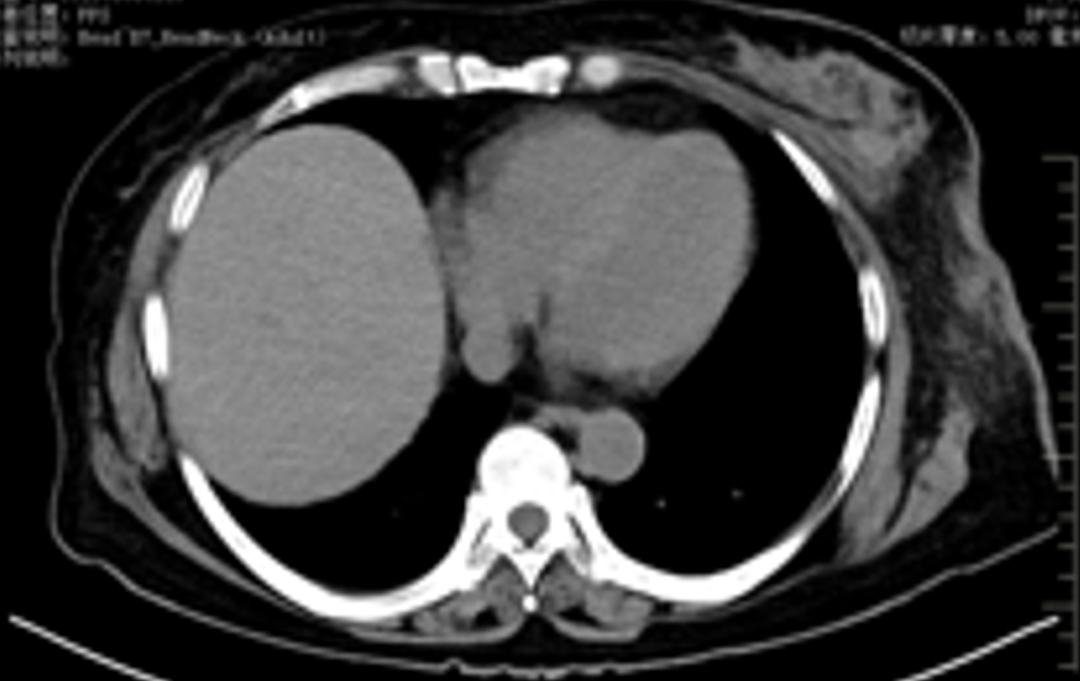
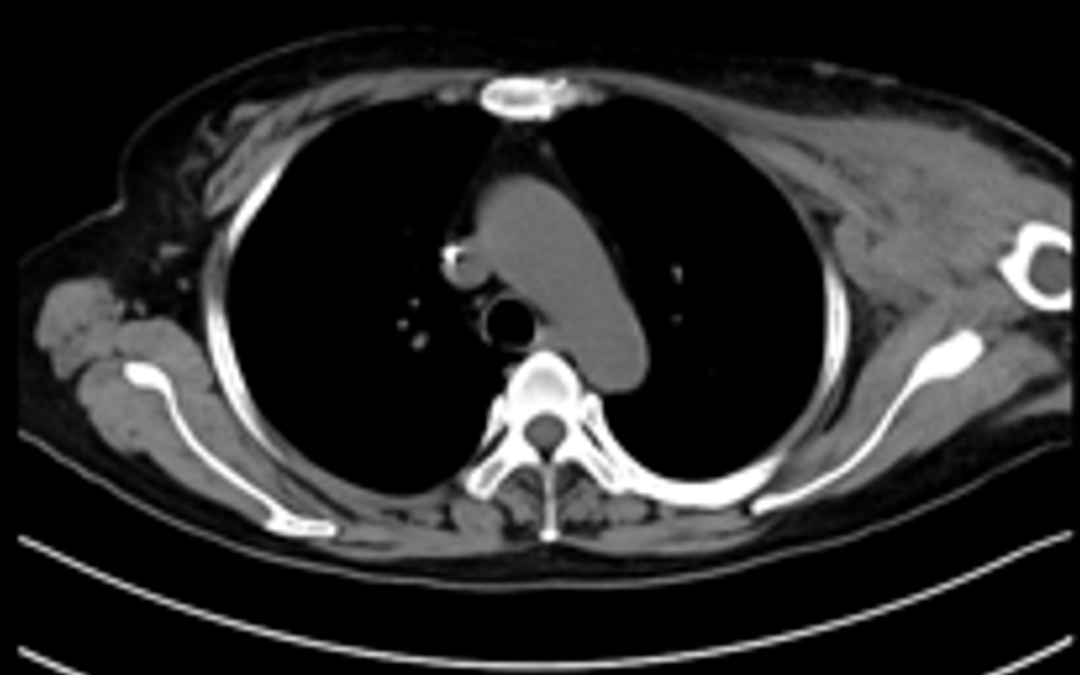
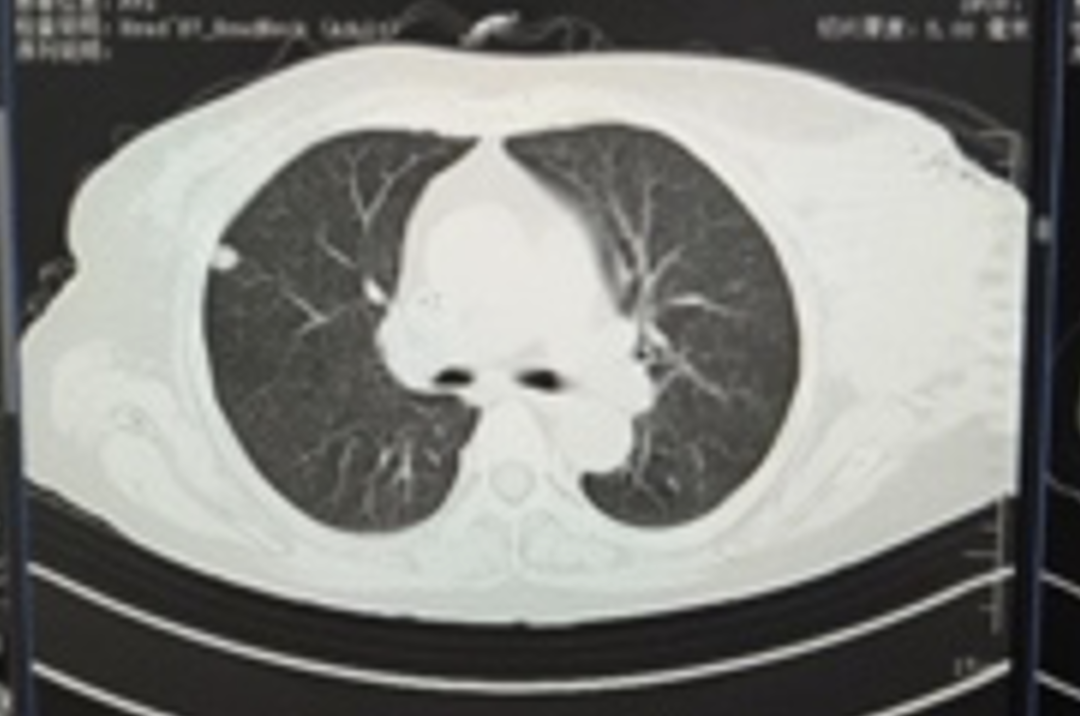
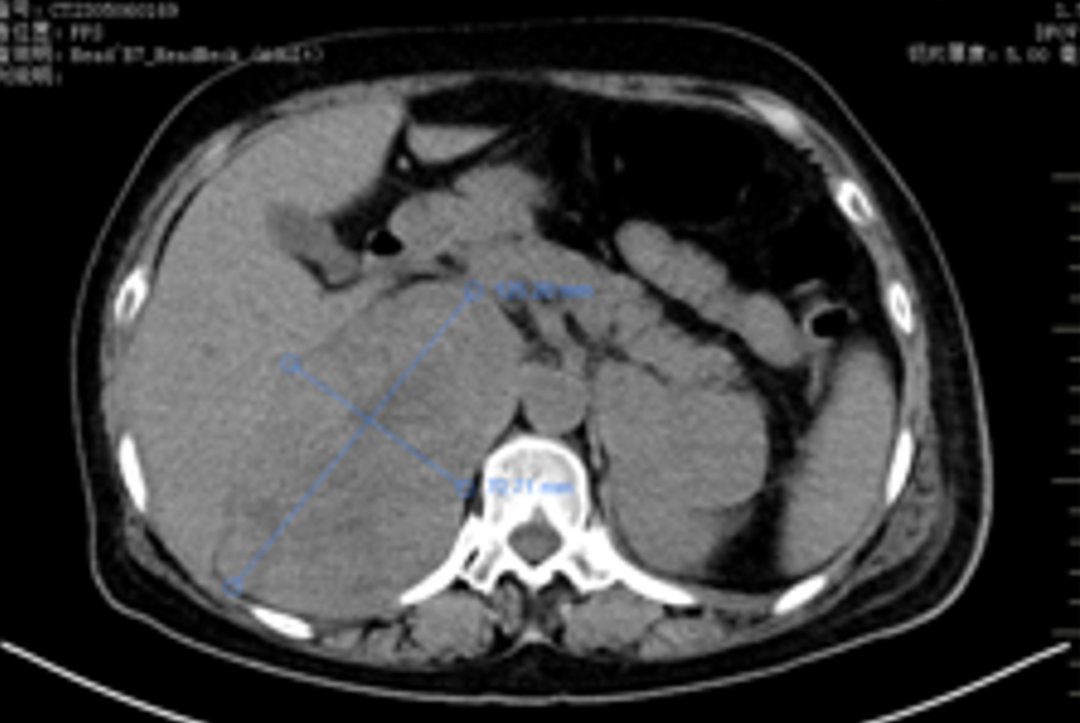

肾上腺病灶活检,病理(2023-05-10):(肾上腺活检组织)纤维组织内查见癌。
免疫组化:CD31(血管+)、MUC1(提示部分区域极向反转+)、α-inhibin(-)、Calretinin(-)、WT-1(-)、PAX-8(-)、GATA3(+)、β-catenin(细胞膜+)、E-ca(+)、Her-2(3+)、ER(3+,>95%)、PR(-)、ki-67指数约(10%)、S-100(-)、Syn(部分细胞+)、CgA(-)、CD56(-)、GCDFP-15(-)、CK7(+)、P40(-)、SATB2(部分细胞+)。
病理诊断:(肾上腺活检组织)纤维组织内查见癌,符合转移性乳腺癌。FISH检测:扩增。
靶向+化疗(2023-07-21~2023-11-24):TH*6(因经济未用帕妥珠单抗)
维持治疗(2023-12-16~2024.01.27):H+来曲唑。(疗效评价 PR )
增强CT(2024-01-26):1.左侧乳腺恶性肿瘤伴左侧腋窝多发淋巴结转移,与2023年12月15日片对比较大病灶形态改变,左乳外上象限皮下结节较前略变大,余病灶变化不显著。2.双侧肾上腺区占位灶,右侧肾上腺区病灶与肝右叶分界不清,考虑:转移瘤,与前片对比病灶变化不显著。3.右侧附件区结节灶,与前片对比未见明显变化。
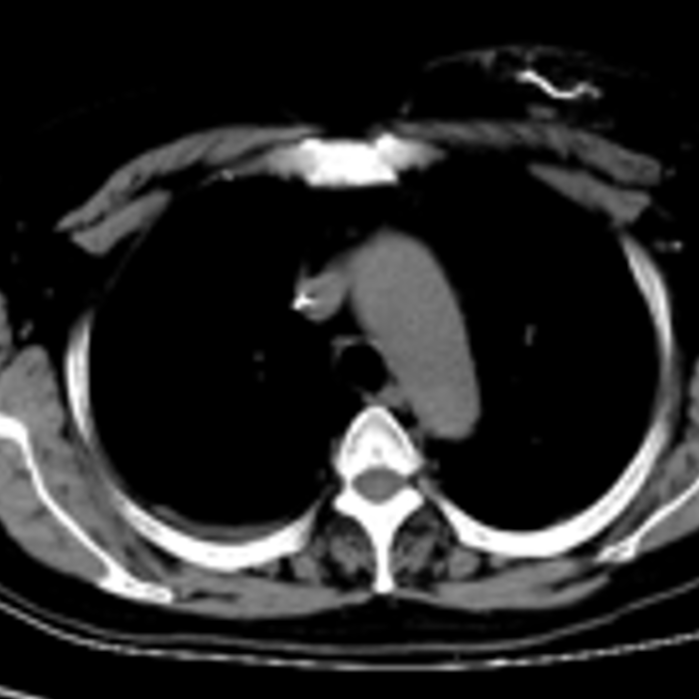
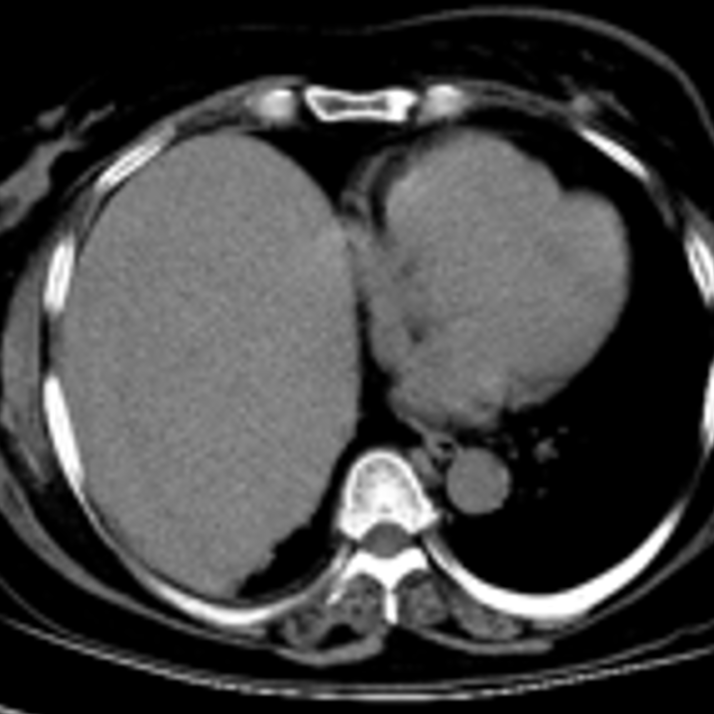

2024-01-27开始:曲妥珠单抗+吡咯替尼+来曲唑。待返院评估。
讨论
肿瘤异质性是恶性肿瘤的特征之一,同一肿瘤中存在不同的癌细胞亚群,基因组学(如基因组、体细胞突变和表观遗传修饰等)和肿瘤生物学(转录组、蛋白质组、代谢组等)存在显著差异。乳腺癌的诊疗基于分子分型进行差异化管理,广义上讲,相对于其他癌种,乳腺癌在精准治疗方面是先行一步的。目前,分子分型已经深植临床实践,检查方法及判断标准也已经非常成熟。HER2检测使更多的患者能从曲妥珠单抗等抗HER2靶向药物治疗中获益。在乳腺癌HER2评估过程中,发现HER2过表达和扩增情况也呈现不同的异质性模式。
本案例患者原发灶及淋巴结活检FISH her-2阴性,多药化疗乳腺病灶及淋巴结明显缩小,单肾上腺病灶效果不佳,检测肾上腺转移灶her-2阳性。加用抗Her-2治疗,肿瘤明显缩小,疗效显著。表现为同一患者不同部位存在HER2表达不同或扩增状态不同,即HER2异质性。
HER2异质性指同一肿瘤不同区域或同一患者不同部位及不同时间的肿瘤存在HER2表达不同或扩增状态不同。一项96例通过组织芯片比较样本不同三个区域HER2表达的研究显示:IHC1+和IHC2+的患者相较于IHC3+具有更强的异质性[2]。有研究将17号染色体多聚体的频率增加与HER2异质性联系在一起,乳腺癌中17号染色体多聚体罕见,更常见17号染色体着丝粒(CEP17)的获得或扩增,在HER2异质性肿瘤中观察到CEP17的拷贝数增加,这表明染色体不稳定性可能是引起HER2异质性的一个潜在原因[3,4]。越来越多研究表明,HER2表达在同一个肿瘤病灶(瘤内空间异质性)和不同肿瘤部位(瘤间空间异质性)以及治疗过程中(时间异质性)的差异可能影响抗HER2治疗的治疗应答和耐药[5]。存在HER2瘤内异质性的肿瘤对抗HER2治疗具有更差的治疗应答。基于IHC、ISH和mRNA定量评估等技术,多项研究对此进行过生物标志物分析。例如,在比较恩美曲妥珠单抗(T-DM1)、T-DM1+帕妥珠单抗和曲妥珠单抗+紫杉醇一线治疗HER2阳性晚期乳腺癌的MARIANNE试验中,HER2 mRNA高表达水平(>中位数)的患者无论接受哪一种方案,PFS均更长(曲妥珠单抗+紫杉醇:15.9个月vs 12.4个月;T-DM1:18.6个月 vs 10.2个月;T-DM1+帕妥珠单抗:18.7个月 vs 14.5个月)[6]。此外,与曲妥珠单抗+紫杉醇组相比,局部的HER2表达与T-DM1组较短的PFS相关(6.4个月 vs 12.4个月),表明含化疗方案在治疗异质性肿瘤时可能具有优势。在EMILIA和TH3RESA两项试验的生物标志物分析中,较高水平的HER2 mRNA(超过中位数)与T-DM1用于二线和三线治疗具有较长的PFS相关[7,8]。表明,HER2 mRNA水平低于中位数的肿瘤对HER2依赖性较低且异质性更强,可能与抗HER2靶向治疗应答较差相关。
HER2 阳性晚期乳腺癌的一线治疗已进入双靶时代,目前有曲妥珠单抗联合帕妥珠单抗的曲帕双靶和曲妥珠单抗联合吡咯替尼的大小分子联合双靶两个治疗方案可以选择。PHILA 研究证明了曲妥珠单抗联合吡咯替尼的大小分子联合双靶治疗方案的优效性,亚组分析显示,无论既往是否使用过曲妥珠单抗,大小分子联合双靶方案都可以改善患者的预后。包括ADC类药物在内的越来越多的新型药物也在不断提供新的证据,期待将来这部分患者的治疗可以有更多的选择。
点评
HER2的评估是乳腺癌患者靶向治疗决策的关键,乳腺癌中HER2的表达或扩增广泛存在空间异质性和时间异质性,HER2的异质性可能是导致免疫组化与原位杂交、原发灶与复发/转移灶、新辅助治疗前后、穿刺标本与手术切除标本HER2检测结果不一致的重要原因,且与较差的预后和靶向药物反应不良相关。而HER2低表达病例异质性更为显著。近年来,随着新型抗体药物偶联物(ADC)的快速发展和HER2低表达概念的提出,为HER2低表达乳腺癌患者带来了新的希望,也给HER2精准判读带来了新的挑战。HER2异质性是影响HER2低表达精准判读的重要因素。因此需要加强对HER2异质性的认识;为避免患者失去潜在靶向治疗的机会,需要对复发/转移灶及治疗后残余病灶(尤其是之前HER2 IHC 0的患者)再次进行HER2检测,必要时对原发灶增加单次HER2检测的蜡块数量。HER2 阳性晚期乳腺癌患者可选择的治疗药物很多,预后得以显著改善,对现有治疗模式也会产生积极影响。
参考文献:
[1] Ross J S, Slodkowska E A, Symmans W F, et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 2009;14(4):320-368. DOI: 10.1634/theoncologist.2008-0230;
[2] Seol H, Lee HJ, Choi Y et al. Intratumoral heterogeneity of HER2 gene amplification in breast cancer: its clinicopathological significance. Mod Pathol 2012; 25:938-948.
[3] Shafi H, Astvatsaturyan K, Chung F et al. Clinicopathological significance of HER2/neu genetic heterogeneity in HER2/neu non-amplified invasive breast carcinomas and its concurrent axillary metastasis. J Clin Pathol 2013; 66: 649-654.
[4] Kurozumi S, Padilla M, Kurosumi M et al. HER2 intratumoral heterogeneity analyses by concurrent HER2 gene and protein assessment for the prognosis of HER2 negative invasive breast cancer patients. Breast Cancer Res Treat 2016; 158: 99-111.
[5] Valenza C, Guidi L, Battaiotto E, et al. Targeting HER2 heterogeneity in breast and gastrointestinal cancers. Trends Cancer. 2023 Nov 25:S2405-8033(23)00229-7.
[6] Perez EA, de Haas SL, Eiermann W, et al. Relationship between tumor biomarkers and efficacy in MARIANNE, a phase III study of trastuzumab emtansine ± pertuzumab versus trastuzumab plus taxane in HER2-positive advanced breast cancer [published correction appears in BMC Cancer. 2019 Jun 24;19(1):620]. BMC Cancer. 2019;19(1):517.
[7] Kim SB, Wildiers H, Krop IE, et al. Relationship between tumor biomarkers and efficacy in TH3RESA, a phase III study of trastuzumab emtansine (T-DM1) vs. treatment of physician's choice in previously treated HER2-positive advanced breast cancer. Int J Cancer. 016;139(10):2336-2342.
[8] Baselga J, Lewis Phillips GD, Verma S, et al. Relationship between Tumor Biomarkers and Efficacy in EMILIA, a Phase III Study of Trastuzumab Emtansine in HER2-Positive Metastatic Breast Cancer [published correction appears in Clin Cancer Res. 2018 Nov 1;24(21):5486]. Clin Cancer Res. 2016;22(15):3755-3763.


