【论著】| 托法替布治疗激素抵抗型免疫检查点抑制剂相关心肌炎的临床研究
时间:2024-06-09 06:00:09 热度:37.1℃ 作者:网络
[摘要] 背景与目的:激素抵抗型免疫检查点抑制剂相关心肌炎(steroid-resistant immune checkpoint inhibitor-associated myocarditis,srICIAM)是一种在接受免疫治疗后出现的心脏相关不良反应,患者总体预后较差。既往研究显示,包含Janus激酶(Janus kinase,JAK)抑制剂托法替布在内的免疫强化抑制治疗可能对srICIAM具有一定疗效。然而,由于缺乏足够的临床数据,其治疗效果及对于肿瘤病情的影响尚不明确。本研究旨在探讨托法替布对srICIAM的治疗效果。方法:本项回顾性病例对照研究连续纳入了2019年7月—2022年5月在复旦大学附属中山医院接受免疫检查点抑制剂治疗且出现srICIAM的36例恶性肿瘤患者。接受糖皮质激素联合托法替布治疗的患者被分配至托法替布组(n=19),未使用托法替布治疗的患者被分配至对照组(n=17)。比较两组患者在临床特征、检验指标、影像学检查结果等方面的数据。同时对这些患者进行随访以监测心血管终点事件的发生。研究方案经过复旦大学附属中山医院伦理委员会批准(批准号:B2021-275R)。本研究按照《赫尔辛基宣言》的伦理学规范进行。结果:与对照组相比,在糖皮质激素累积剂量及持续时间差异无统计学意义(P>0.05)的情况下,托法替布组的心肌炎恢复时间更短(中位恢复时间:86.5 d vs 126.5 d,P=0.021)。托法替布组的心肌炎相关死亡率显著低于对照组(5% vs 35%,P=0.025)。结论:托法替布可在一定程度上降低srICIAM患者的死亡率并缩短康复时间,同时对于肿瘤患者的预后未产生不良影响。其可能成为srICIAM的潜在治疗药物之一。
[关键词] 免疫检查点抑制剂;免疫疗法;心肌炎;Janus激酶抑制剂
[Abstract]Background and purpose: Outcomes for cancer patients with steroid-resistant immune checkpoint inhibitor-associated myocarditis (srICIAM) are poor. Intensified immunosuppressive therapies, including tofacitinib, a novel Janus kinase (JAK) inhibitor, may have some therapeutic benefits. However, due to the lack of sufficient clinical data, the effectiveness of such treatments and their impact on cardiovascular outcomes remain unclear. This study aimed to investigate the therapeutic effect of tofacitinib on srICIAM. Methods: This retrospective case-control study included 36 malignant tumor patients who received immune checkpoint inhibitor treatment at Zhongshan Hospital affiliated to Fudan University from July 2019 to May 2022 and developed srICIAM. Patients receiving corticosteroids in combination with tofacitinib were assigned to the tofacitinib group (n=19), while those not treated with tofacitinib were allocated to the control group (n=17). The study compared clinical characteristics, laboratory findings, and imaging results between the two groups. Additionally, follow-up was conducted to monitor the incidence of cardiovascular endpoints in these patients. The research plan was approved by the Ethics Committee of Zhongshan Hospital Affiliated to Fudan University (Approval Number: B2021-275R). This study was conducted in accordance with the ethical guidelines of the Helsinki Declaration. Results: Compared to the control group, and with no significant difference in the cumulative dose and duration of corticosteroids (P<0.05), the tofacitinib group showed a shorter myocarditis recovery time (median recovery time: 86.5 days vs 126.5 days, P=0.021). The myocarditis-related mortality rate was significantly lower in the tofacitinib group than in the control group (5% vs 35%, P=0.025). Conclusion: Tofacitinib may reduce mortality and promote cardiac recovery in srICIAM patients without impeding the anti-tumor effect. It may become one of the potential treatment strategies in the future.
[Key words] Immune checkpoint inhibitors; Immunotherapy; Myocarditis; Janus kinase inhibitor
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)深刻改变了抗肿瘤治疗的格局。约50%的癌症患者被认为适合接受ICI治疗,其中大多数患者均能有所获益[1-2]。然而,使用ICI可能会破坏人体的免疫稳态,从而诱发免疫相关不良事件(immune-related adverse event,irAE),例如心肌炎、肌炎和肝炎等[3]。免疫检查点抑制剂相关心肌炎(immune checkpoint inhibitors-associated myocarditis,ICIAM)的发生率较低,为0.21%~3.30%,然而却有很高的致死率(27.00%~67.00%),是尤为严重的irAE之一[4-5]。停用ICI并尽快使用糖皮质激素治疗是ICIAM的首选治疗方法,但仍有部分患者对于激素治疗不敏感[6]。根据现有指南和专家共识[7],这类患者被定义为激素抵抗型免疫检查点抑制剂相关心肌炎(steroid-resistant immune checkpoint inhibitor-associated myocarditis,srICIAM)。指南推荐对于这部分患者在早期联合免疫抑制治疗[7],包括英夫利昔单抗、吗替麦考酚酯、抗胸腺细胞球蛋白、阿巴西普、托法替布在内的多种治疗药物,均有一定的治疗srICIAM的效果[8-12]。然而,由于缺乏足够的临床数据支持,目前指南中尚未推荐特定的免疫抑制药物用于治疗srICIAM。因此,有关免疫抑制治疗对于srICIAM的疗效评估,还需要更多的临床数据以进一步证实。
托法替布被广泛用于类风湿性关节炎、银屑病关节炎和溃疡性结肠炎等自身免疫性疾病的治疗中[13-14]。托法替布通过抑制Janus激酶(Janus kinase,JAK)阻断促炎细胞因子的下游信号转导,从而发挥抑制炎症的作用[14-15]。然而,近期的临床研究[16]表明,长期使用托法替布可能会提高恶性肿瘤的发病率。因此,我们进行了一项回顾性的临床研究,旨在更好地探索托法替布对srICIAM的治疗效果及其对肿瘤控制的后续影响。
1 资料和方法
1.1 研究对象及方法
本项回顾性病例对照研究连续纳入了2019年7月—2022年5月在复旦大学附属中山医院接受ICI治疗并发展为srICIAM的36例患者。所有ICIAM的诊断都是基于Bonaca的标准进行的[17]。此外,srICIAM的诊断基于2022年欧洲心脏病学会心脏肿瘤学指南中有关srICIAM的定义:在接受3 d足量糖皮质激素治疗后,心肌肌钙蛋白T(cardiac troponin T,cTnT)未下降到峰值的50%以下,或房室传导阻滞、室性心律失常仍存在,左心室收缩功能持续异常[7]。
1.2 研究方法
在糖皮质激素治疗的早期阶段(30 d内)接受托法替布(每日两次,每次5 mg)治疗的患者被归入托法替布组(tofacitinib group),未接受托法替布治疗的患者被分配到对照组(comparator group)。
通过电子病例系统对于包括人口统计学数据、心血管风险因素、心肌炎发病时间、糖皮质激素累积剂量和总使用时间、心肌炎恢复时间、心电图、超声心动图、心脏核磁共振(cardiac magnetic resonance,CMR)检查和生物标志物在内的数据进行了收集。肿瘤相关的数据包括癌症类型、免疫治疗类型以及基于实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1的心肌炎治疗前后肿瘤的影像学评估结果[18]。心肌炎相关数据包括临床表现、心电图、cTnT水平、超声心动图和CMR等结果。我们同时收集了与心肌炎合并发生的irAE的情况,并根据美国临床肿瘤学会的指南对心肌炎的严重程度进行了分级[19]。心肌炎的CMR诊断基于2018年的Lake Louise标准[20]。心肌活检的病理学诊断结果由两名经验丰富的病理科医师根据Dallas标准[21]作出。cTnT≥0.014 ng/mL被定义为异常。糖皮质激素的剂量转化为甲泼尼龙等效剂量以统一。心肌炎的康复被定义为符合以下条件:① cTnT恢复到基线水平;② 新发现的心电图异常恢复正常;③ 新发的左心室收缩功能异常恢复。左心室收缩功能异常被定义为超声心动图测量的左心室射血分数(left ventricular ejection fraction,LVEF)与治疗前相比下降大于10%或LVEF低于50%,如无治疗前LVEF数据,则以LVEF小于50%作为评判标准[22]。
本研究对ICIAM幸存患者进行随访,以了解患者在接受心肌炎治疗后肿瘤病情的进展,基于RECIST 1.1标准评估心肌炎发病前及心肌炎治疗后肿瘤的情况[18]。住院期间死亡原因由患者的主治医师和来自心脏病学及肿瘤学的两位专家共同确定。出院后,患者的生存状态和死亡原因由两名内科医师根据从门诊或电话随访中获得的信息确定。研究方案经过复旦大学附属中山医院伦理委员会批准(批准号:B2021-275R)。本研究按照《赫尔辛基宣言》的伦理指南进行。
1.3 统计学处理
采用Graphpad Prism 9.5(GraphPad Software, San Diego, USA)和R 4.0(R Foundation for Statistical Computing, Vienna, Austria)分析数据;以n(%)表示计数资料,计数资料样本组间比较采用卡方检验;计量资料描述为x±s或中位数(第25,75百分位数:Q1,Q3),采用Shapiro-Wilk检验来确定数据是否正态分布,如数据符合正态分布,则采用独立样本t检验进行两组间比较,若不符合正态分布,则采用Wilcoxon秩和检验进行组间比较。采用Kaplan-Meier方法绘制生存曲线并采用log-rank检验比较两组生存曲线是否具有差异,心肌炎康复时间定义为从心肌炎确诊到心肌炎的康复的时间间隔,心肌炎死亡时间定义为从诊断到因心肌炎死亡的时间间隔。P <0.05为差异有统计学意义。
2 结 果
2.1 入选患者基本情况
本研究最终入选36例srICIAM患者,其中托法替布组共19例患者(53%),对照组共17例患者(47%)(图1)。两组患者在心肌炎发病前的实验室检查结果差异无统计学意义(P >0.05,表1)。
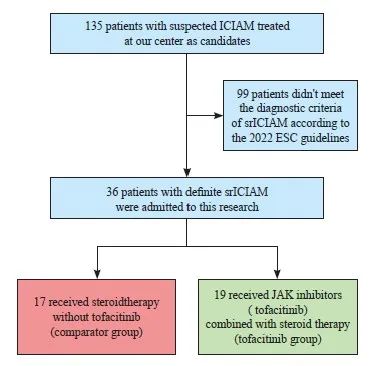
图1 研究流程图
Fig. 1 Study flow diagram
ICIAM: Immune checkpoint inhibitor-associated myocarditis; srICIAM: Steroid-resistant immune checkpoint inhibitor-myocarditis; ESC guidelines: European Society of Cardiology guidelines on cardio-oncology; JAK: Janus kinase.
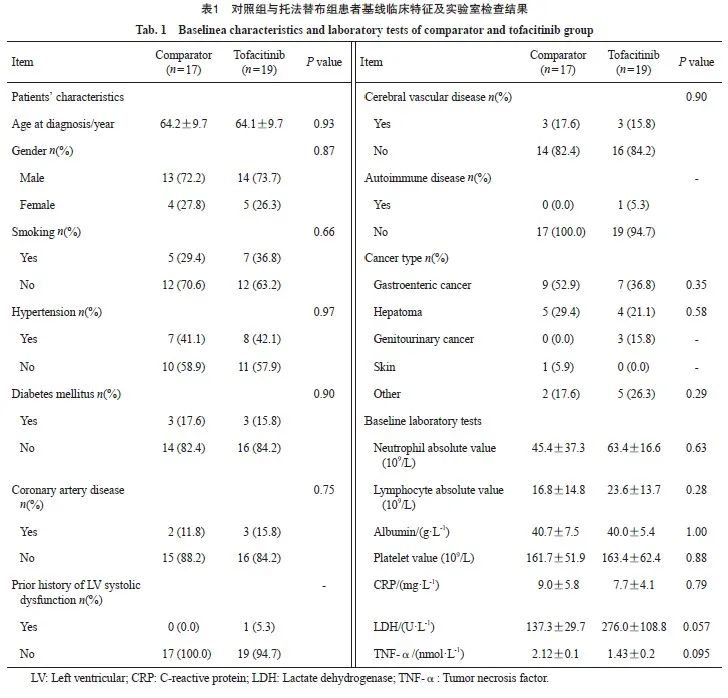
2.2 两组患者的临床表现及治疗结果
两组患者的免疫治疗及心肌炎治疗相关信息见表2。两组患者接受免疫治疗的种类差异无统计学意义(P>0.05)。最常见的心肌炎相关症状是胸闷(两组均为47%)和乏力(两组均为53%)。两组中最常见的伴发irAE是肌炎(对照组35% vs 托法替布组26%,P=0.580)。两组患者中发生G3和G4级心肌炎患者比例差异无统计学意义(P=0.760)。ICIAM病程中最常见的心电图异常是新发的T波或ST段的异常(对照组53% vs 托法替布组37%,P=0.350)。对照组中24%的患者出现显著的LVEF下降,而托法替布组为16%(P=0.580)。两组分别有53%和63%的患者接受了CMR检查。对照组和托法替布组中各有1和2例患者接受了心内膜下心肌活检以明确诊断。托法替布组的患者均接受了托法替布联合糖皮质激素治疗,对照组的患者均接受了糖皮质激素治疗,其中部分患者还接受了丙球蛋白(9/17,53%)、英夫利昔单抗(1/17,6%)及血浆置换(2/17,12%)的治疗。从首次接受ICI治疗到心肌炎确诊的时间在对照组和托法替布组之间差异无统计学意义[29.0 d (Q1,Q3:21.0,48.0 d) vs 35.0 d(Q1,Q3:24.5,67.5 d),P=0.420,图2A]。托法替布组患者从糖皮质激素治疗开始到托法替布治疗的中位时间间隔为10 d(Q1,Q3:8.0,17.5 d;图2B)。托法替布治疗的中位持续时间为68 d (Q1,Q3:41.5,95.4 d;图2C)。两组糖皮质激素治疗的持续时间和累积剂量差异无统计学意义[持续时间:75.0 d(Q1,Q3:46,110.0 d) vs 83.0 d(Q1,Q3:56.0,104.0 d),P=0.820;累积剂量:3 292.0±1 574.4 mg vs 2 824.3± 1 320.8 mg,P=0.340,图2D~E]。接受心肌炎治疗后第14 d时,托法替布组的cTnT水平显著低于对照组(0.16±0.17 ng/mL vs 0.42± 0.36 ng/ mL,P=0.008,表2)。两组患者cTnT水平随时间变化的情况见图2F。与对照组相比,托法替布组的心肌炎恢复时间更短(86.5 d vs 126.5 d,P=0.021,图2G)。Log-rank检验结果显示,托法替布组患者心肌炎的累积康复率高于对照组(95% vs 59%,log-rank P=0.009,图2H)。
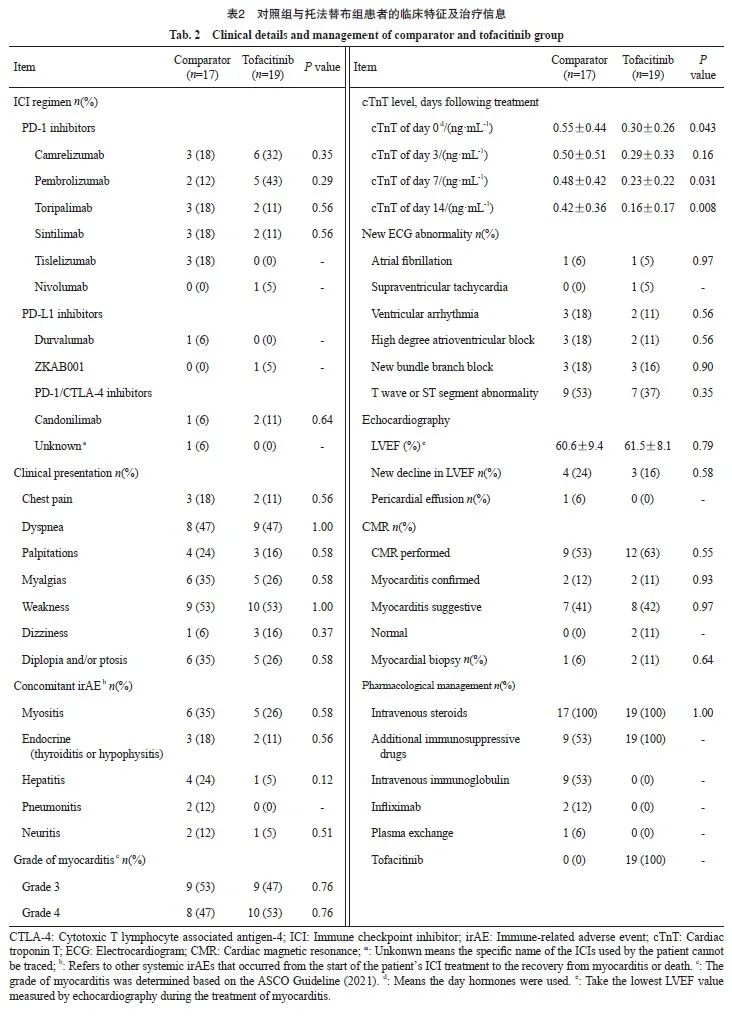
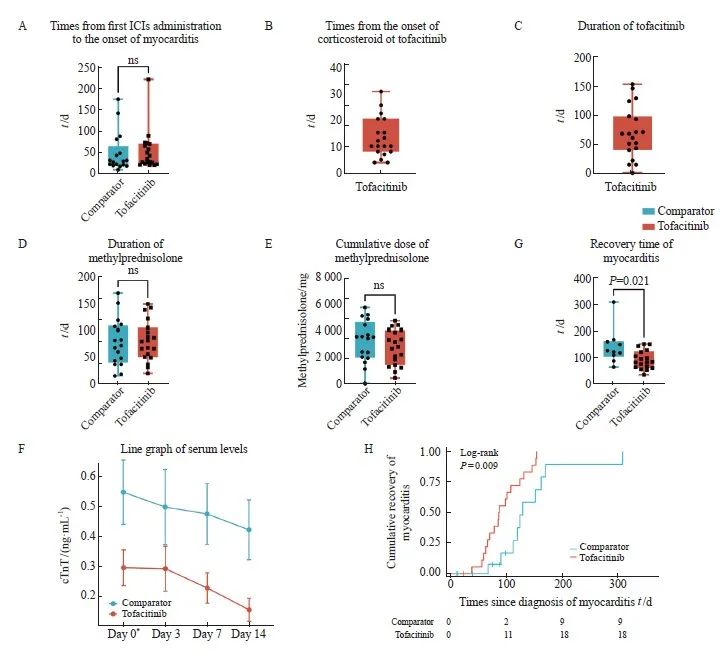
图2 心肌炎治疗情况
Fig. 2 Myocarditis presentation, clinical course and management
A: Times from first ICIs administration to the onset of myocarditis; B: Times from the onset of corticosteroid to intensified immunosuppressive therapies with JAK inhibitors; C: Duration of tofacitinib; D-E: Duration and cumulative dose of methylprednisolone; F: The recovery time of patients in comparator group and tofacitinib group. G: Line graph of serum cTnT levels; H: Over time Kaplan-Meier curves of time to recovery of myocarditis comparator versus tofacitinib group; *: Day 0 means the day hormones are used. cTnT: Cardiac troponin T; ICI: Immune checkpoint inhibitor; ns: No significance.
2.3 随访结果
心肌炎确诊后90 d时,对照组患者心肌炎相关的死亡率为35%(6/17),而托法替布组为5%(1/19)。Kaplan-Meier生存曲线显示,托法替布组患者心肌炎相关死亡率低于对照组患者(P=0.025,图3A)。基于RECIST 1.1标准[18]进行心肌炎发作前及治疗后首次肿瘤病情评估,托法替布组中44%的患者评估结果为疾病稳定(stable disease,SD),而对照组中42%的患者为SD(图3B)。
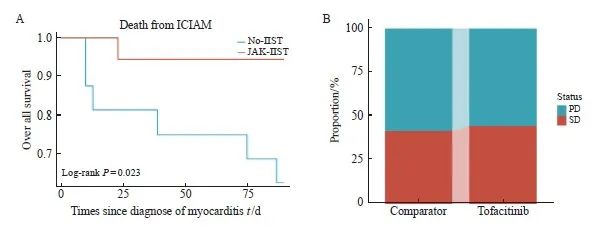
图3 心肌炎相关死亡及心肌炎治疗前后肿瘤评估情况
Fig. 3 Myocarditis-related deaths and tumor assessment before and after myocarditis treatment
A: Mortality since the diagnosis of myocarditis. B: The proportion of PD and SD patients in the two groups after myocarditis recovery. PD: Progressive disease; SD: Stable disease.
3 讨 论
本研究共入组了36例srICIAM的患者。通过收集并分析这部分患者心肌炎治疗期间的临床数据及后续的随访结果来阐述托法替布对srICIAM的治疗效果。结果显示,在足量糖皮质激素治疗的基础上,早期联用托法替布可以降低srICIAM患者的死亡率(从35%降至5%),同时还缩短心肌炎患者的康复时间(P=0.021,图2G)。此外,托法替布组患者在心肌炎治疗前后肿瘤评估为SD的比例稍高于对照组,在一定程度上提示托法替布对于患者的肿瘤病情无明显的负面影 响。
ICIAM是ICI相关心脏不良反应中尤为严重的一种,通常在开始ICI治疗后的两个月内出现。目前,对于ICIAM治疗的一线治疗方式是停用ICI并给予足量的糖皮质激素治疗,然而,仍有部分患者对糖皮质激素治疗的反应不佳[7]。Salem等[23]通过在早期给予大剂量的阿巴西普联合鲁索替尼(一种选择性JAK抑制剂),显著提高了重症ICIAM患者的生存率,将死亡率从60%降至3%(P=0.015)。此外,上述研究还分析了ICIAM模型小鼠的心脏组织以及其他研究中ICIAM患者心肌组织的RNA-seq数据[24],发现Janus激酶-信号转导和转录激活因子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)信号转导通路相关的基因表达显著上调,这为JAK抑制剂治疗ICIAM提供了强有力的理论支持。
JAK抑制剂信号转导通路选择性干扰JAK的腺嘌呤核苷三磷酸的结合位点,阻碍STAT蛋白的磷酸化和核转移,最终抑制下游促炎信号转导通路的激活[25],在各种自身免疫性疾病(包括类风湿性关节炎和溃疡性结肠炎)的治疗中发挥着关键作用[26-27]。尽管ICIAM的发病机制尚未完全清楚,但最新的研究[28]结果显示,特异性识别α-肌球蛋白的T淋巴细胞在ICIAM的发生、发展中起着关键作用。T淋巴细胞激活需要两个信号:首先,抗原呈递细胞识别特定抗原并在细胞表面呈递,被T淋巴细胞受体识别,从而传递抗原特异性识别信号;其次,抗原呈递细胞表面的CD80/86与T淋巴细胞表面的CD28受体相互作用产生第二信号,导致T淋巴细胞的最终被激活[29-30]。JAK抑制剂可以抑制树突状细胞[31],从而减少针对心肌炎细胞的抗原呈递。此外,JAK抑制剂可以通过抑制干扰素的产生及干扰素调节因子的激活,减少CD80/CD86的表达,最终抑制T淋巴细胞的激活和增殖[32],从而在心肌炎中发挥治疗作用。另外,转录组测序结果提示在心肌炎模型中JAK-STAT信号转导通路的过度激活,为JAK抑制剂的治疗效果提供了理论支持[23]。然而,JAK抑制剂治疗ICIAM的分子机制仍需进一步研究。
此外,有研究[33]结果显示,炎症通路的激活及细胞坏死参与了ICIAM进程,其中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的细胞坏死可能发挥重要作用,既往小样本的回顾性研究提示,TNF-α单克隆抗体(英夫利昔单抗)可以降低ICIAM患者的死亡率,提示TNF-α与ICIAM之间的密切联系[10]。本研究结果显示,在基线时,两组患者的TNF-α水平差异无统计学意义(P=0.095)。说明ICIAM相关的TNF-α的升高可能是由ICI所诱导的,而TNF-α与ICIAM之间的关系还有待进一步研究。
在治疗srICIAM时,医师需要着重考虑如何在降低心肌炎相关死亡风险的同时保持抗肿瘤的有益效果。尽管托法替布在自身免疫系统疾病中显示出良好的疗效,但最近一项随机对照临床试验结果显示,与TNF-α抑制剂相比,长期使用托法替布(中位随访时间4年)可增加类风湿关节炎患者的恶性肿瘤发生风险[16]。因此,在两组患者接受心肌炎治疗后,我们分别通过影像学检查基于RECIST 1.1标准对患者的肿瘤大小进行评估,结果发现,托法替布的使用对肿瘤的病情似乎并未产生明显的负面影响。值得注意的是,与需要长期使用托法替布的类风湿关节炎患者不同,我们的队列中,心肌炎患者接受托法替布治疗中位持续时间仅为68 d(图2C),对于免疫系统的抑制仅持续较短的时间,在一定程度上解释了托法替布对于患者的肿瘤病情未产生显著负面影响的原因。
本研究存在以下局限性:包括样本量小、单中心设计以及非随机化。作为一项回顾性研究,容易受到观察偏差的影响,这可能会影响结果的可靠性。同时,两组患者的肿瘤类型并不完全匹配。此外,由于目前长期随访尚未结束,无法通过总生存时间及无进展生存期对托法替布对肿瘤的影响进行全面的评估。下一步,我们将基于长期随访的结果,进一步探索托法替布对于ICIAM患者肿瘤病情的影响。
综上所述,本研究结果显示,托法替布可在一定程度上降低srICIAM患者的死亡率并缩短康复时间,同时对肿瘤预后似乎并未产生负面影响。其可能成为srICIAM的潜在治疗药物之一。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:许宇辰负责数据的收集与分析、论文的撰写;张健负责数据的收集及患者的随访;王妍负责肿瘤患者的病情评估及患者随访;林瑾仪负责患者心脏相关检查及检验结果的判断与患者随访;周宇红负责提供ICIAM患者的临床数据;程蕾蕾及葛均波负责课题的指导、资金的提供以及论文的修改。
[参考文献]
[1] YANG K L, LI J R, ZHAO L, et al. Estimating the number of Chinese cancer patients eligible for and benefit from immune checkpoint inhibitors[J]. Front Med, 2022, 16(5): 773-783.
[2] HASLAM A, PRASAD V. Estimation of the percentage of US patients with cancer who are eligible for and respond to checkpoint inhibitor immunotherapy drugs[J]. JAMA Netw Open, 2019, 2(5): e192535.
[3] CHHABRA N, KENNEDY J. A review of cancer immunotherapy toxicity: immune checkpoint inhibitors[J]. J Med Toxicol, 2021, 17(4): 411-424.
[4] WANG D Y, SALEM J E, COHEN J V, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(12): 1721-1728.
[5] HU J R, FLORIDO R, LIPSON E J, et al. Cardiovascular toxicities associated with immune checkpoint inhibitors[J]. Cardiovasc Res, 2019, 115(5): 854-868.
[6] WANG C, LIN J Y, WANG Y, et al. Case series of steroidresistant immune checkpoint inhibitor associated myocarditis: a comparative analysis of corticosteroid and tofacitinib treatment[J]. Front Pharmacol, 2021, 12: 770631.
[7] LYON A R, LÓPEZ-FERNÁNDEZ T, COUCH L S, et al. 2022
ESC guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS)[J]. Eur Heart J, 2022, 43(41): 4229-4361.
[8]NGUYEN L S, BRETAGNE M, ARRONDEAU J, et al. Reversal of immune-checkpoint inhibitor fulminant myocarditis using personalized-dose-adjusted abatacept and ruxolitinib: proof of concept[J]. J Immunother Cancer, 2022, 10(4): e004699.
[9]KADOKAWA Y, TAKAGI M, YOSHIDA T, et al. Efficacy and safety of Infliximab for steroid-resistant immune-related adverse events: a retrospective study[J]. Mol Clin Oncol, 2021, 14(4): 65.
[10]ZHANG R S, PADEGIMAS A, MURPHY K M, et al. Treatment of corticosteroid refractory immune checkpoint inhibitor myocarditis with Infliximab: a case series[J]. Cardiooncology, 2021, 7(1): 13.
[11]XING Q, ZHANG Z W, ZHU B, et al. Case report: treatment for steroid-refractory immune-related myocarditis with tofacitinib[J]. Front Immunol, 2022, 13: 944013.
[12]YOGASUNDARAM H, ALHUMAID W, CHEN J W, et al. Plasma exchange for immune checkpoint inhibitor-induced myocarditis[J]. CJC Open, 2021, 3(3): 379-382.
[13]IRVING P M, LEUNG Y, DUBINSKY M C. Review article: guide to tofacitinib dosing in patients with ulcerative colitis[J]. Aliment Pharmacol Ther, 2022, 56(7): 1131-1145.
[14]DHILLON S. Tofacitinib: a review in rheumatoid arthritis[J]. Drugs, 2017, 77(18): 1987-2001.
[15]PANÉS J, GISBERT J P. Efficacy of tofacitinib treatment in ulcerative colitis[J]. Gastroenterol Hepatol, 2019, 42(6): 403-412.
[16]OZDEDE A, YAZICI H. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis[J]. N Engl J Med, 2022, 386(18): 1766-1768.
[17]BONACA M P, OLENCHOCK B A, SALEM J E, et al. Myocarditis in the setting of cancer therapeutics: proposed case definitions for emerging clinical syndromes in cardio-oncology[J]. Circulation, 2019, 140(2): 80-91.
[18]EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[19]SCHNEIDER B J, NAIDOO J, SANTOMASSO B D, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO guideline update[J]. J Clin Oncol, 2021, 39(36): 4073-4126.
[20]FRIEDRICH M G, SECHTEM U, SCHULZ-MENGER J, et al. Cardiovascular magnetic resonance in myocarditis: a JACC White Paper[J]. J Am Coll Cardiol, 2009, 53(17): 1475-1487.
[21]ARETZ H T. Myocarditis: the Dallas criteria[J]. Hum Pathol, 1987, 18(6): 619-624.
[22]MCDONAGH T A, METRA M, ADAMO M, et al. 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: developed by the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC[J]. Eur J Heart Fail, 2022, 24(1): 4-131.
[23]SALEM J E, BRETAGNE M, ABBAR B, et al. Abatacept/ruxolitinib and screening for concomitant respiratory muscle failure to mitigate fatality of immune-checkpoint inhibitor myocarditis[J]. Cancer Discov, 2023, 13(5): 1100-1115.
[24]FINKE D, HECKMANN M B, SALATZKI J, et al. Comparative transcriptomics of immune checkpoint inhibitor myocarditis identifies guanylate binding protein 5 and 6 dysregulation[J]. Cancers, 2021, 13(10): 2498.
[25]PHILIPS R L, WANG Y X, CHEON H, et al. The JAK-STAT pathway at 30: much learned, much more to do[J]. Cell, 2022, 185(21): 3857-3876.
[26]TANAKA Y, LUO Y M, O’SHEA J J, et al. Janus kinase-targeting therapies in rheumatology: a mechanisms-based approach[J]. Nat Rev Rheumatol, 2022, 18(3): 133-145.
[27]SANDBORN W J, SU C, SANDS B E, et al. Tofacitinib as induction and maintenance therapy for ulcerative colitis[J]. N Engl J Med, 2017, 376(18): 1723-1736.
[28]AXELROD M L, MEIJERS W C, SCREEVER E M, et al. T cells specific for α-myosin drive immunotherapy-related myocarditis[J]. Nature, 2022, 611(7937): 818-826.
[29]CHAPMAN N M, BOOTHBY M R, CHI H B. Metabolic coordination of T cell quiescence and activation[J]. Nat Rev Immunol, 2020, 20(1): 55-70.
[30]DUSTIN M L. T-cell activation through immunological synapses and kinapses[J]. Immunol Rev, 2008, 221: 77-89.
[31]HEINE A, HELD S A, DAECKE S N, et al. The JAK-inhibitor ruxolitinib impairs dendritic cell function in vitro and in vivo[J]. Blood, 2013, 122(7): 1192-1202.
[32]KUBO S, YAMAOKA K, KONDO M, et al. The JAK inhibitor, tofacitinib, reduces the T cell stimulatory capacity of human monocyte-derived dendritic cells[J]. Ann Rheum Dis, 2014, 73(12): 2192-2198.
[33]ZHANG H, LIN J Y, SHEN Y H, et al. Protective effect of crocin on immune checkpoint inhibitors-related myocarditis through inhibiting NLRP3 mediated pyroptosis in cardiomyocytes via NF-κB pathway[J]. J Inflamm Res, 2022, 15: 1653-1666.


