兰州大学《AHM》:无螯合剂放射性标记水凝胶用于成像引导的近距离放疗
时间:2024-05-24 16:00:25 热度:37.1℃ 作者:网络
放射治疗是利用高能α、β、γ射线和X射线杀伤癌细胞,是临床上治疗癌症的主要手段。近距离放射治疗是一种放射疗法,将放射性核素嵌入小尺寸颗粒中并将其直接放置到肿瘤中,放射性核素被限制在肿瘤内,以最大限度地提高局部肿瘤剂量吸收,并最大限度地减少全身毒副作用,例如125I粒子和90Y微球。然而,近距离放射治疗中涉及的各种放射性核素,如125I、131I、90Y、188Re和225Ac,需要不同的放射性标记方法和载体,增加了临床实践的复杂性。此外,发射短射程射线的放射性核素在植入后难以监测放射性核素的剂量和疗效。肿瘤转移一直是癌症患者死亡的主要原因。临床上将放射治疗结合免疫检查点阻断治疗增强远端效应,不仅在局部发挥抗肿瘤作用,而且通过T细胞介导的免疫反应抑制转移肿瘤。近年来,水凝胶作为一种具有良好生物相容性的多功能药物递送载体在近距离放射治疗中受到了极大的关注。近距离放射治疗水凝胶作为肿瘤局部治疗时,可在肿瘤内均匀分布,持续输送放射能量,实现肿瘤的消除,同时大大减少全身血液循环对正常组织的辐射损伤。
最新研究
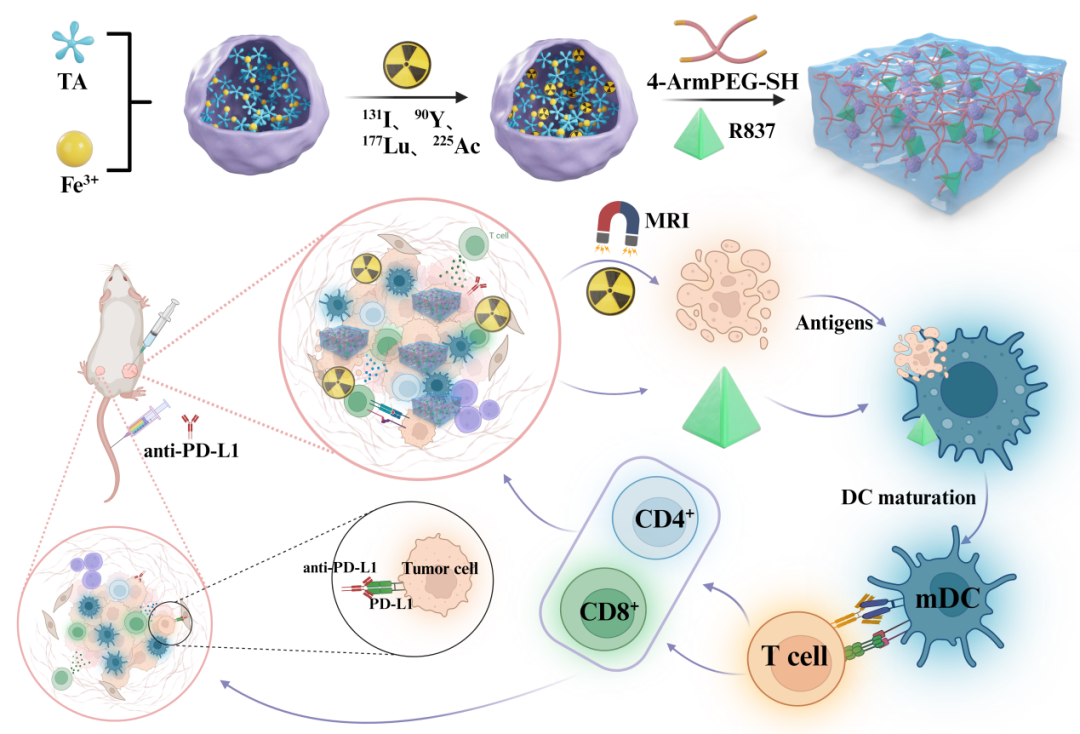
近期,兰州大学田龙龙研究员、刘斌教授和柳江燕教授,开发了一种用于治疗局部和转移性肿瘤的近距离放疗水凝胶。在没有螯合剂的情况下,临床常用的放射性治疗核素(如131I、90Y、177Lu和225Ac)高效稳定地标记铁单宁酸纳米颗粒(FeTA),然后用4-ArmPEG-SH化学交联形成近距离治疗水凝胶。在近距离放疗过程中,水凝胶中的铁离子的磁共振成像(MRI)信号与放射性核素的保留剂量直接相关,不受穿透限制的实时监测在体内发射短射程射线的放射性核素。水凝胶的设计确保了治疗放射性核素在肿瘤内的长期滞留,有效根除局部肿瘤。此外,放射性标记的水凝胶装载免疫佐剂(R837),与免疫检查点阻断疗法协同作用,从而激活有效的抗肿瘤免疫反应并抑制转移性肿瘤生长。相关工作以“Imageable Brachytherapy with Chelator-Free Radiolabeling Hydrogel”为题,发表在Adv. Healthc. Mater.。兰州大学第二医院核医学科崔振存博士和王立琴硕士为共同第一作者。

【文章要点】
本研究分两步合成了 FeTA-PEG水凝胶。首先,通过Fe3+溶液和单宁酸TA溶液的混合搅拌和透析后,成功制备直径为20-40nm的类球形FeTA 纳米颗粒。然后将 FeTA 纳米颗粒与4-Arm-PEG-SH交联,得到具有高度微孔结构的 FeTA-PEG水凝胶。傅里叶变换红外(FTIR)光谱显示,凝胶化后在1200 cm-1处出现新的吸收峰,对应于C-S键的伸缩振动,表明TA和4-ArmPEG-SH之间形成了键。流变学测试显示储能模量(G ')显著大于损耗模量(G”)且频率扫描显示储能模量在整个频率范围内的频率依赖性增加表明确实形成了凝胶(图1)。
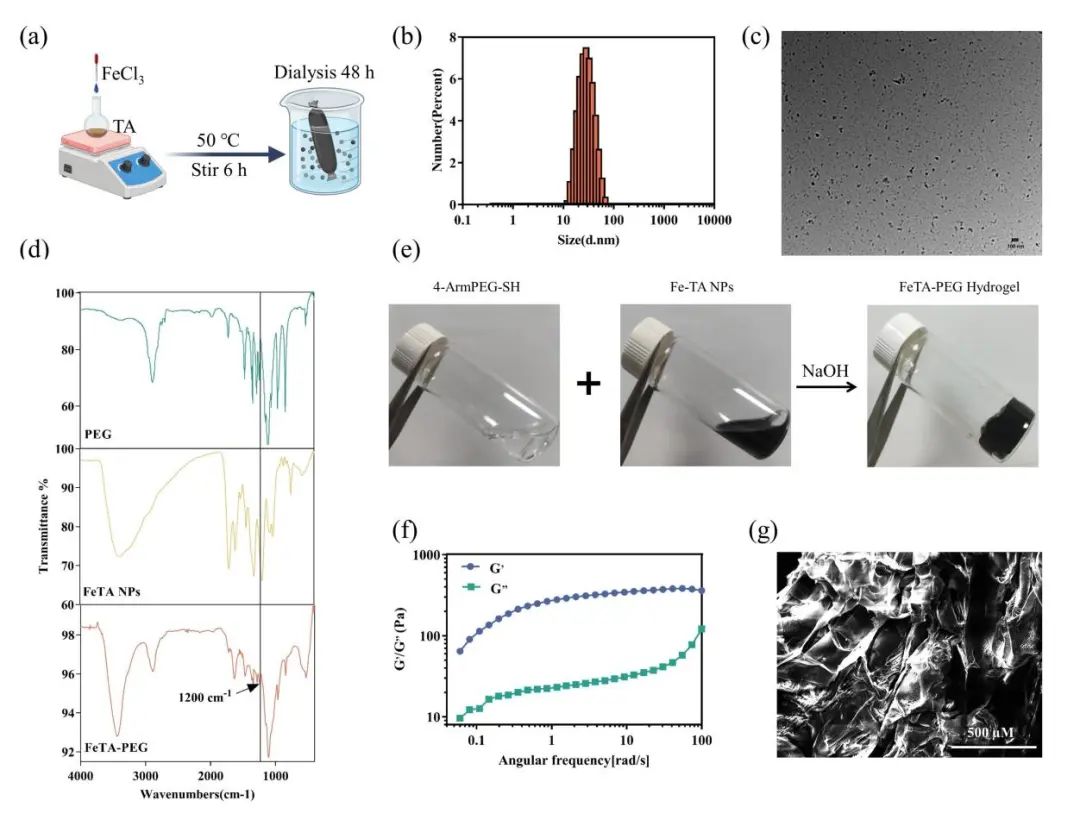
图1 水凝胶的形成及表征
接下来,FeTA纳米颗粒用常规治疗性放射性核素(131I、90Y、177Lu和225Ac)标记,而不使用螯合剂。TA分子的多个连苯三酚基团可以与金属放射性核素配位,酚羟基的邻位也可以通过取代反应用放射性碘标记。各种核素放射性标记产率均高于85%。放射性标记的FeTA在碱性条件下与4-ArmPEG-SH进一步交联以获得放射性标记的水凝胶。通过γ计数器测量FeTA和FeTA-PEG水凝胶的放射性标记稳定性两周,结果显示131I放射性标记稳定性超过90%,而90Y、177Lu和225Ac放射性标记稳定性超过95%。FeTA纳米颗粒中TA分子的酚羟基会被氧化成醌,削弱了酚羟基邻位C-131I键的稳定性。值得注意的是,未检测到225Ac的子体放射性核素从FeTA和FeTA-PEG水凝胶分离,表明FeTA-PEG水凝胶的强配位和高放射性标记稳定性。这使其成为肿瘤中治疗性放射性核素长期保留的有希望的候选物,可以减少对正常组织的损伤(图2)。
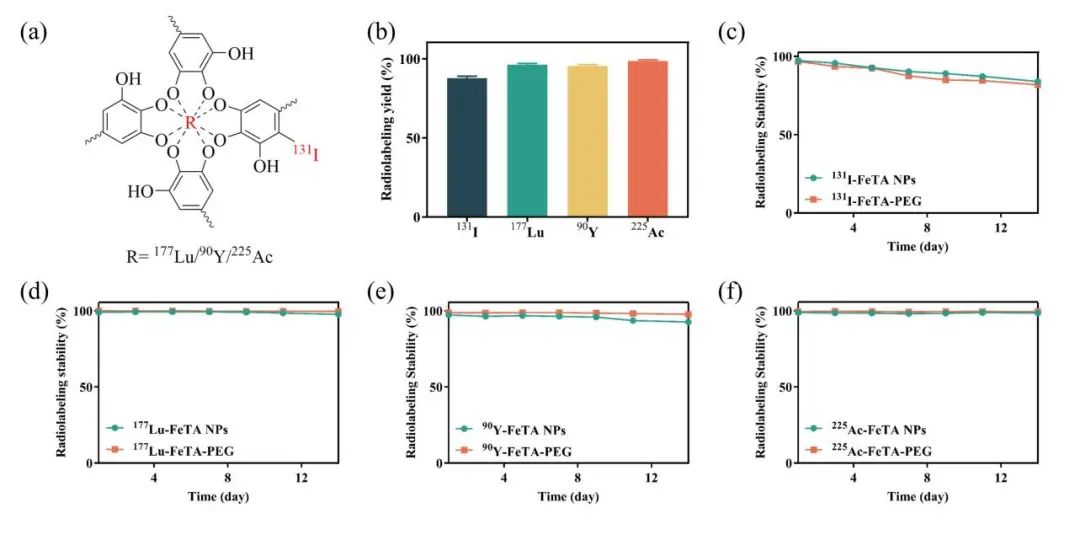
图2 放射性标记
然后,CT26结肠肿瘤小鼠瘤内(i. t.)注射131I、90Y、177Lu或225Ac放射性标记的FeTA-PEG水凝胶,使用小动物活体成像系统和MRI成像监测。发现225Ac-FeTA NP在肿瘤内注射后在肾脏中强烈积累,表明225Ac-FeTA NP由于尺寸小而快速逃离肿瘤并从肾脏清除。肿瘤内注射放射性标记的FeTA-PEG水凝胶后,在肿瘤中观察到放射性同位素信号,在正常器官和组织中未检测到显著信号。衰变校正后,放射性强度曲线显示,即使在7天后,大多数放射性同位素仍保留在肿瘤中,表明水凝胶制剂中的放射性核素保留在肿瘤中,这有利于最大限度地减少近距离放射治疗期间的副作用。由于穿透深度有限,放射性同位素发射的短程α射线在体内无法准确检测。基于水凝胶中的三价铁离子的MRI成像能力,还进行了没有穿透深度限制的MRI成像检测。MRI图像清楚地证明了水凝胶的肿瘤内扩散,这进一步与普鲁士蓝染色一致。此外,计算出肿瘤中标准化MRI信号与放射性同位素信号之间的Pearson相关系数分别为0.776(131I)、0.742(177Lu)、0.717(90Y)和0.885(225Ac),表明MRI信号与放射性同位素信号之间存在强相关性。使用FeTA-PEG水凝胶,MRI成像可用于监测近距离放射治疗期间放射性核素的肿瘤保留剂量(图3)。
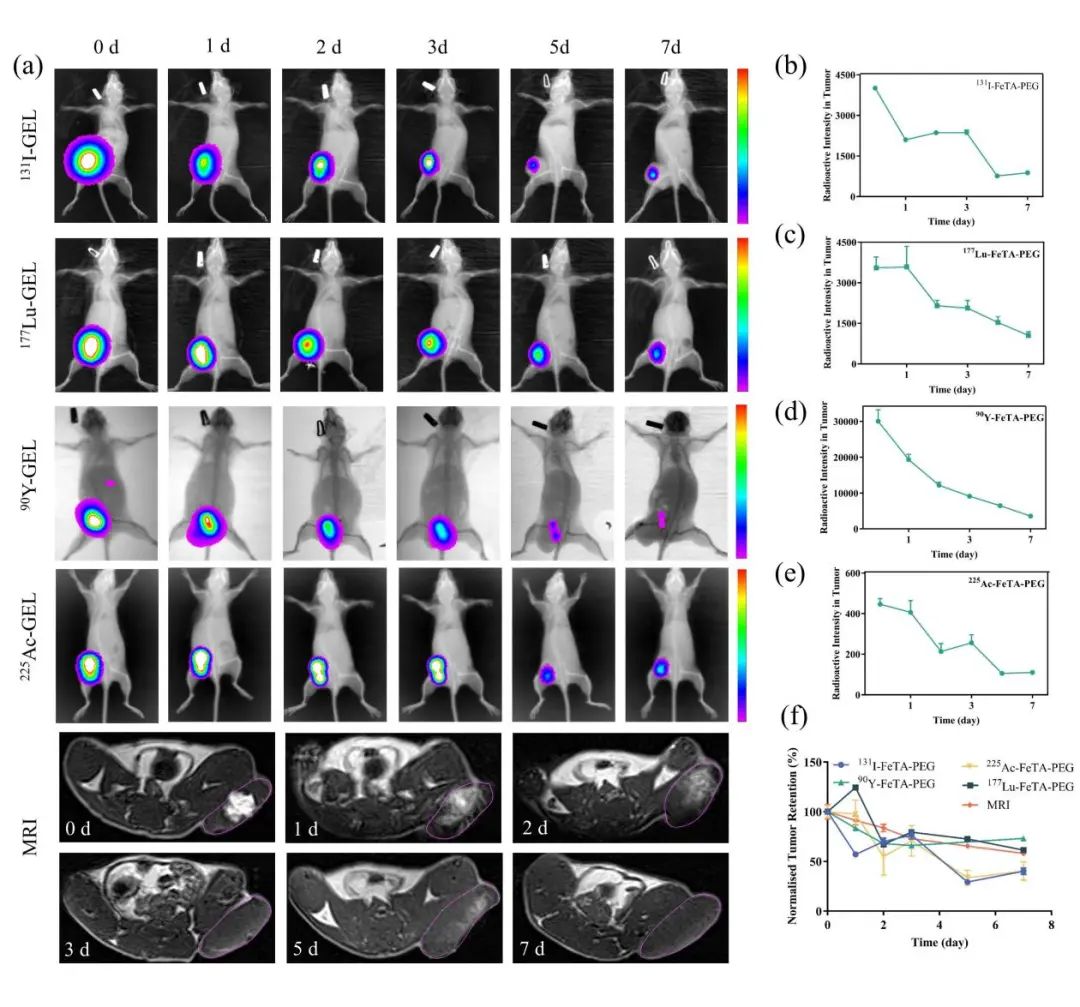
图3 放射性核素标记的小动物活体成像和MRI成像监测
鉴于放射性标记的FeTA-PEG水凝胶的优异稳定性和肿瘤保留,在CT26结肠肿瘤小鼠中评价225Ac-FeTA-PEG水凝胶的近距离放射治疗功效。结果显示PBS和FeTA-PEG水凝胶组中的肿瘤体积随时间迅速增加,而游离225Ac组中的肿瘤生长被部分抑制。值得注意的是,225Ac-FeTA-PEG水凝胶组中的肿瘤生长在给药后得到显著抑制,该组中的所有肿瘤均被完全消除,无明显副作用。存活曲线显示,对照组和FeTA-PEG水凝胶组中的所有小鼠在第20天死亡,游离225Ac组中的所有小鼠在第32天死亡。治疗组中仅一只小鼠在32天后死亡,表明225Ac-FeTA-PEG水凝胶治疗显著改善了肿瘤内注射后的小鼠存活率。肿瘤H&E染色显示,225Ac-FeTA-PEG水凝胶组中的肿瘤细胞被严重破坏,而在其他组中仅观察到部分损伤。TUNEL染色还显示,225Ac-FeTA-PEG水凝胶组中的肿瘤细胞经历严重的细胞凋亡。这些结果表明,使用225Ac-FeTA- PEG水凝胶的近距离放射治疗可以显著抑制肿瘤生长,并提高荷瘤小鼠的存活率(图4)。
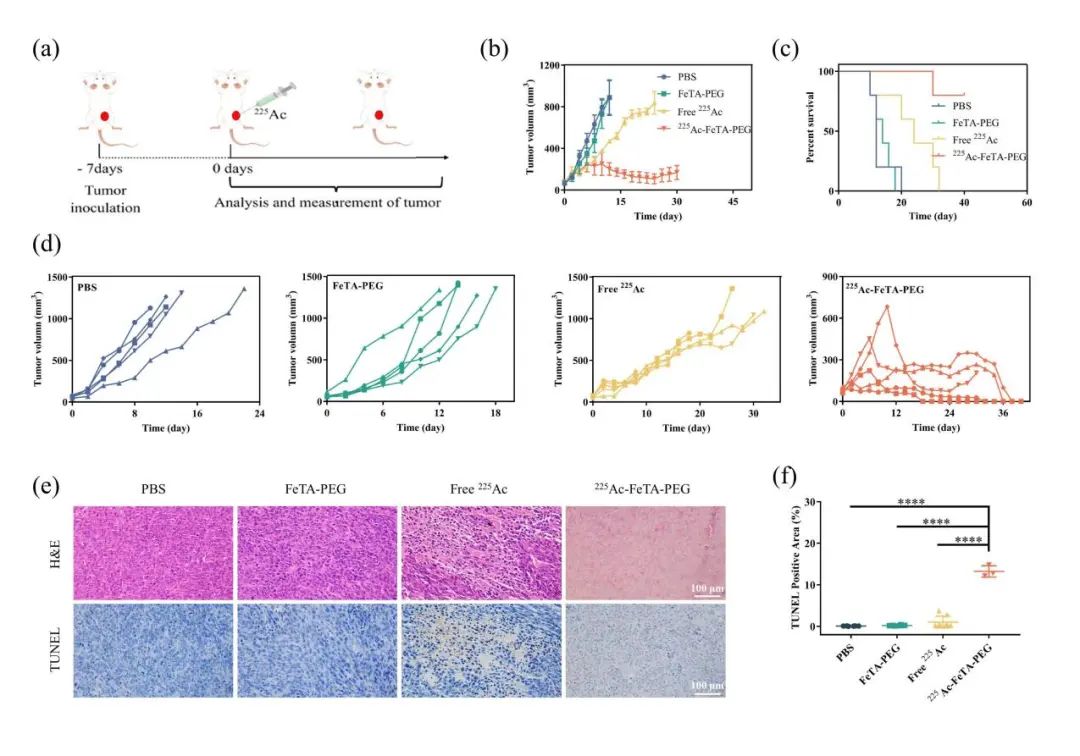
图4 225Ac-GEL抗肿瘤近距离治疗
近距离放射治疗通常用于局部肿瘤而不是转移性肿瘤。然而,在临床实践中,肿瘤转移是患者死亡的主要原因。免疫疗法已被证明可以激活宿主免疫系统以攻击远处转移性肿瘤。近距离放射治疗与免疫治疗相结合是治疗转移性肿瘤的一种有前途的方法。因此,225Ac-FeTA-PEG水凝胶进一步负载佐剂咪喹莫特(R837,TLR7受体的小分子激动剂)并与免疫检查点阻断疗法联用以进行转移肿瘤模型的抗肿瘤疗效评估。结果显示与其他组中的肿瘤快速生长相比,225Ac-FeTA-PEG-R837水凝胶加抗PD-L1组中远处肿瘤的生长被完全抑制,并且该组中的小鼠存活超过70天而没有死亡和复发。远端肿瘤的H&E和TUNEL染色也显示,用225Ac-FeTA-PEG-R837水凝胶加抗PD-L1处理对肿瘤细胞造成最显著的损伤。远端肿瘤的免疫组织化学染色结果发现CD8+细胞毒性T淋巴细胞(CTL)(癌症免疫疗法的关键免疫标志物)的数量在用佐剂R837加抗PD-L1抗体治疗后增加。由活化T细胞分泌的颗粒酶B和细胞因子TNF-α仅在225Ac-FeTA-PEG-R837水凝胶加抗PD-L1处理后显著增加。已知免疫原性,即引发免疫应答的能力,由抗原性和佐剂性决定。用225Ac-FeTA-PEG水凝胶溶瘤可释放肿瘤相关抗原,同时,佐剂R837在酸性肿瘤微环境中从水凝胶中缓慢释放。然后用佐剂R837使抗原提呈细胞摄取肿瘤相关抗原并成熟,以增强肿瘤免疫原性和激活肿瘤特异性T细胞。抗PD-L1抗体可阻断PD-L1/PD-1检查点,从而激活T细胞介导的抗肿瘤免疫。FeTA-PEG-R837水凝胶联合抗PD-L1治疗不能破坏局部肿瘤,缺乏肿瘤相关抗原的释放。因此,仅225Ac-FeTA-PEG-R837水凝胶加抗PD-L1治疗有效抑制远处肿瘤生长并改善小鼠的存活(图5)。
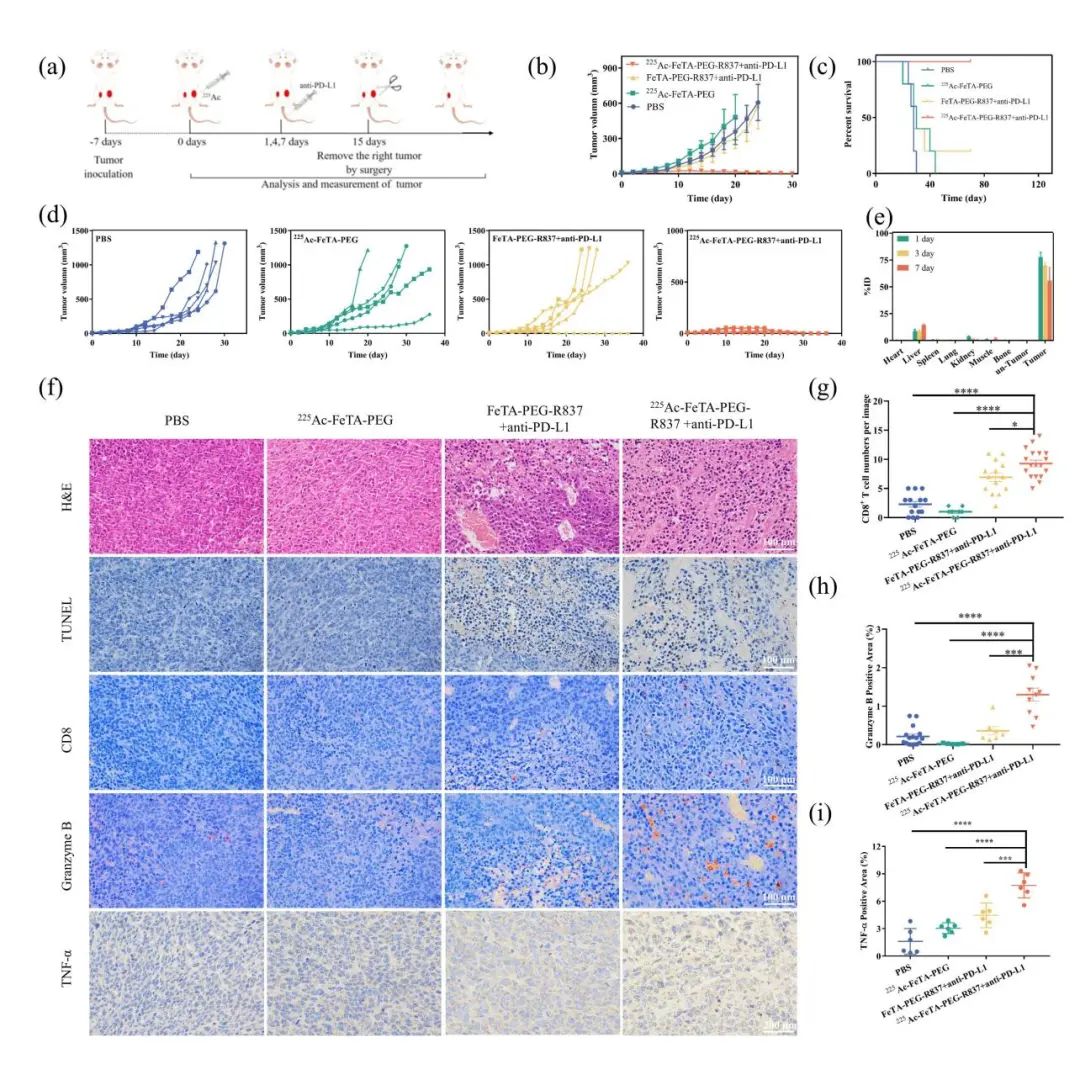
图5 225Ac-GEL近距离放疗联合免疫治疗
【结论与展望】
总之,此项研究中成功合成了基于铁和单宁的FeTA纳米颗粒(NPs),并开发了一种无螯合剂的标记技术快速有效地标记临床广泛使用的性放射性治疗核素,并在碱性条件下利用4-ArmPEG-SH制备出FeTA-PEG水凝胶。基于铁离子的磁共振成像(MRI)和放射性核素成像监测发现放射性标记的FeTA-PEG水凝胶在肿瘤内持久的滞留、低放射性泄漏和有良好的抗肿瘤效果;与免疫佐剂R837和免疫检查点抑制剂抗PD-L1抗体联用后,通过激活抗肿瘤免疫反应有效地抑制转移性肿瘤生长,且对健康组织(包括心脏、肝脏、脾脏、肺和肾脏)没有明显的不良影响。总的来说,这种可成像的近距离放射治疗水凝胶为开发具有潜在临床转化的放射性药物提供了一种新的途径。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202401438


