第四代ALK抑制剂NVL-655获美FDA突破性疗法认定
时间:2024-05-23 06:00:40 热度:37.1℃ 作者:网络
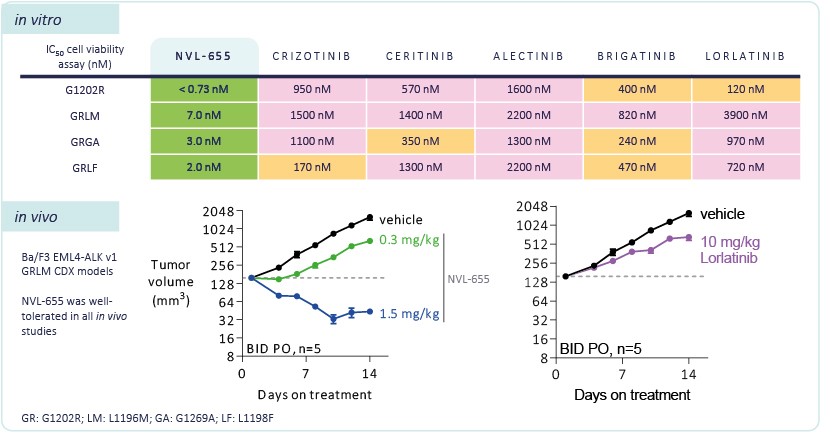
2024年5月17日,Nuvalent公司宣布,其在研脑渗透性ALK抑制剂NVL-655获美国食品药品监督管理局(FDA)授予突破性疗法认定(BTD),用于治疗先前接受过两种或两种以上ALK-TKI治疗的局部晚期或转移性ALK阳性非小细胞肺癌(NSCLC)患者。NVL-655是一种新型脑部渗透性、ALK选择性抑制剂,用于克服现有治疗的某些局限性。 NVL-655化学结构 其设计具有以下特点: ①NVL-655被设计用于对第一代、第二代和第三代ALK抑制剂产生耐药性的肿瘤,包括具有溶剂前沿G1202R突变或G1202R/L1196M(GRLM)、G1202R/G1269A(GRGA)或G1202R/L1198F(GRLF)复合突变的肿瘤。 ②NVL-655针对中枢神经系统(CNS)渗透性进行了优化,以改善CNS转移患者的治疗选择。 ③NVL-655设计突出了ALK选择性,以减少与原肌球蛋白受体激酶(TRK)家族结构相关的靶外抑制导致的CNS不良事件。 此次的突破性疗法认定主要是基于一项I/II期ALKOVE-1试验(NCT05384626)的早期安全性和有效性数据的支持。 ALKOVE-1试验是一项首次人体剂量递增和扩展研究,主要评估了NVL-655治疗晚期ALK阳性实体瘤患者的安全性、耐受性和抗肿瘤活性。 数据截至2023年8月8日,在所有剂量水平的可评估疗效的非小细胞肺癌患者(n=51)中,客观缓解率(ORR)为39%。值得注意的是,所有反应均为部分缓解(PR)。此外,在41例每日50mg或更高剂量治疗的患者中,ORR为44%。37例(67%)反应可评估的患者仍在接受NVL-655治疗。在这些患者中,中位治疗持续时间为3.4个月。所有应答者均继续治疗,无疾病进展。 此外,在具有中枢神经系统(CNS)转移病史患者中,ORR为52%(n=15/28);在常见ALK耐药突变G1202R患者中,ORR为71%(n=12/17)。 在安全性方面,NVL-655的耐受性良好。在所有接受治疗的患者(n=93)中,最常见的任何级别治疗相关不良反应包括:ALT升高、AST升高、恶心、味觉障碍、便秘、疲劳、周围水肿。 前期数据 NVL-655 治疗显示,在 1.5 mg/kg 剂量下,14 天后肿瘤深度缩小,与媒介物相比具有统计学显着性 (p£0.0001)。 Lorlatinib 在 10 mg/kg 测试剂量下适度抑制肿瘤生长,选择该剂量是为了临床前接近人体剂量 100 mg QD 的暴露量。这些发现与在接受劳拉替尼治疗后病情进展的患者中检测到 GRLM 复合突变的临床报告一致。本研究的目的不是为了确定 NVL-655 与 lorlatinib 治疗后肿瘤消退差异的统计显著性。 研究结果显示,在重度预处理的晚期ALK阳性非小细胞肺癌患者中,NVL-655具有良好的耐受性和抗肿瘤活性信号。 参考来源: https://www.onclive.com https://filecache.investorroom.com https://www.prnewswire.com