浙江大学医学院王福俤/闵军霞团队Adv. Sci.:顽固性贫血新疗法
时间:2024-01-26 19:19:36 热度:37.1℃ 作者:网络
近日,浙江大学医学院王福俤/闵军霞教授团队在国际著名学术期刊《Advanced Science》杂志发表题为“Activation of Intestinal HIF2α Ameliorates Iron-Refractory Anemia”的研究论文【1】。

该成果系统阐明了小肠缺氧诱导因子Hif2a-泵铁蛋白Fpn(Hif2a-Fpn轴)受到抑制是难治性缺铁贫血、炎性贫血、癌症贫血和肾性贫血等顽固性贫血的根本原因;首次发现激活Hif2a-Fpn轴通过非铁调素Hepcidin依赖方式显著增加小肠铁吸收和改善顽固性贫血;首次揭示临床药物罗沙司他(Roxadustat,FG-4592)通过激活Hif2a-Fpn轴治疗多种顽固性贫血的良好药效和临床转化潜力。
临床治疗试验期待您的支持
王福俤/闵军霞教授团队正在推进罗沙司他(或达普司他和伐度司他)治疗顽固性贫血的临床治疗干预试验。
期待领域临床专家加盟助力。

图1.论文首页截图
全球约有25%的人患有贫血。在临床上,炎症性贫血和缺铁性贫血非常常见,通常共存于各种慢性病,感染性疾病,自身免疫性疾病和肿瘤等疾病中。通常这些贫血患者体内炎症水平高,炎症通过IL-6/STAT3通路激活肝脏铁调素Hepcidin(由HAMP基因编码)表达,高水平Hepcidin一方面通过抑制肠道上皮细胞基底膜铁外排蛋白(Ferroportin,Fpn)的表达来减少铁吸收,另一方面也通过抑制巨噬细胞Fpn表达来减少铁循环,进而诱发贫血。临床上目前治疗贫血的主要方法为输血,使用红细胞生成刺激剂(erythropoiesis-stimulating agents,ESA)和补铁治疗。传统治疗虽然能改善患者症状,却有以下问题:易引发心脑血管疾患等副作用,对EPO抵抗,或给药途径受限等问题。而这些高Hepcidin型贫血由于小肠Fpn低表达导致口服补铁这一治疗策略失效【2】。因此探寻小分子靶向药物调控Hepcidin表达或通过非Hepcidin依赖途径促进小肠铁吸收是治疗此类贫血的理想方式。
王福俤/闵军霞教授团队多年来致力于从分子生物学和遗传学水平研究铁代谢异常导致贫血的有效靶点和治疗策略。团队在中国居民中开展筛查和深入研究,发现首个缺铁性贫血风险基因TMPRSS6多态性显著性增加贫血风险【3】;筛选并解析了鸡血藤、黑豆皮、天然产物杨梅素等【4-6】能通过抑制Hepcidin改善缺铁性贫血,为困扰全球的贫血提供重要策略。
在Hepcidin的经典调控中,机体处于高铁蓄积或者炎症状态均会上调Hepcidin;而处于贫血或者缺氧时,机体会上调缺氧诱导因子(hypoxia-inducible factor, HIF)的重要靶基因-促红细胞生成素(erythropoietin,EPO)的表达,进而促进骨髓和脾脏造血细胞分泌erythroferrone(ERFE),来抑制肝脏Hepcidin表达,促进铁吸收和贫血的恢复【7】。[FW1] 此外HAMP也被报道受HIF1A的直接调控【8】。因此,在缺氧时,HIF可以通过多个途径直接或间接抑制肝脏HAMP从而调控铁代谢。该研究的科学假说是:靶向缺氧相关通路是否可通过调控Hepcidin进而改善难治性高Hepcidin型贫血。
意外发现缺氧可治疗难治性缺铁贫血
为展开这一研究,博士后余盈盈等引入Tmprss6全身敲除(Tmprss6-/-)小鼠,该小鼠因缺失Tmprss6基因,引起肝脏分泌Hepcidin水平升高和小肠Fpn降低,导致单纯性补铁吸收障碍难以治疗而得名难治性贫血,表现为脱毛和经典的小细胞低色素性贫血,伴随网织红细胞数量升高【9】。(因此将其作为高Hepcidin型贫血的经典模型用来探究缺氧对高Hepcidin型贫血的影响)当对该小鼠进行缺氧处理4周后,研究者发现小鼠毛发生长,红细胞数量、血红蛋白、血细胞比容和红细胞体积均明显改善,并且网织红细胞数量明显减少,提示更多的非成熟红细胞在缺氧后转化为成熟红细胞,促进贫血改善。
进一步,研究人员探索缺氧是否通过经典的Epo-Erfe-Hepcidin通路促进Tmprss6-/-小鼠造血恢复。通过检测发现对照小鼠体内Epo和Erfe在缺氧后显著性升高,进而导致Hepcidin下降;Tmprss6-/-小鼠在缺氧处理后Epo不变,Erfe反而下降,肝脏Hamp表达和血清Hepcidin水平均不发生改变。因此提示缺氧并不通过经典的Epo-Erfe-Hepcidin通路改善Tmprss6-/-小鼠贫血。进一步检测缺氧后Tmprss6-/-小鼠体内铁分布情况发现,该小鼠的脾脏铁水平不变、肝脏铁水平升高、血清铁水平升高伴随小肠铁水平下降。这些结果提示缺氧很可能通过促进Tmprss6-/-小鼠小肠铁的吸收动员进而改善贫血。因此研究人员进一步锁定小肠展开研究。
在缺氧的情况下,小肠的缺氧诱导因子Hif1a和Hif2a均明显升高。小肠NCOA4 (nuclear receptor coactivator 4), DMT1 (divalent meta transporter 1)和FPN均被报道为HIF的重要靶基因【10-12】,参与小肠铁吸收和动员。通过逐个检测排除发现缺氧处理并不通过Ncoa4介导的铁蛋白自噬影响铁动员;也不影响位于顶膜的铁吸收基因Dmt1的表达,但是显著性升高Tmprss6-/-小鼠位于基底膜的Fpn mRNA和蛋白水平表达。而Fpn水平的升高也解释了小肠铁外排增多,血清铁升高和造血改善的一系列现象。因此,这些结果提示缺氧可以改善难治性贫血,但并不通过经典的Epo-Erfe影响Hepcidin-Fpn轴,而是可能通过非Hepcidin依赖的小肠缺氧通路参与Fpn调控机制来改善铁吸收和贫血(图2)。
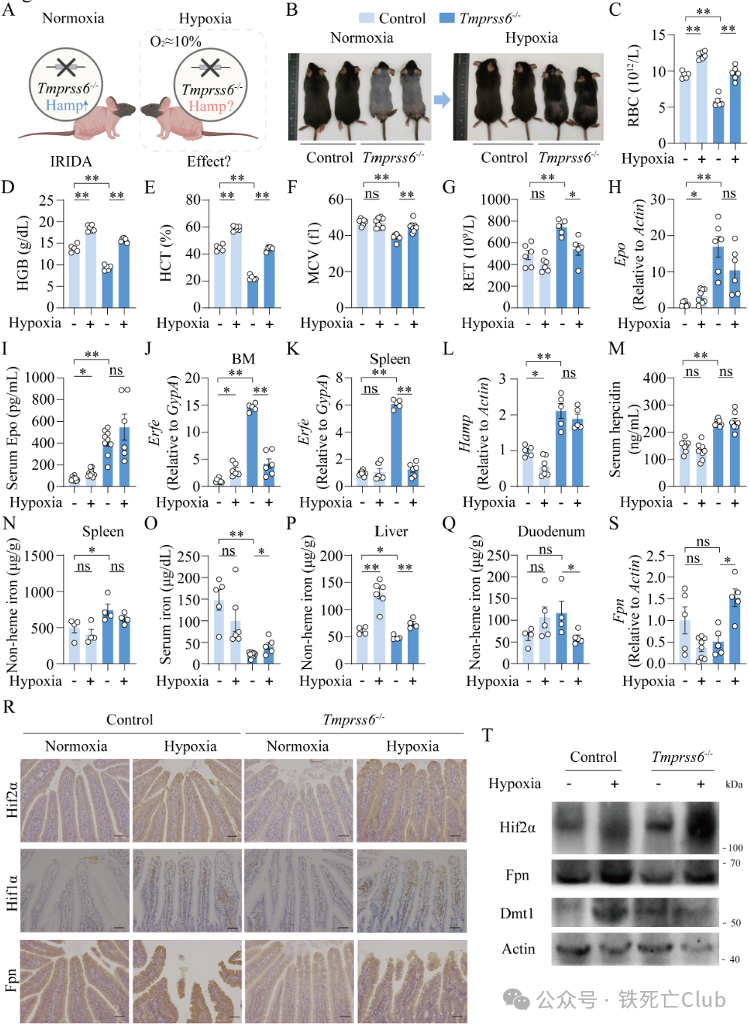
图2 (摘自论文Figure 1) 缺氧改善难治性贫血
发现临床老药可有效治疗难治性缺铁贫血
为了进一步将缺氧治疗难治性贫血这一发现进行临床转化,研究人员寻找能够模拟缺氧效应的药物。HIF在常氧情况下会被降解,主要是因为HIF的氧依赖降解结构域中的脯氨酸残基易被氧和亚铁离子依赖性的脯氨酸羟化酶(Prolyl Hydroxylase Domain, PHD)羟化而驱动HIF进入泛素化降解。因此,PHD是缺氧通路的重要靶点。目前的研究发现,以罗沙司他(Roxadustat,FG4592)为例,其通过模拟PHD的底物之一酮戊二酸来抑制PHD,从而通过减缓HIF降解速率以稳定HIF蛋白水平【13】。鉴于PHD抑制剂促进HIF通路的药理学机制,研究人员提出假设:以罗沙司他为代表的PHD抑制剂可能是难治性贫血和炎症性贫血的潜在治疗药物。
为进一步展开探究,研究人员对Tmprss6-/-小鼠进行4周罗沙司他灌胃,与缺氧处理效应一致的是,Tmprss6-/-小鼠毛发生长,贫血指标恢复,血清铁水平增高,Epo-Erfe-Hamp通路不变,但小肠Hif1a和Hif2a水平升高,小肠Fpn水平显著性升高伴随小肠铁水平下降,提示罗沙司他能够改善难治性贫血,并且通过稳定小肠Hif促进Fpn表达改善铁吸收这一途径(图3)。
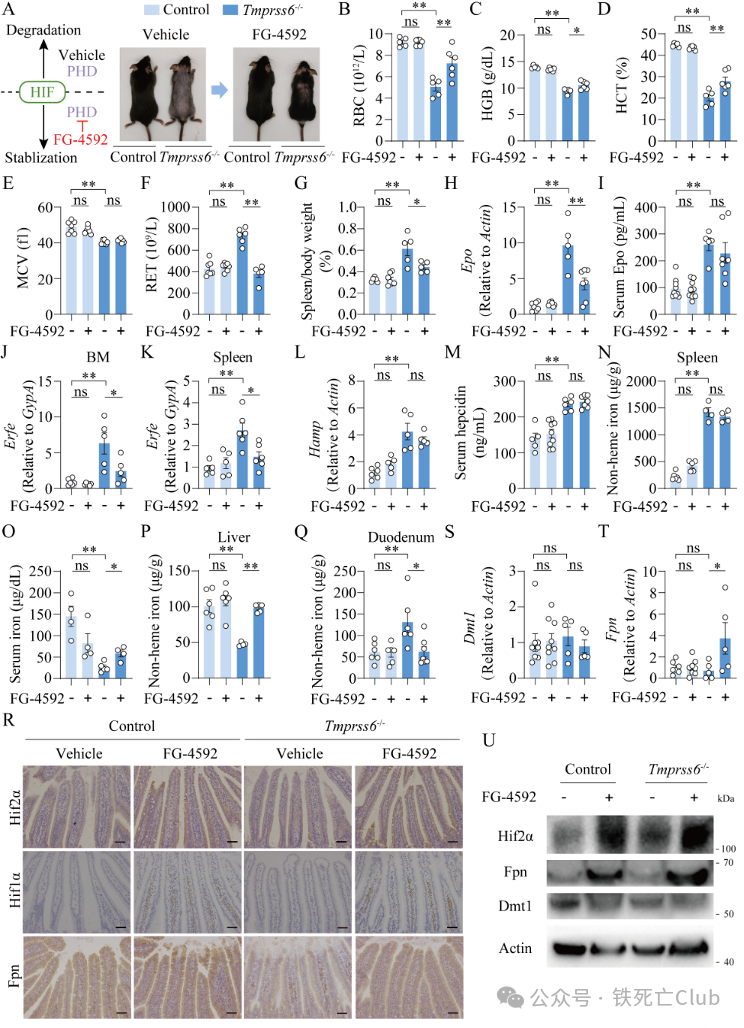
图3 (摘自论文Figure 2) 罗沙司他改善难治性贫血
发现临床老药罗沙司他治疗肾性贫血关键机制——靶向小肠HIF-FPN轴
在临床上,罗沙司他已被国内批准但仅仅局限于慢性肾脏病(Chronic kidney disease,CKD)患者的贫血治疗。主要的大规模的研究支持来自2019年的国内科学家在《新英格兰医学杂志》连续报道了两篇关于罗沙司他治疗肾性贫血(不管患者有无经历长期透析)的临床试验,发现罗沙司他口服药,能够升高患者Epo的浓度,有效降低血清Hepcidin并增加其血清铁水平。
罗沙司他药理机制发表论文观点主要认为罗沙司他可以促进肾脏EPO表达进而降低Hepcidin【14-16】;余盈盈等新成果革命性发现了罗沙司他治疗肾性贫血的新机制,也是根本机制。
因此,研究人员想要进一步探索两个问题:①肾性贫血伴随高Hepcidin情况下,罗沙司他是否同样适用?②肾性贫血的情况下,除了肾脏,小肠是否作为罗沙司他靶向的重要器官通过促进铁吸收改善贫血。
为了深入探究小肠,避开Epo-Erfe-Hepcidin这条途径的影响,研究人员利用对照和Tmprss6敲除小鼠进行5/6肾切手术诱导慢性肾损伤,通过血清肌酐、尿素氮结合肾脏Masson染色和血常规指标确保模型成功的情况下,发现罗沙司他并不改善肾脏损伤,但能够明显改善对照小鼠贫血。有趣的是,罗沙司他能明显改善Tmprss6敲除小鼠贫血,并未改变Hepcidin水平,但能上调小肠Hif1a和Hif2a水平,促进小肠Fpn表达和小肠铁外排。这些结果提示罗沙司他可以通过小肠的HIF-FPN轴治疗Hepcidin水平升高的肾性贫血(图4)。
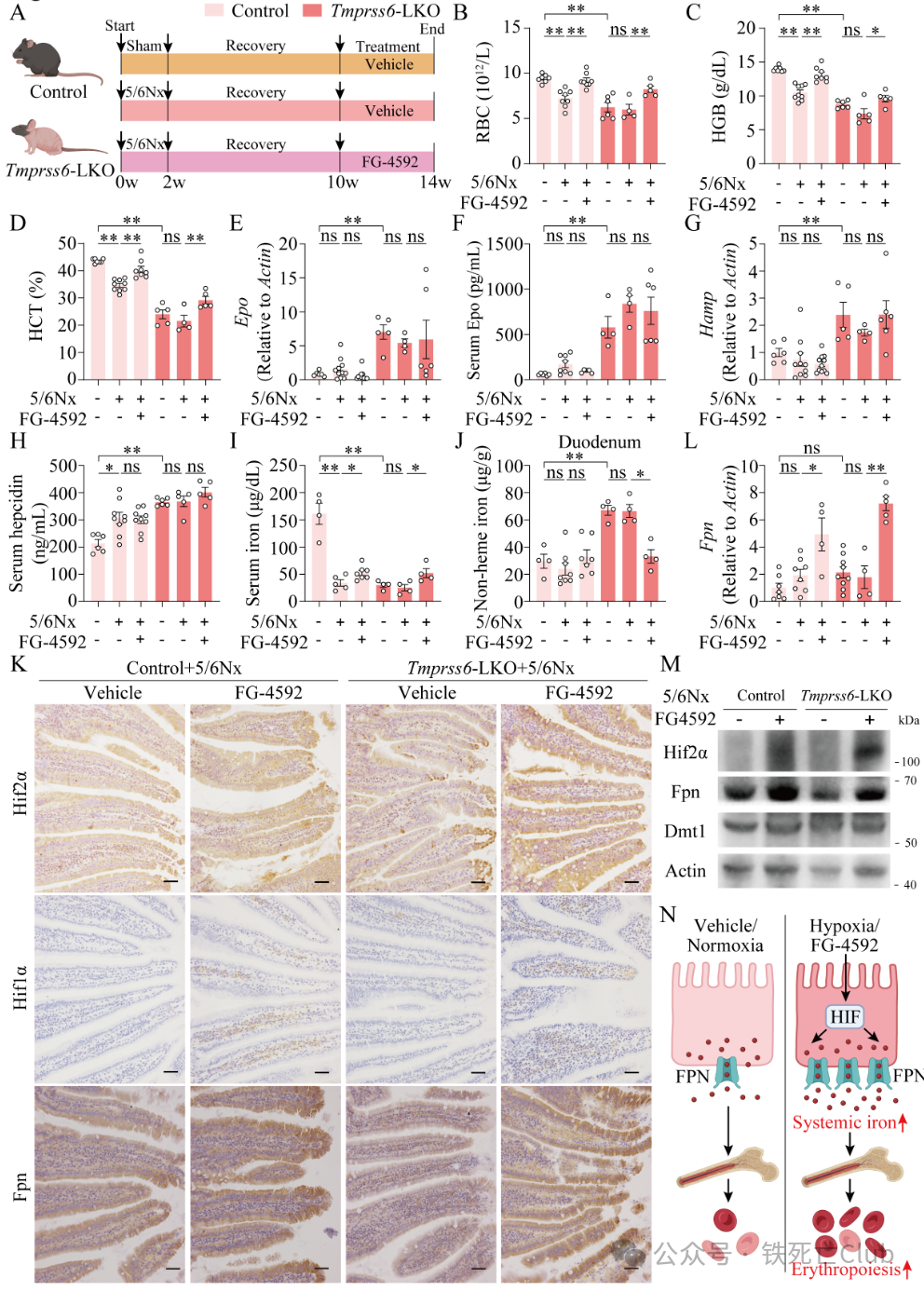
图4 (摘自论文Figure 3) 罗沙司他改善高Hepcidin型肾性贫血
发现罗沙司他可有效治疗炎性贫血
除了难治性贫血,肾性贫血,罗沙司他是否可以治疗其他类型的高Hepcidin型贫血?临床上最常见的贫血是慢性疾病伴行的炎症性贫血。
研究人员引入松节油诱导的经典炎症性贫血模型。同样发现,缺氧和罗沙司他可以明显改善贫血,不通过Epo-Erfe-Hepcidin这条通路,但可以直接促进小肠Fpn的表达(图5)。

图5 (摘自论文Figure 4) 罗沙司他改善炎症性贫血
发现罗沙司他可有效治疗癌症贫血
癌症患者高发贫血;肿瘤化疗引起的贫血在临床上非常常见,贫血严重与化疗的不良预后相关。为了进一步探究罗沙司他是否可以适用于化疗贫血(或简称癌症贫血)。
研究人员引入化疗药物5-氟脲嘧啶(5-Fluorouraci,5-FU)诱导化疗贫血【17】。研究人员发现5-FU诱导后Hepcidin水平存在动态变化(0-7天Hepcidin升高;7-14天Hepcidin下降;14-21天Hepcidin正常化)。另外也发现5-FU诱导的化疗贫血伴随炎症水平升高。有趣的是,不管是7天或者14天的缺氧/罗沙司他干预,均不会改变Hepcidin水平,但均能通过稳定小肠Hif促进Fpn表达改善化疗贫血。因此,无论Hepcidin水平如何改变,罗沙司他均可以通过调控小肠Fpn表达改善贫血,提示罗沙司他或可适用于所有的贫血(图6)。
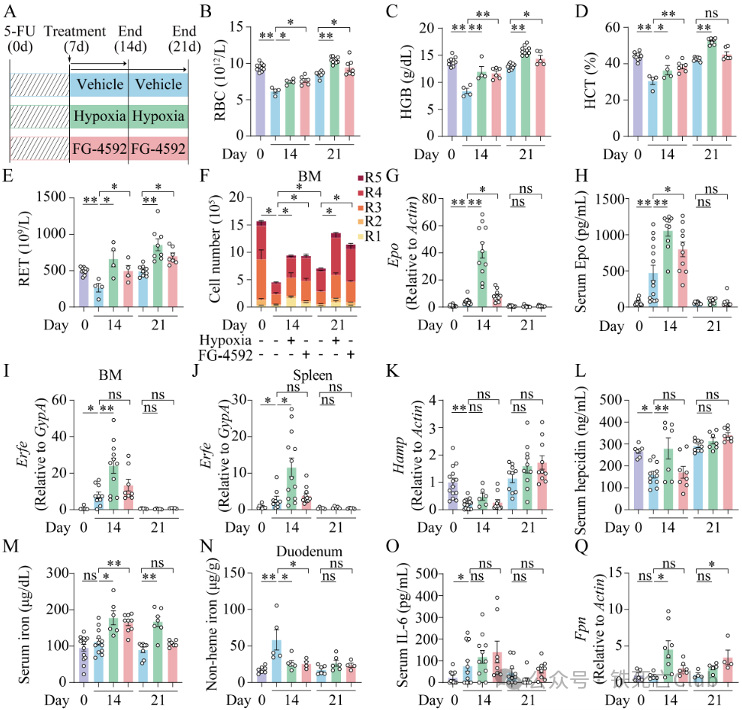
图6 (摘自论文Figure 5) 罗沙司他改善5-FU诱导的化疗贫血
Hif2a受到抑制是顽固性贫血的关键机制
罗沙司他都可以促进小肠Hif1a和Hif2a影响Fpn的表达,为进一步明确罗沙司他是通过Hif1a或Hif2a发挥作用。
研究人员通过Luciferase和ChIP-qpcr实验发现罗沙司他主要通过稳定Hif2a,促进Hif2a与Fpn 缺氧反应元件(Hypoxia response element,HRE)的结合,而不是Hif1a与Fpn的结合,进而促进Fpn转录表达和蛋白水平升高。
为了进一步探究上调小肠Hif2a是否可以通过促进Fpn的表达来改善难治性造血,研究人员在Tmprss6-/-基础上过表达小肠Hif2a,发现过表达Hif2a后明显促进Tmprss6-/-小鼠小肠Fpn表达并且显著性改善贫血。这些结果提示罗沙司他主要通过稳定小肠Hif2a来促进Fpn表达,而过表达小肠Hif2a可以直接促进小肠Fpn表达进而改善难治性高Hepcidin型贫血(图7)。
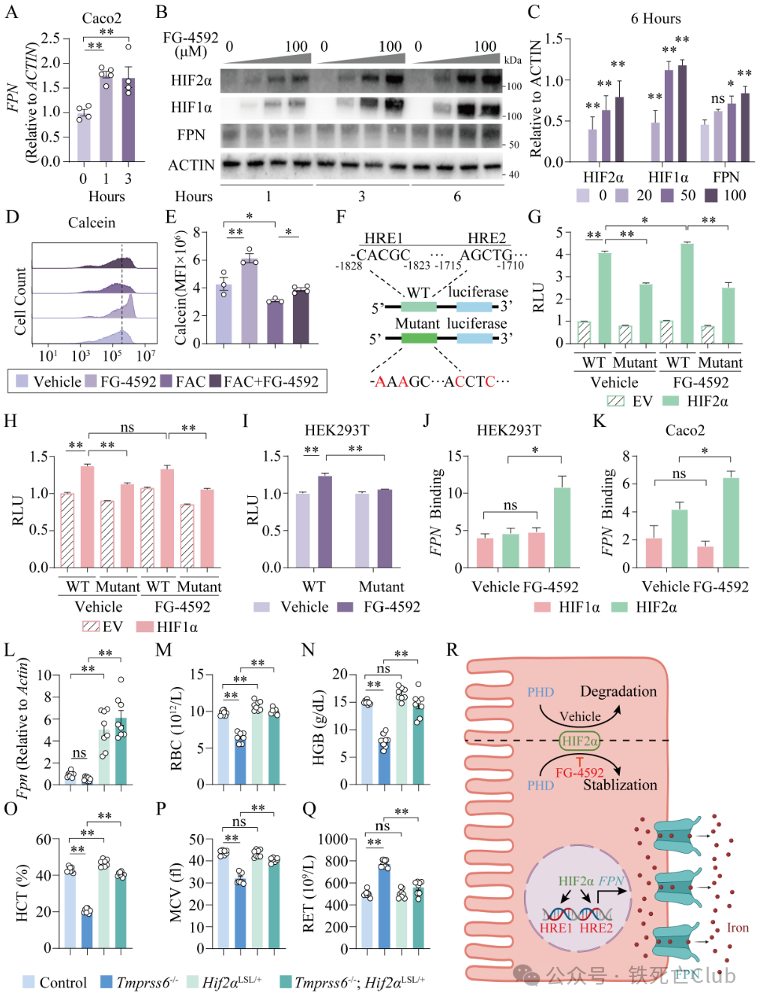
图7 (摘自论文Figure 6) 过表达小肠Hif2a改善高Hepcidin型贫血
明确小肠Hif2a是罗沙司他药效的关键作用靶点
为进一步探究小肠Hif2a是否为罗沙司他的作用靶点,研究人员构建了Hif2a小肠特异性敲除小鼠(Hif2a-IKO),从体内外两方面展开探究。
利用对照小鼠和Hif2a-IKO小鼠类器官发现,罗沙司他促进对照组小肠类器官Fpn mRNA 和蛋白水平表达,但不能在Hif2a-IKO类器官中观察到此现象。并且发现Fpn和Hif2a有非常相似的表达定位,均可以在基底膜融合。研究人员对对照小鼠和Hif2a-IKO小鼠进行5-FU化疗贫血诱导后发现Hif2a-IKO小鼠在21天贫血恢复更慢,而罗沙司他可以促进对照小鼠造血的恢复,但不能改善Hif2a-IKO小鼠贫血的恢复。尤其在小肠缺失Hif2a的情况下,罗沙司他不能进一步上调Hif2a-IKO小鼠小肠Fpn的mRNA和蛋白水平。这些结果明确了小肠Hif2a是罗沙司他的关键作用靶点,罗沙司他通过稳定小肠Hif2a促进Fpn表达在贫血恢复中发挥重要作用(图8)。
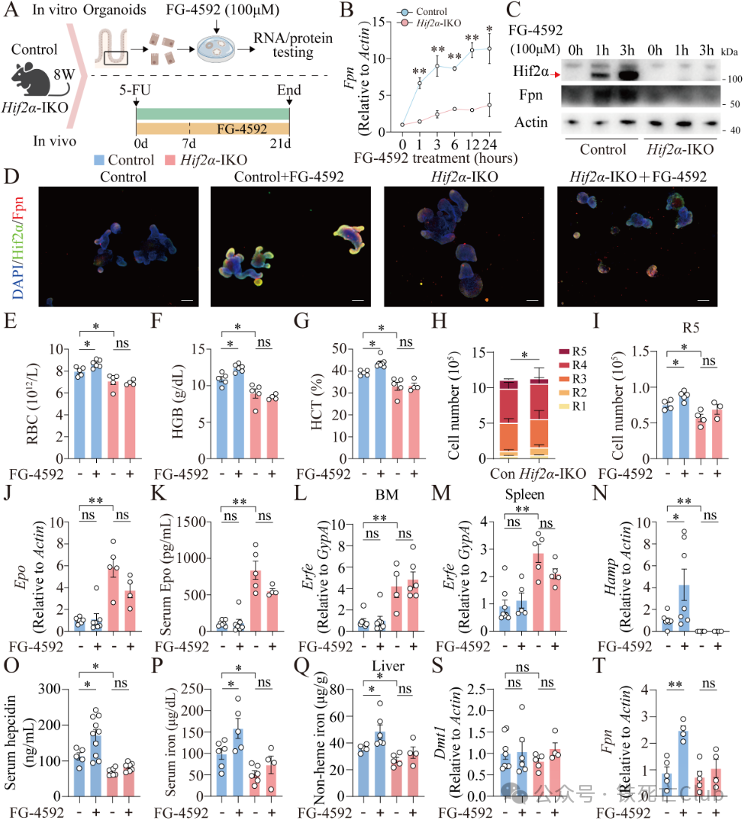
图8 (摘自论文Figure 7) 小肠Hif2a缺失导致贫血恢复受阻
本成果主要突出贡献
(1) 首次发现靶向缺氧通路可治疗难治性贫血、炎症性贫血和化疗相关贫血;
(2) 阐明靶向缺氧通路治疗贫血不依赖于经典Hepcidin-Fpn轴,通过稳定小肠Hif2a直接调控Fpn表达;
(3) 首次报道靶向小肠Hif2a-Fpn轴调控机制在贫血治疗中的转化应用;
(4) 为拓展罗沙司他等PHD抑制剂在临床多种类型贫血(难治性贫血、炎症性贫血和化疗相关贫血等)的治疗应用提供理论基础。值得一提,除Roxadustat罗沙司他,还有Daprodustat达普司他(FDA获批)、Vadaustat 伐度司他等新药(同样分子机制),可能具备相似的贫血治疗效应。
该成果不仅丰富和阐明铁代谢和贫血的分子调控机制;同时为临床贫血治疗提供了新靶点和新策略。罗沙司他(Daprodustat达普司他、Vadaustat 伐度司他等其他PHD抑制剂)老药新用,为贫血患者康复和人类医疗事业带来福音。

图9 论文模式图 (选自论文Online 可视模式图)
浙江大学医学院博士后余盈盈、博士研究生苏韵星和杨思思为论文共同第一作者;王福俤教授、闵军霞教授和美国密西根大学Yatrik M. Shah教授为共同通讯作者。浙江大学公共卫生学院硕士研究生刘雨曈和南华大学衡阳医学院硕士研究生林芝婷参与部分实验。
该项目得到国家自然科学基金以及中国博士后科学基金的资助。感谢浙江大学医学院公共技术平台提供实验支持。
参考文献
【1】Yingying Yu(余盈盈)#, Yunxing Su#, Sisi Yang#, Yutong Liu, Zhiting Lin, Nupur K. Das, Qian Wu, Jiahui Zhou, Shumin Sun, Xiaopeng Li, Wuyang Yue, Yatrik M. Shah*, Junxia Min(闵军霞)*, Fudi Wang(王福俤)*. Activation of Intestinal HIF2α Ameliorates Iron-Refractory Anemia. Adv Sci (Weinh).2024; doi.org/10.1002/advs.202307022
【2】Marques O, Weiss G, Muckenthaler MU. The role of iron in chronic inflammatory diseases - from mechanisms to treatment options in Anemia of Inflammation. Blood. 2022; blood.2021013472.
【3】Peng An, Qian Wu, Hao Wang, Yu Guan, Mingdao Mu, Yijun Liao, Daizhan Zhou, Pengkun Song, Chunrong Wang, Liping Meng, Qingqing Man, Lixiang Li, Jian Zhang, Fudi Wang(王福俤)*. TMPRSS6, but not TF, TFR2 or BMP2 variants are associated with increased risk of iron-deficiency anemia. Human Molecular Genetics. 2012, 21(9): 2124-31.
【4】Yu Guan, Peng An, Zhuzhen Zhang, Fan Zhang, Yu Yu, Qian Wu, Yanbo Shi, Xin Guo, Yunlong Tao, Fudi Wang(王福俤)*. Screening identifies the Chinese medicinal plant Caulis Spatholobi as an effective HAMP expression inhibitor. Journal of Nutrition. 2013, 143(7):1061-6.
【5】Mingdao Mu, Aimin Wu, Peng An, Xiaoli Du, Qian Wu, Xiaoyun Shen, Fudi Wang(王福俤)*. Black soyabean seed coat extract regulates iron metabolism by inhibiting the expression of hepcidin. British Journal of Nutrition. 2014, 111(7):1181-9.
【6】Mingdao Mu, Peng An, Qian Wu, Xiaoyun Shen, Dandan Shao, Hao Wang, Yingqi Zhang, Shenshen Zhang, Hui Yao, Junxia Min, Fudi Wang(王福俤)*. The dietary flavonoid myricetin regulates iron homeostasis by suppressing hepcidin expression. Journal Nutrition Biochemistry. 2016, 30: 53-61.
【7】Pak M, Lopez MA, Gabayan V, Ganz T, Rivera S. Suppression of hepcidin during anemia requires erythropoietic activity. Blood. 2006;108(12):3730–3735.
【8】Peyssonnaux C, Zinkernagel AS, Schuepbach RA, et al. Regulation of iron homeostasis by the hypoxia-inducible transcription factors (HIFs). J Clin Invest. 2007;117(7):1926–1932.
【9】Folgueras AR, de Lara FM, Pendás AM, et al. Membrane-bound serine protease matriptase-2 (Tmprss6) is an essential regulator of iron homeostasis. Blood. 2008;112(6):2539–2545.
【10】Das NK, Jain C, Sankar A, et al. Modulation of the HIF2α-NCOA4 axis in enterocytes attenuates iron loading in a mouse model of hemochromatosis. Blood. 2022;139(16):2547–2552.
【11】Shah YM, Matsubara T, Ito S, Yim S-H, Gonzalez FJ. Intestinal hypoxia-inducible transcription factors are essential for iron absorption following iron deficiency. Cell Metab. 2009;9(2):152–164.
【12】Taylor M, Qu A, Anderson ER, et al. Hypoxia-inducible factor-2α mediates the adaptive increase of intestinal ferroportin during iron deficiency in mice. Gastroenterology. 2011;140(7):2044–2055.
【13】Maxwell PH, Eckardt K-U. HIF prolyl hydroxylase inhibitors for the treatment of renal anaemia and beyond. Nat Rev Nephrol. 2016;12(3):157–168.
【14】Chen N, Hao C, Peng X, et al. Roxadustat for Anemia in Patients with Kidney Disease Not Receiving Dialysis. N Engl J Med. 2019;381(11):1001–1010.
【15】Chen N, Hao C, Liu B-C, et al. Roxadustat Treatment for Anemia in Patients Undergoing Long-Term Dialysis. N Engl J Med. 2019;381(11):1011–1022.
【16】Voit RA, Sankaran VG. Stabilizing HIF to Ameliorate Anemia. Cell. 2020;180(1):6.
【17】Coulon S, Dussiot M, Grapton D, et al. Polymeric IgA1 controls erythroblast proliferation and accelerates erythropoiesis recovery in anemia. Nat Med. 2011;17(11):1456–1465.
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202307022

