【论著】颈动脉支架置入术后闭塞行复合手术再通的疗效及安全性分析
时间:2024-09-14 18:01:37 热度:37.1℃ 作者:网络
摘要:目的探讨颈动脉支架置入术后闭塞行复合手术再通治疗的效果及安全性。方法回顾性连续纳入2016年6月至2023年4月首都医科大学宣武医院神经外科脑血运重建中心17例颈动脉支架置入术后闭塞行复合手术再通治疗患者的病历资料,根据是否再通成功,将其分为再通成功组与再通失败组。血管成功再通定义为术后即刻改良脑梗死溶栓(mTICI)分级≥2b级且残余狭窄率<50%。记录两组患者基线资料(年龄、性别、体质量指数、吸烟史、饮酒史、高血压病史、糖尿病史、高脂血症史、冠心病史)、临床资料[入院时美国国立卫生研究院卒中量表(NIHSS)评分、空腹血糖、低密度脂蛋白、高密度脂蛋白、总胆固醇、三酰甘油、闭塞侧别、病变累及节段、合并对侧颈动脉重度狭窄或闭塞、前交通动脉开放、后交通动脉开放、颈外内动脉代偿、软脑膜动脉代偿、残端形态、影像学诊断闭塞至再通的时间],并进行组间比较。记录闭塞血管再通及围手术期并发症发生情况,并对患者进行术后3、6个月及≥1年的影像学及临床随访。结果17例患者中,再通成功占比为13/17;1例患者术后发生开通血管的再闭塞,经溶栓治疗后再通,但出现颈部血肿伴呼吸困难,经急诊手术处理后恢复;无术后卒中或死亡患者。围手术期并发症发生占比为1/17。与再通成功组患者相比,再通失败组患者高密度脂蛋白和总胆固醇水平较高,组间差异均有统计学意义[高密度脂蛋白:(1.3±0.3)mmol/L比(0.9±0.3)mmol/L, t=-2.139;总胆固醇:(4.2±0.8)mmol/L比(3.1±0.7)mmol/L, t=-2.649;均P< 0.05];其余基线资料和临床资料的差异均无统计学意义(均P>0.05)。13例再通成功组中9例完成了影像学随访,随访时间3.8~36.9个月,中位随访时间为22.8(12.8,34.7)个月,其中1例(1/9)患者于术后33.0个月发生再通血管的再狭窄,再次行支架置入治疗。结论初步分析表明,采用复合手术再通颈动脉支架置入后闭塞有较好的再通成功和较低的围手术期并发症。对于颈动脉支架置入术后慢性闭塞患者,在多模态影像学评估下,可尝试应用复合手术行再通治疗。
颈动脉支架置入术是治疗颈动脉狭窄的主要方式之一,在预防卒中复发方面发挥着重要作用。临床上约有5%的缺血性卒中患者在颈动脉支架置入术后会发生支架内再狭窄或完全闭塞,该术后并发症严重影响了支架置入对卒中复发的预防效果。如果伴有明显的血流动力学障碍,颈动脉闭塞患者2年内再发同侧缺血性卒中的风险可高达22.7%。由于支架内及闭塞远端血栓的存在,单纯血管内介入或颈动脉内膜切除术(carotid endarterectomy, CEA)在处理支架置入术后闭塞方面均有较大的难度和风险。本中心尝试采用复合手术———CEA和血管内介入相结合的方式治疗颈动脉支架置入术后发生闭塞的缺血性卒中患者,现将病历资料进行总结和分析,以期对该类患者的临床诊疗提供参考。
1 对象与方法
1.1 对象
回顾性连续纳入2016年6月至2023年4月于首都医科大学宣武医院神经外科脑血运重建中心因颈动脉支架置入术后发生闭塞行复合手术开通治疗的17例缺血性卒中患者的病历资料。本研究方案获得首都医科大学宣武医院伦理审查委员会批准(伦理审批号:临研审[2013]002号)。患者或其家属签署了诊疗知情同意书。
纳入标准:(1)年龄18~80岁;(2)DSA证实支架置入侧颈动脉完全闭塞;(3)既往6个月内发生过与闭塞血管相关的颅内缺血事件,且最近一次缺血性卒中发生时间>2周;(4)相关灌注检查提示闭塞颈动脉同侧大脑半球存在明确的灌注异常。
排除标准:(1)发病72h内的颈动脉闭塞;(2)同侧大脑半球大面积脑梗死(梗死面积>1/2大脑中动脉供血区);(3)同侧颅内大血管存在重度狭窄(狭窄率>70%)或闭塞;(4)严重神经功能缺损,改良Rankin量表(mRS)评分4~5分;(5)存在严重合并症,如恶性肿瘤、终末期肝病、终末期肺部疾病,预期寿命少于3年。
1.2 研究方法与评价标准
记录患者基线资料及临床资料,基线资料包括年龄、性别、体质量指数、吸烟史、饮酒史、高血压病史、糖尿病史、高脂血症史、冠心病史,临床资料包括入院时美国国立卫生研究院卒中量表(NIHSS)评分、空腹血糖、低密度脂蛋白、高密度脂蛋白、总胆固醇、三酰甘油、闭塞侧别、病变累及节段、合并对侧颈动脉重度狭窄或闭塞、前交通动脉开放、后交通动脉开放、颈外内动脉代偿、软脑膜动脉代偿、残端形态、影像学诊断闭塞至再通的时间。
影像学诊断闭塞时间是指经DSA证实支架置入至同侧颈动脉完全闭塞的时间间隔。将本次入院时发生过卒中且mRS评分≤3分定义为轻中型缺血性卒中。
实验室检测指标:空腹血糖(参考范围3.90~6.10mmol/L)、低密度脂蛋白(参考范围2.08~3.12mmol/L)、高密度脂蛋白(参考范围1.08~1.91mmol/L)、总胆固醇(参考范围3.24~5.70mmol/L)、三酰甘油(参考范围0.45~2.25mmol/L)。
使用改良脑梗死溶栓(modified thrombolysis in cerebral infarction, mTICI)分级评估血管再通状态,将mTICI分级≥2b级且残余狭窄率<50%定义为血管成功再通。
围手术期并发症包括神经损伤、过度灌注综合征、围手术期缺血性卒中、颈部血肿、围手术期心肌梗死、颈动脉血栓形成,其中神经损伤指由于手术操作可能损伤邻近的脑神经和颈部神经根,可能由于手术解剖、牵拉伤害或颈部血肿的压迫导致;过度灌注综合征指解除颈动脉狭窄或阻塞后因脑组织过度灌注引起的头痛、癫痫发作、意识障碍等症状;围手术期缺血性卒中指手术过程中或术后2周发生脑梗死和(或)短暂性脑缺血发作(TIA)的临床症状,并排除出血、高灌注脑病等非缺血因素;颈部血肿指手术后血管损伤或止血不充分导致的血液在组织间隙积聚形成血肿,围手术期心肌梗死指手术期间或术后2周发生的心肌梗死;颈动脉血栓形成指手术后由于血管内膜损伤、血流缓慢或血液成分异常导致颈动脉血栓形成,从而引发脑缺血或脑梗死。
1.3 术前检查
术前完善相关检查,包括颈动脉彩色多普勒、头颈部CT血管成像(CTA)、头部MR平扫、MR高分辨率血管壁成像、脑灌注成像、DSA,参照纳入与排除标准筛选并评估颈动脉病变情况。
1.4 手术方法及治疗
所有患者术前口服阿司匹林100mg/d或氯吡格雷75mg/d,至少服用5d。手术操作均在复合手术室全身麻醉下进行,术中通过经颅多普勒超声持续监测脑血流量的变化。
气管插管全身麻醉后,患者取仰卧位,头部后倾20°,向闭塞颈动脉对侧旋转30°。对于闭塞段位于颈动脉球部及其近端的患者,首先尝试CEA,残余狭窄率>50%时行进一步球囊扩张或支架置入术;对于闭塞累及C1段以远的患者,直接行CEA联合血管内治疗。
所有患者采用Seldinger法穿刺右侧股动脉并置入8F动脉鞘。经胸锁乳突肌前缘切口暴露颈动脉分叉,以动脉瘤夹阻断甲状腺上动脉及颈外动脉,并以阻断钳阻断近端颈总动脉。纵行切开颈总动脉远端及颈内动脉近端血管壁,若颈内动脉远端可见反流血液并未见延续的血栓,则阻断切口远端的颈内动脉,小心剥离并取出闭塞的支架及其周围的粥样硬化斑块或血栓,切除过程中尽可能保留中膜层结构。
对于闭塞段位于颈动脉球部及其近端的患者,依次释放甲状腺上动脉、颈外动脉、颈内动脉后缝合切口。随后,经股动脉鞘置入造影导管,行病变侧颈总动脉造影,对狭窄率>50%的残余狭窄行进一步局部球囊扩张或支架置入术。
对于闭塞累及C1段以远的患者,将微导管与微导丝通过导引导管置入血管内,随后直视下将微导管、导丝一起置入该界面,并向远端推送。预计微导管通过颈动脉外口后行微导管造影,以明确病变情况。证实微导管进入血管真腔后留置微导丝,缝合血管。随后,经微导丝行狭窄部位球囊扩张及支架置入术。支架置入过程中始终阻断来自颈总动脉的前向血流,待确保颈动脉全程通畅后再放开颈总动脉的Rummel止血带,以恢复前向血流。最后复查颈总动脉造影,需明确再通血管血流通畅且残留狭窄率≤50%。
对于血管再通失败的患者,给予药物保守治疗:阿司匹林100mg/d或氯吡格雷75mg/d。
血管成功再通的患者应密切监测生命体征24h,将收缩压降低在基线水平的10%~20%,以预防过度灌注。技术成功定义为达到mTICI分级≥2b级且残余狭窄率<50%。接受支架置入术的患者给予双联抗血小板聚集药物,即阿司匹林100mg/d和氯吡格雷75mg/d,治疗3个月后终生口服单药抗血小板聚集药物(阿司匹林100mg/d或氯吡格雷75mg/d);未行支架置入术的患者终生口服单药抗血小板聚集药物(阿司匹林100mg/d或氯吡格雷75mg/d)。
1.5 术后随访
患者在复合手术治疗前后及出院前均进行神经系统体格检查,并记录相关指标。术后3、6个月及之后每年进行临床和颈动脉彩色多普勒随访。采用电话或门诊随访的方式,评估神经功能恢复情况、mRS评分、术后新发神经系统症状及术后再狭窄情况,其中术后再狭窄定义为再通血管的狭窄率>70%或闭塞,将术后3个月mRS评分≤2分定义为预后良好。
1.6 统计学分析
以复合手术后血管是否再通进行分组,即再通成功组与再通失败组,比较两组患者基线和临床资料的差异。应用SPSS26.0软件对数据进行统计学分析。采用Shapiro-Wilk检验对计量资料进行正态性分析,符合正态分布的计量资料以x-±s表示,组间比较采用t检验;不符合正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,组间比较使用非参数秩和检验;计数资料以例表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基本情况
共纳入17例患者,其中男16例,女1例;年龄44~76岁,平均(63±7)岁;体质量指数20.3~29.1kg/m2,平均(24.6±2.4)kg/ m2;吸烟史13例,饮酒史7例,高血压病11例,糖尿病5例,高脂血症8例,冠心病3例;入院时NIHSS评分0~6.0分,中位数评分0(0,3.5)分;病变累及颈内动脉13例,颈总动脉+颈内动脉1例,颈总动脉3例;合并对侧颈动脉重度狭窄或闭塞7例;前交通动脉开放10例,后交通动脉开放13例,颈外、颈内动脉代偿12例,软脑膜动脉代偿3例;残端形态为锥形4例、钝形9例、无残端4例。
16例患者在支架闭塞后发生过轻中型缺血性卒中,其中10例患者在最后一次缺血事件发生后3个月内接受了血管再通治疗。
2.2 手术疗效及围手术期并发症发生
情况
17例患者采用了CEA结合血管内正向再通的复合手术方式,共有13例患者血管再通成功,血管再通成功占比为13/17。13例再通成功组患者接受了支架置入治疗,置入支架1~6枚/例,中位数为2.00(1.75~3.00)枚/例。4例再通失败组患者在血管内治疗阶段经反复尝试后导丝仍无法通过闭塞段,考虑继续操作可能增加出血的风险而停止了血管内治疗,后续均采取药物保守治疗。13例再通成功组中,仅1例患者在复合手术后出现了并发症(1/17),该例患者成功再通术后第2天复查颈动脉彩色多普勒示颈动脉再闭塞,行溶栓治疗后血管再通,但住院期间患者出现颈部血肿伴呼吸困难,遂急诊行血肿清除术,并转至重症监护病房,最终出院时mRS评分3分。
术后围手术期头部MRI显示,10例(10/17)患者存在新发责任血管区域无症状性高信号,无术后死亡或出血性卒中或缺血性卒中患者。
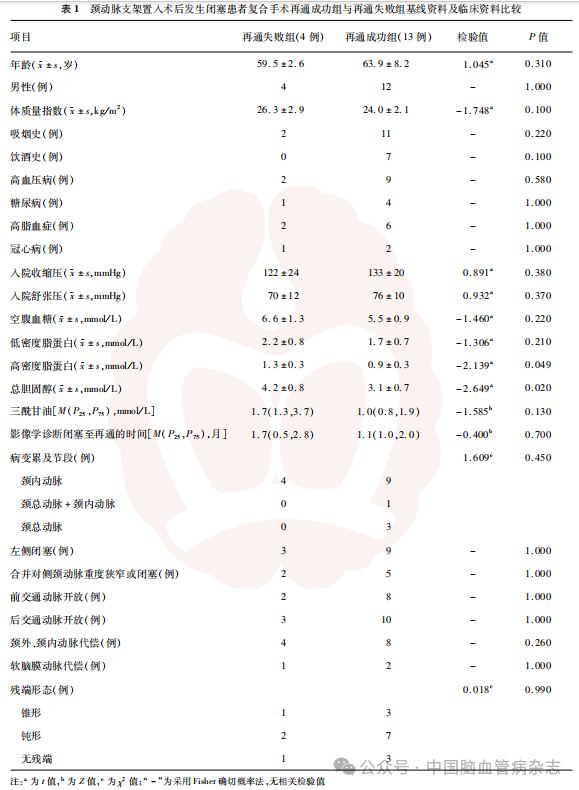
2.3 再通成功组与再通失败组患者基线资料与临床资料比较
与再通成功组患者相比,再通失败组患者高密度脂蛋白、总胆固醇较高,组间差异均有统计学意义(均P<0.05);其余基线资料和临床资料的差异均无统计学意义(均P>0.05)。见表1。
2.4 随访情况
17例患者有10例完成了术后3、6个月和≥1年的临床随访;9例完成了术后3个月影像学随访,7例完成了术后6个月和≥1年的影像学随访。13例再通成功组患者中有9例完成了影像学随访,随访时间3.8~36.9个月,中位随访时间为22.8(12.8,34.7)个月,其中1例(1/9)患者于术后33.0个月发生再通血管的再狭窄,该患者再狭窄发生后反复发作TIA,遂再次于我院行支架置入治疗;未发生再狭窄的8例患者中有1例发生了TIA。术后3个月mRS评分0分者5例,2分者2例,3分者3例。
典型病例
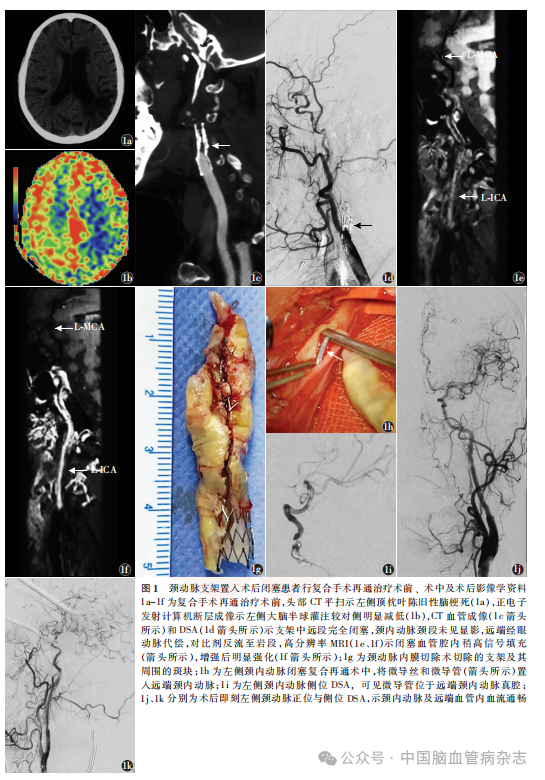
男,70岁。主因“左侧颈内动脉支架置入术后闭塞3年,反复发作右侧肢体无力半年”于2017年10月17日入住首都医科大学宣武医院神经外科。入院前3年,患者因脑梗死行左侧颈内动脉起始段支架置入术,术后服用阿托伐他汀钙片(立普妥)1片/晚,阿司匹林肠溶片1片/d,遗留不全性运动性失语。入院前半年,患者自觉头晕,并反复发作右侧肢体无力,外院头部CT平扫示左侧顶枕叶陈旧性脑梗死(图1a),正电子发射计算机断层成像(positron emission computerized tomography, PECT)示左侧大脑半球灌注较对侧明显减低(图1b),CTA(图1c)及DSA(图1d)示支架中远段完全闭塞,颈内动脉颈段未见显影,远端经眼动脉代偿,对比剂反流至岩段。高分辨率MRI示,闭塞管腔内稍高信号填充(图1e),增强后明显强化(图1f)。诊断为左侧颈内动脉支架置入术后闭塞,拟行复合手术再通治疗。首先采用CEA切除支架及其周围的斑块(图1g),然后经股动脉入路建立血管内治疗通路,直视下将微导丝和微导管置入远端颈内动脉(图1h)。当微导管造影证实位于远端颈内动脉真腔后(图1i),于狭窄段行球囊扩张,并置入2枚APOLLO支架(3.0mm×18.0mm,3.5mm×23.0mm;上海微创医疗器械)。术后即刻造影示颈内动脉及远端血管内血流通畅,mTICI分级≥3级(图1j,1k)。
3 讨论
支架置入术后闭塞是临床上颈动脉狭窄患者介入治疗后少见但严重的并发症,非急性发作的支架置入术后颈动脉闭塞存在较高的缺血性卒中再发风险。研究表明,即使在最佳内科药物治疗下,伴有严重血流动力学障碍的症状性颈动脉闭塞患者同侧卒中的年再发风险仍超过10%。非急性期颈动脉闭塞血运重建的方式包括颅外-颅内旁路移植术和闭塞血管的原位再通术,但多项随机对照研究均未证实血管旁路移植术能为伴血流动力学障碍的颈动脉闭塞患者带来额外的获益。
支架置入术后发生闭塞是一个复杂的过程,除可受糖尿病、吸烟、高血压病、高脂血症以及外周动脉疾病等多种因素的影响外,闭环支架的使用与支架内再狭窄风险增加相关,可能与其在特定解剖结构中的适形性不足有关,而开环支架和症状性颈动脉狭窄则显示出可能降低支架置入术后闭塞的保护作用。
对于复杂的颈动脉闭塞血管,不仅需要明确残端的类型、长度、闭塞段的位置,还需要确定复杂的路线、塌陷的血管壁、扩散的血栓和易损的斑块,而高分辨率MR可以用来确定颈内动脉闭塞的性质,包括血栓、斑块、夹层、病变长度、动脉壁厚度和狭窄程度等。依此指导血管腔内治疗,可减少危险事件的发生,有助于实现安全和成功的血管再通。
闭塞血管的原位再通是近十年来临床上比较常用的治疗方式,再通的血管能恢复远端脑组织的血液供应,降低缺血性卒中复发的风险,其传统的手术方式包括CEA和单纯血管内介入治疗。但对于支架置入后的颈动脉闭塞,CEA和单纯血管内开通均有较高的技术难度和风险。单纯CEA无法处理血栓延伸至岩骨段以上的闭塞,而金属支架的存在阻碍了血管内治疗通路的建立。复合手术因结合了CEA与血管内治疗的优势而在近几年应用越来越多,荟萃分析报道,其治疗非急性期颈动脉闭塞的再通成功率为87.0%,明显高于单纯血管内介入再通的72.6%。有研究表明,32例慢性颈动脉闭塞患者进行单纯血管内治疗的成功率为78.13%,围手术期并发症发生率为18.75%。本研究17例颈动脉支架置入术后闭塞患者行复合手术再通治疗的结果提示,与单纯血管内治疗相比,复合手术可以获得较高的再通成功和较低的围手术期并发症比例。此外,本研究结果显示,与再通成功组患者相比,再通失败组患者高密度脂蛋白、总胆固醇较高,组间差异均有统计学意义(均P<0.05),但高脂血症病史的组间差异无统计学意义(P>0.05)。高脂血症是心脑血管疾病的危险因素,而高胆固醇水平可能引起血管壁的病理损害,由于本研究样本量较少,组间比较的统计效能尚不足以评价血脂水平与复合手术再通成败的关系,有待于未来增加样本量后再行探讨。
与单纯血管内治疗相比,复合手术再通颈动脉支架置入后的闭塞有一定的技术优势。首先,也是最重要的,复合手术采用CEA清除了颈动脉分叉处的支架及其周围的斑块和血栓,解决了单纯血管内治疗过程中导丝导管越过金属支架困难的难题,简化了血管内操作的流程和技术难度,有助于提高血管再通的成功率。其次,CEA去除了颈内动脉起始部的斑块,使微导管和微导丝易于穿过真腔到达远端正常血管,减少了血管内操作时导丝盲探可能导致的夹层、穿孔等严重并发症。最后,闭塞血管内的血栓和碎屑可以从颈动脉切口处清除,降低了围手术期缺血事件发生的风险,而对分叉处斑块的切除并非扩张也有利于减少再闭塞的发生,有利于获得更好的远期预后。
采用复合手术开通颈动脉支架置入术后的闭塞有几点问题需要特别关注。首先,在血管再通治疗前应通过多模态影像学对患者进行评估,以根据闭塞病变的长度和部位制定合适的复合手术开通策略。对于闭塞段局限于支架的患者,可首先尝试单纯CEA再通,若残余狭窄明显再行支架置入术;对于远端颈内动脉存在血栓的患者,则应直接行复合手术再通。其次,应对血管再通成功患者定期行影像学随访,以监测再通血管的状态,降低再狭窄或再闭塞引起缺血事件的风险。本组再通成功13例患者中有1例发生了术后再狭窄,说明颈动脉闭塞再通成功后有一定的再狭窄或再闭塞风险,这与既往研究报道一致。
本研究存在一定的局限性。首先,由于临床上颈动脉支架置入术后闭塞患者较少,本研究仅纳入了17例患者,这限制了结果的稳定性和进一步分析复合手术再通失败的相关因素。其次,纳入患者的中位随访时间仅22.8个月,不足以评估该治疗方式的长期疗效。期望未来更大样本量的研究数据进一步评价复合手术在支架置入术后闭塞再通治疗中的有效性和安全性。
综上所述,本研究初步分析表明,采用复合手术再通治疗颈动脉支架置入术后闭塞有较好的再通成功和较低的围手术期并发症比例。对于颈动脉支架置入术后慢性闭塞患者,在多模态影像学评估下,可尝试应用复合手术再开通治疗。


