Circ Res 中南大学湘雅二医院周胜华教授团队发表高血压靶器管损伤及保护机制的原创性研究成果
时间:2023-12-10 22:36:42 热度:37.1℃ 作者:网络
高血压是全球心血管疾病发病率和死亡率逐年增加的主要原因,也是慢性肾脏疾病、中风、冠心病和心力衰竭的主要风险因素。原发性高血压的确切机制目前仍知之甚少。流行病学长期随访的研究报告发现,即使高血压患者对降压治疗反应良好,血压平稳控制,他们的心血管风险仍显著高于相同水平血压的健康人群,说明现有的降压药物尚不能完全达到即降压又充分有效保护靶器官的作用,提示尽管血压控制良好,但高血压相关靶器官损伤依然继续。寻找阐明高血压相关靶器官损伤的病理生理机制将为高血压靶器官损害的治疗提供实验证据和方向。近年来,T细胞相关免疫和炎症在高血压及其靶器官损伤中作用机制越来越受到重视,成为该领域的前沿热点之一。
2023年12月4日,中南大学湘雅二医院心血管内科周胜华教授团队在国际心血管领域顶级杂志Circulation Research上在线发表了题为“CD4+ T cell Legumain Deficiency Attenuates Hypertensive Damage via Preservation of TRAF6”的原创研究论文,首次揭示了T细胞内源性豆荚蛋白(LGMN)在高血压及其靶器官损伤中的作用、机制和靶点。

为解决高血压带来的靶器官损伤及相应的心血管残余风险增加这一难题,周胜华教授团队首先分离了健康人群及未控制高血压及高血压控制良好患者的外周血CD4+ T细胞,检测发现CD4+ T细胞LGMN在高血压患者显著升高,且其表达量与高血压患者人群的心血管事件残余风险显著相关(图1)。紧接着,团队构建T细胞LGMN特异性敲除小鼠,构建以RAAS系统激活为特征的血管紧张素II诱导的高血压模型及盐敏感特征的DOCA/Salt诱导的高血压模型,发现CD4+ T细胞特异性LGMN敲除可显著降低两种动物模型的小鼠血压及相应血管和肾脏的靶器官损伤。
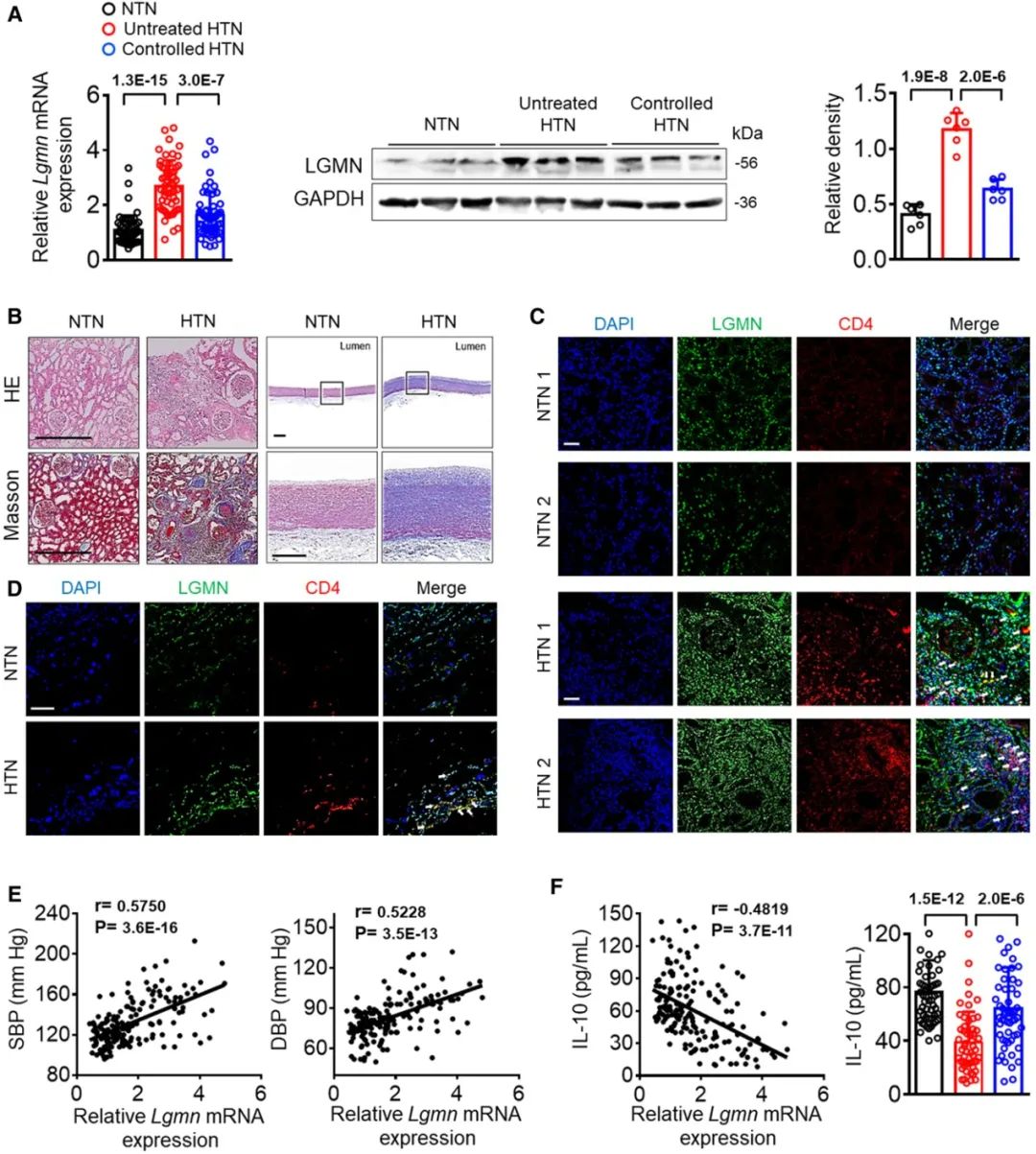
图1. 高血压患者CD4+ T细胞LGMN表达显著增加且与其心血管事件残余风险指标相关
机制上,通过蛋白组学及生物信息学分析,发现LGMN缺失通过阻断分子伴侣介导的TRAF6自噬降解进而促进Treg细胞的分化及免疫调节功能来改善高血压及相应靶器官损伤(图2)。该研究首次发现了TRAF6为分子伴侣介导的自噬底物、LGMN-TRAF6轴在Treg细胞免疫调节功能及高血压靶器官损伤中的作用。重要的是,单独使用经典抗高血压药物氯沙坦仅轻度减轻盐敏感高血压及相应靶器官损伤,而氯沙坦联合LGMN敲除Treg细胞过继转移可显著逆转DOCA/Salt诱导的血压升高及相关靶器官损伤,表明在临床常规药物治疗下,靶向T细胞LGMN可对高血压靶器官损伤带来额外获益。
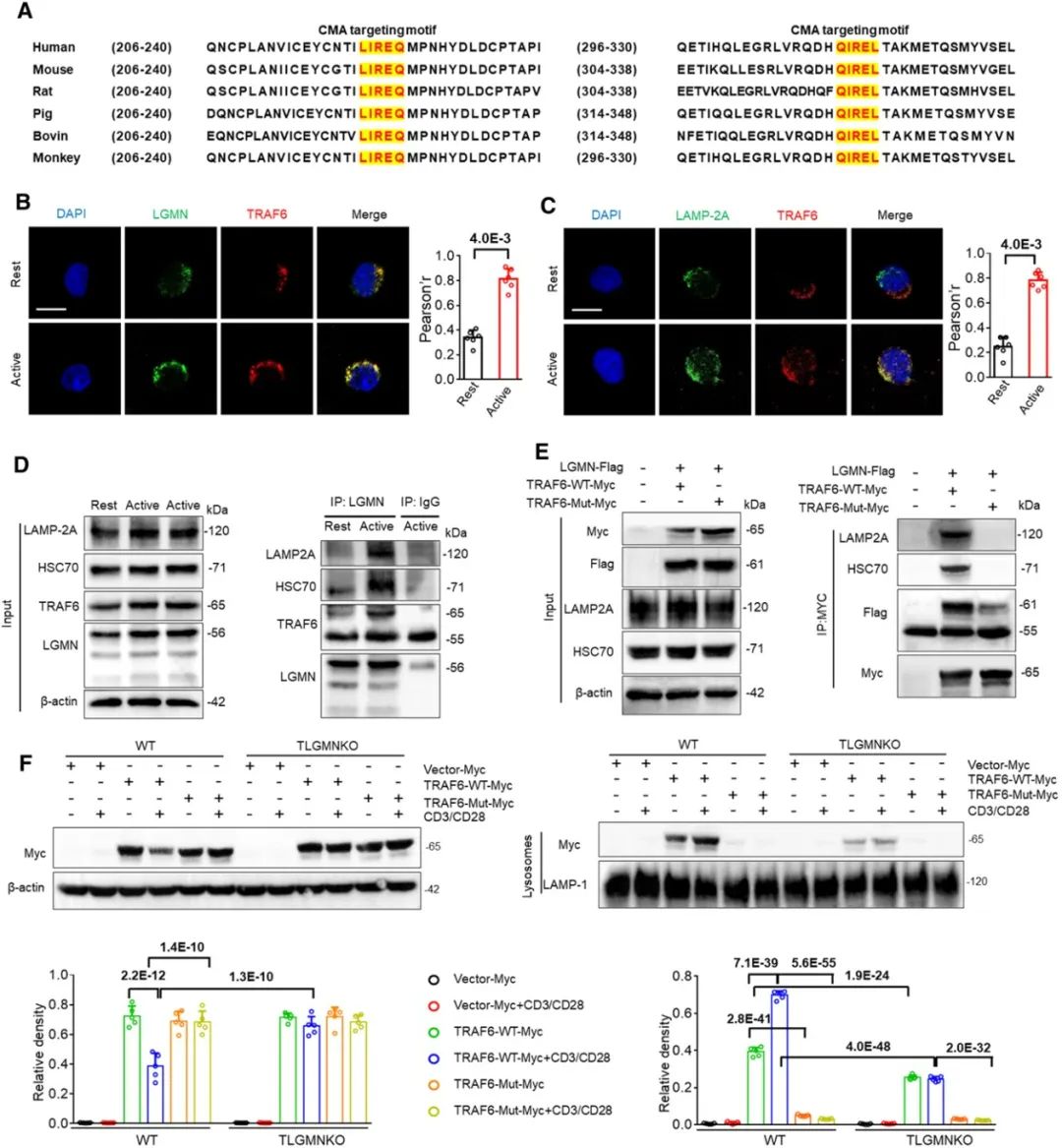
图2. LGMN促进分子伴侣介导的TRAF6自噬降解
综上,本研究从临床问题出发,以临床高血压人群为研究对象,发现高血压患者CD4+ T细胞LGMN高表达与其靶器官损伤及心血管事件残余风险增加具有显著的相关性。在此基础上,通过构建T细胞LGMN特异性敲除小鼠及多种高血压模型,利用多种分子生物学手段详细阐明了高血压靶器官损伤及高血压患者心血管残余风险增加的分子机制及潜在干预靶点(图3),具有重要的临床转化意义和价值,将为未来高血压领域靶向免疫及炎症治疗、减轻高血压靶器官损伤提供了新的视角和思路。
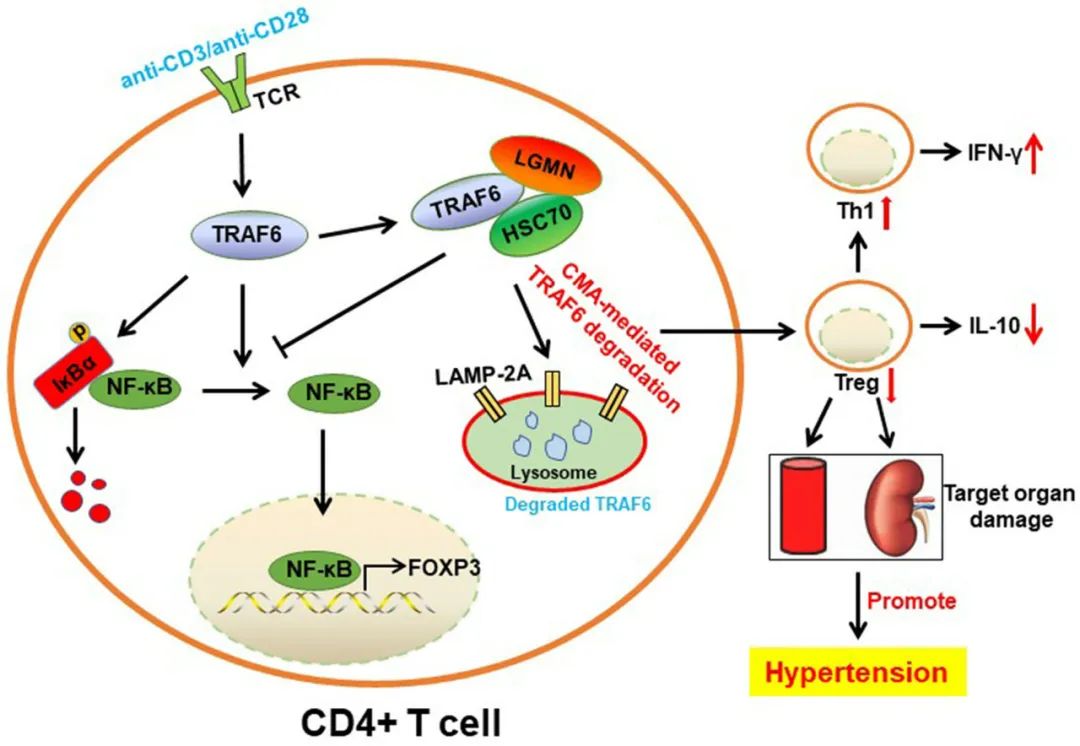
图3. CD4+ T细胞内源性LGMN促进高血压及靶器官损伤的分子机制
中南大学湘雅二医院心血管内科周胜华教授及团队成员何玉虎副研究员为共同通讯作者,何玉虎副研究员和心血管内科2020级博士研究生邹普为并列第一作者。心血管内科刘启明教授、胡信群教授、方臻飞教授、刘玲教授、唐亮教授及肾脏病理科袁曙光教授、病理科卢俊米主管技师为本文共同作者。中南大学湘雅二医院为论文第一及通讯作者单位。该研究得到国家自然基金委员会面上项目(81870258、81800059、82171557)及湖南省自然基金委员会优秀青年基金(2021JJ20085、2020JJ5806)的支持。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.123.322835


