NPJ Precis Oncol案例解析:纵向ctDNA监测在前列腺癌早期检测、个性化治疗及预后监测中的应用
时间:2023-12-06 14:34:15 热度:37.1℃ 作者:网络
循环肿瘤DNA(ctDNA)检测也被称为液体活检,具有实时性、无创性和准确性等优势,可揭示特定治疗路径的驱动突变,能更完整地反应肿瘤基因信息,在评估患者治疗效果和监测病情动态变化等方面具有重要应用前景。“分子生物学缓解”(定义为治疗中肿瘤特异性ctDNA的减少)的概念与传统评估方法相关,但尚未在实体恶性肿瘤中得到完全验证。
目前,随着ctDNA检测在精准肿瘤学中的广泛应用,临床医生或多或少会发现一些意想不到的偶然分子,如来自未知潜能克隆造血(CHIP)或以前未诊断的恶性肿瘤等次要来源的遗传物质,这些遗传物质有望被认识以及适当地用于诊断和监测治疗反应中。
近日,美国加州大学戴维斯分校综合癌症中心的科研人员在npj Precision Oncology上发表了题为“Incidental detection of FGFR3 fusion via liquid biopsy leading to earlier diagnosis of urothelial carcinoma”的文章。研究团队对一位前列腺癌患者进行了连续的纵向ctDNA监测,发现了意外的FGFR3-TACC3基因融合、BRCA1移框突变(frameshift mutation)和其他分子异常,随后进行第二原发癌检查将其诊断为无症状尿路上皮癌(UC)。该研究证明,与计算机断层扫描(CT)等常规筛查方法相比,ctDNA检测可以在临床诊断前至少18个月检测到癌症DNA及基因异常存在,使得疾病监测和耐药性早期检测成为可能,并为针对FGFR和BRCA1的靶向治疗提供机会。

文章发表在npj Precision Oncology
患者的临床病史及ctDNA纵向监测
研究团队对一名73岁西班牙裔男性前列腺癌(PC)患者进行追踪、深度分析(图1)。该患者在9年前被诊断为PC,血清前列腺特异性抗原(PSA)为15.4 ng/mL,其接受了调强放疗治疗(IMRT)和16个月的雄激素剥夺治疗(ADT)治疗,PSA最低为0.08 ng/mL;4年后,患者出现了生化复发(BCR),PSA升高至6.36 ng/mL,重新开始(现在仍然在进行)ADT治疗,从那时起其血清PSA水平稳定在<0.1 ng/mL。
在确诊PC 8年后,研究团队对患者原始PC活检组织进行了NGS检测,并在每次随访时使用Tempus平台进行纵向ctDNA监测,平均间隔为3个月。ctDNA监测一年后,临床报告显示出多个变异等位基因分数(VAF)上升的新分子异常,包括TP53 p.G245D、BRCA1 p.N1521fs、MYC扩增以及FGFR3和TACC3基因之间的融合,这在PC活检NGS分析中未被发现。

图1. 患者的临床时间和分子研究。
其中一些突变(如TP53和BRCA1)是相对组织非特异性的,可能是在PC的克隆进化过程中获得,但FGFR3-TACC3融合在PC中极为罕见,这提示可能存在一种新的UC原发灶,因此研究团队对患者进行了第二原发恶性肿瘤检测。
影像学检查结果显示,该患者存在左侧输尿管肿块、病理性腹主动脉旁淋巴结和肝脏第2段和第6段病变;进一步肝活检证实其患有转移性UC(mUC)。肝活检标本的NGS分析显示出FGFR3ex18-TACC3ex12融合,这种融合在原发性UC活检中并未被检测到。
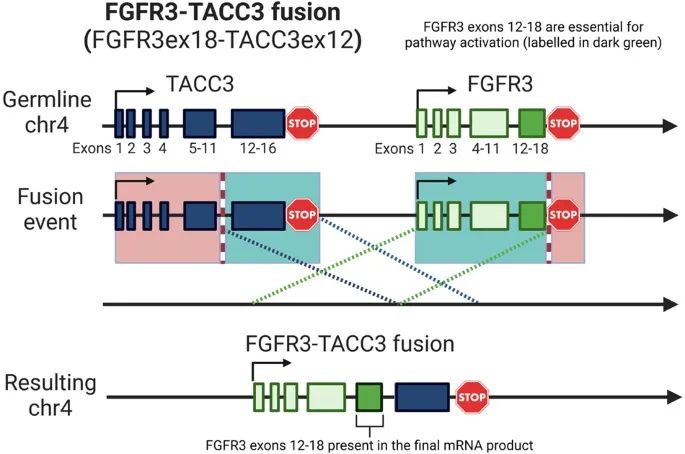
图2. FGFR3ex18-TACC3ex12融合的示意图。
接下来,患者开始使用Cisplatin(顺铂)和Gemcitabine(吉西他滨)进行化疗。化疗一个周期后,液体活检临床报告中的所有分子异常均消失;重复成像显示,所有病变部位均有反应(图2)。
通过利用ctDNA监测来降低化疗是一种新型策略。在新辅助治疗中,ctDNA的清除与病理完全缓解相关。经影像学评估良好以及观察到分子学缓解,研究团队决定将该患者的治疗降级,并转为帕博利珠单抗免疫治疗。在治疗6个月后,ctDNA NGS的临床报告再次显示患者UC出现了先前的分子异常,包括TP53 p.G245D以及BRCA1 p.N1521fs与FGFR3ex18-TACC3ex12融合,但其临床无进展间隔时间超过了mUC维持免疫治疗试验中报道的中位数。
上述结果表明,该患者UC携带的多个分子异常,可以通过ctDNA纵向分析跟踪,并作为常规成像检测的补充。在治疗一段时间后,已知肿瘤相关变异的再次出现(如本例患者),可作为即将到来的临床复发的早期预警信号。此外,治疗期间的纵向ctDNA监测与治疗失败、疾病进展时间密切相关,应及时进行密切的疾病监测。
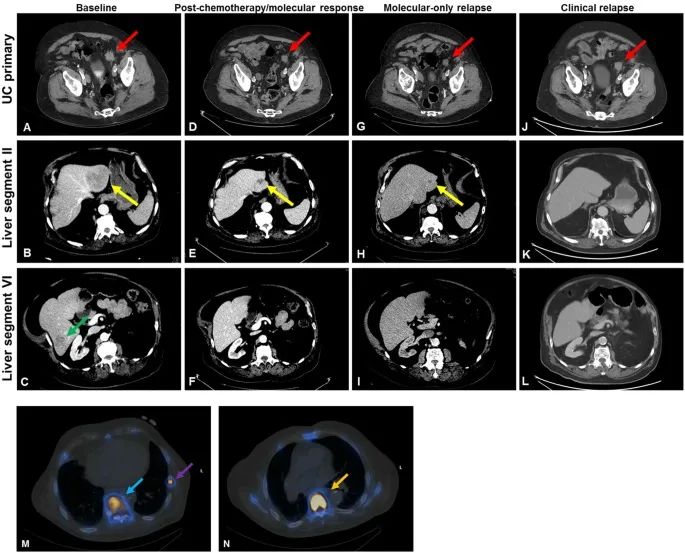
图3. 该患者治疗后mUC的放射学反应。
在UC相关ctDNA异常再次出现大约4个月后,重复成像显示该患者T9椎体内出现可疑的新硬化病变;所有既往发病部位(包括尿路上皮原发部位和肝转移部位)的大小均稳定(图4)。与放射科讨论后,研究团队在1个月后对患者进行了骨扫描,发现其出现新的骨转移病。重复身体成像也显示该患者的UC原发灶有微小扩大,而已知肝转移灶保持稳定。
在此期间,UC相关分子异常的VAF持续上升,并且研究团队首次发现了额外的功能增益(GOF)变异FGFR2 p.F276C和NRAS p.Q61L。同时,患者的PSA保持在<0.1 ng/mL的最低检测水平,ctDNA中未发现PC相关突变。
研究团队对骨病变进行确认性活检,结果显示存在mUC,但该组织不适用于进行NGS检测;对骨病变进行放射治疗,UC相关突变的ctDNA VAF迅速降低。随后,患者开始接受FGFR抑制剂(Erdafitinib)系统治疗。纵向ctDNA监测显示,UC相关突变(P53 p.G245D和BRCA1 p.N1521fs)的ctDNA VAF最初得到改善,但其很快又上升,FGFR3ex18-TACC3ex12和FGFR2 p.F276C的ctDNA含量急剧下降。以上结果表明,FGFR3ex18-TACC3ex12和FGFR2 p.F276C对Erdafitinib敏感,而NRAS p.Q61L可以作为耐药机制。
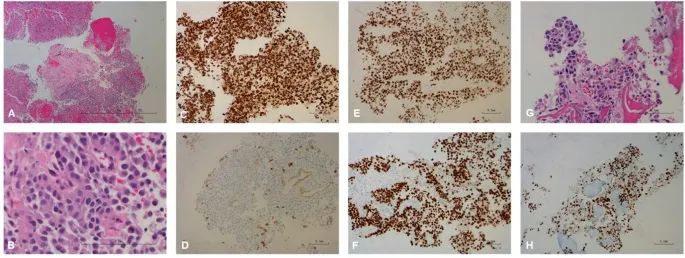
图4. 肝脏II段活检和骨(脊柱)T9转移的病理结果。
ctDNA测序数据的回顾性再分析
在上述治疗过程中,cfDNA检测是以5000 X覆盖率进行NGS,阈值设置错义变异VAF为0.1%,插入/缺失(InDel)VAF为0.5%。研究团队通过重新校准原始ctDNA测序数据回顾性地了解患者的疾病进程,以寻找可能存在的低于检测报告阈值的UC衍生变异。在mUC诊断前的cfDNA样本中,发现TP53 G245D和BRCA1 N1521fs突变分别比其在临床报告中最早出现的时间早12个月(至少)和8个月,VAF分别为0.24%和0.04%;FGFR3ec18-TACC3ex12 没有在新的更早时间点被检测到。
在针对mUC的细胞毒性化疗进行约6个月内,临床NGS报告的UC相关突变ctDNA结果均为阴性。但重新比对分析结果显示,TP53 G245D在整个过程中都可以在ctDNA中检测到。此外,与再次出现在临床报告中的时间相比,研究团队在早2个月的ctDNA样本就检测到BRCA1 N1521fs。
总之,根据肿瘤信息进行的重新比对和分析表明,虽然VAF水平较低,UC相关的体细胞突变可以在临床报告最早出现前至少12个月、临床诊断前至少18个月以及一线治疗后明确放射学进展前至少12个月在cfDNA中检测到。
综上所述,该研究对已知PC患者进行了ctDNA监测,进一步诊断出其患有UC,并将其纳入治疗反应的纵向评估,揭示了ctDNA在早期癌症检测中的潜力,特别是对于没有筛查指南的组织学检测(如UC)。该病例报告强调了纵向ctDNA监测在早期癌症检测、识别个性化治疗靶点、监测治疗反应、预测临床复发/进展和表征耐药机制等多方面的效用,具有改变临床肿瘤学实践的能力。
论文原文:
Huang, Q., Mitsiades, I., Dowst, H. et al. Incidental detection of FGFR3 fusion via liquid biopsy leading to earlier diagnosis of urothelial carcinoma. npj Precis. Onc. 7, 123 (2023). https://doi.org/10.1038/s41698-023-00467-9


