病例分享 | 托法替布治疗难治性系统性红斑狼疮合并肺间质病变一例
时间:2023-12-03 16:34:35 热度:37.1℃ 作者:网络
中年女性,确诊系统性红斑狼疮5年余,期间病情反复,累及呼吸系统、血液系统等多个系统,予多种免疫抑制剂治疗效果不佳,加用生物制剂后,肺间质病变纤维化仍有进展,经综合考虑,予患者制定甲氨蝶呤、艾拉莫德联合托法替布免疫抑制治疗方案控制病情,患者病情得到了明显的改善。
01 病史资料
吴某,中年女性,45岁
主诉:反复发热、皮疹伴关节肿痛5年,咳嗽4年余。
现病史:
患者自2018年起出现多关节肿痛、皮疹、发热,2019-02就诊于外院,实验室检查提示“ 血抗核抗体核型阳性,核颗粒型1:3200,抗SSA(++),抗Sm(++),抗nRNP(+++),抗Ro52(++);补体下降C3 0.386(g/L)↓,C4 0.0367(g/L)↓;炎症指标升高(ESR:83mm/H↑,CRP 37.0mg/L↑)”。诊断“系统性红斑狼疮”。予“泼尼松(5mg bid)+羟氯喹(200mg bid)”调节免疫治疗后症状好转,但病情反复。
2019-03患者再次出现关节肿痛、咳嗽伴高热,至外院就诊,考虑“肺部感染”,抗感染疗效欠佳。转我院住院,结合相关实验室及影像学检查,考虑“系统性红斑狼疮轻度活动合并肺部感染”,予“抗感染,羟氯喹(200mg bid)+醋酸泼尼松(20mg qm)”治疗,症状缓解后出院,但病情仍有反复。
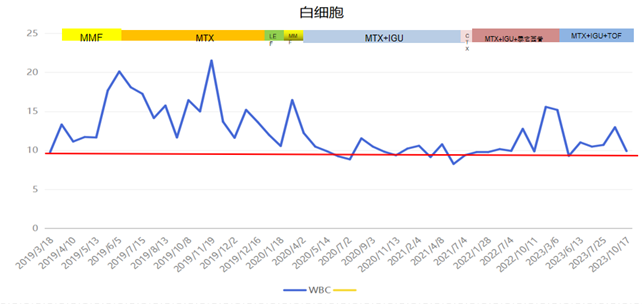
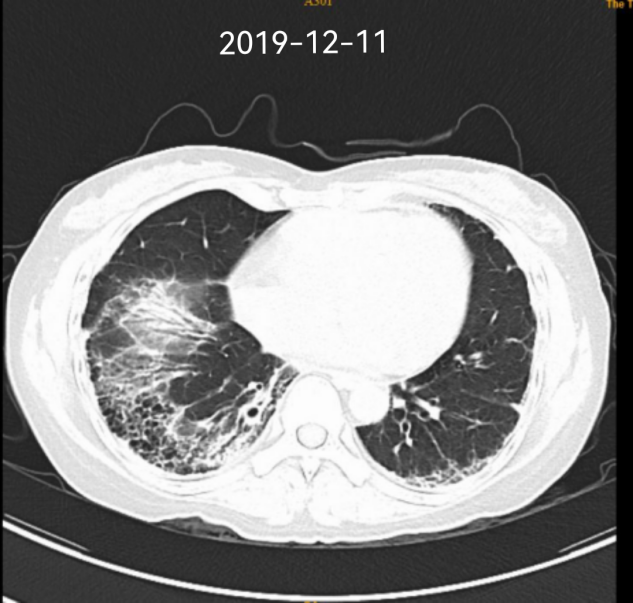
2019-05患者因发热伴咳嗽频率增加,伴白痰,难咳出,予抗感染治疗无缓解,至我院呼吸内科住院,查血常规示:WBC 20.10(109/L)↑,中性粒细胞百分数 93.90(%)↑,ESR:32(mm/H)↑;补体C3 0.60(g/L)↓,补体C4 0.06(g/L)↓;胸部CT示:1.拟双肺间质纤维化改变;2.双下肺感染;3.冠状动脉少许硬化,我科会诊考虑“红斑狼疮,结缔组织病肺间质纤维化合并感染”,予“抗感染,羟氯喹(200mg bid)+泼尼松(15mg qm)联合环磷酰胺”控制病情,患者症状好转出院。
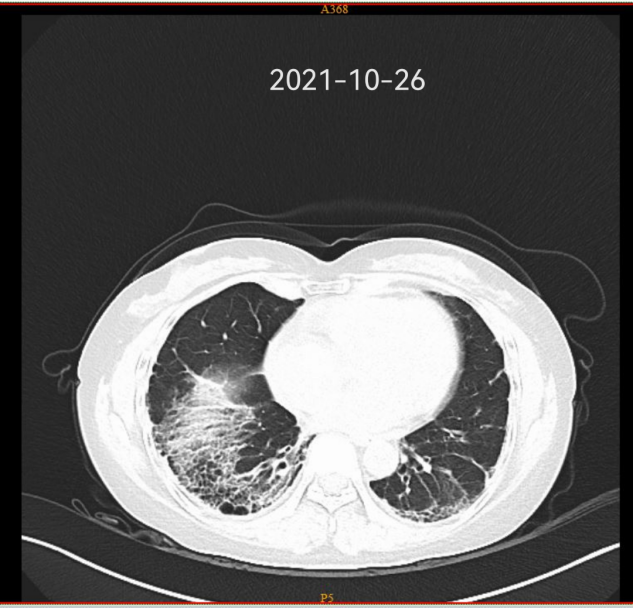
此后患者多次因关节肿痛、咳嗽伴发热就诊及住院,考虑环磷酰胺无效,后尝试更换多种免疫抑制剂如吗替麦考酚酯、来氟米特、艾拉莫德等多种药物治疗,患者关节肿痛症状好转,但咳嗽逐渐加重,皮疹迁延不愈,并反复发热,肺纤维化病变进展。
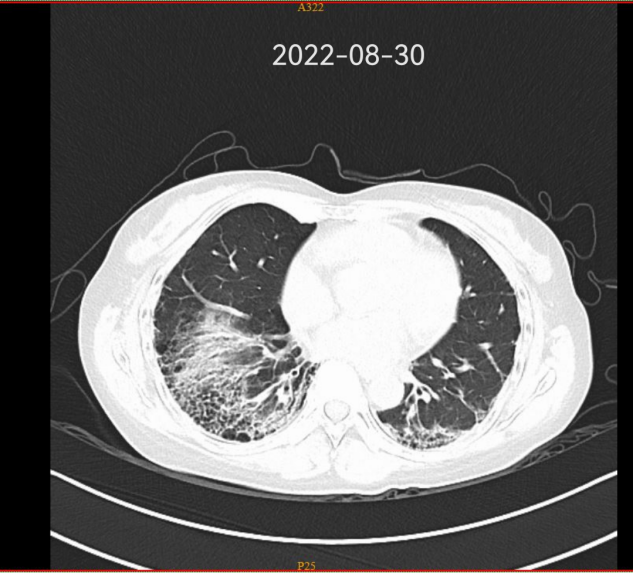
2022-06患者因复查胸部CT提示肺间质纤维化病变无改善,咳嗽加重并出现左上肢皮疹,偶有活动后胸闷、气促,收住入我科进一步诊治。入院后住院查血常规示:WBC 11.28(109/L)↑,中性粒细胞百分数 86.5(%)↑,Hb109(g/L)↓;自身免疫病组合:抗核抗体140.53(IU/ml)↑,补体C3 0.78(g/L)↓,补体C4 0.13(g/L)↓;胸部CT示:1.拟双肺间质肺炎伴纤维化,较前略有进展;双侧胸膜轻度增厚;2.冠状动脉前降支少许钙化;3.心包少许积液。
既往史:曾有肺结核病史,抗结核治疗1年后停药。
02 辅助检查
实验室检查
补体C3、C4
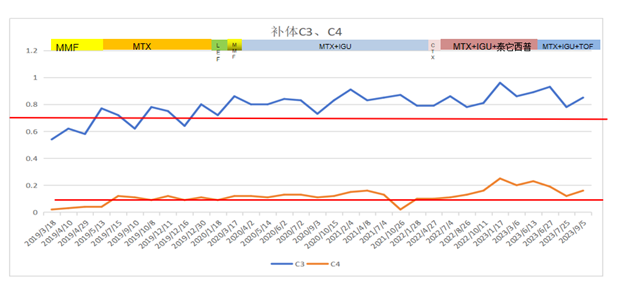
IgG
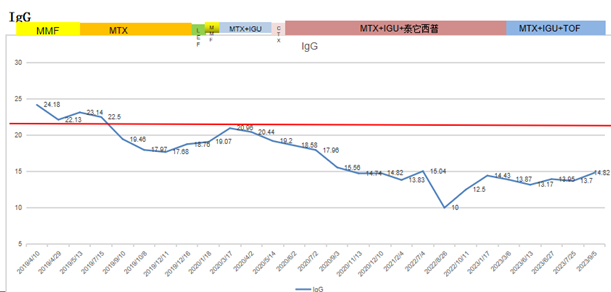
血沉 ESR
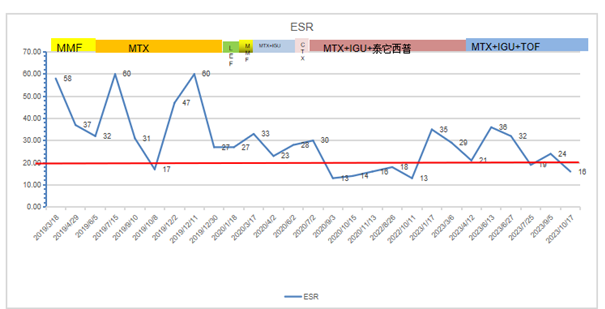
超敏C反应蛋白 hs-CRP
血红蛋白 Hb

白细胞
影像学检查
2019 - 2022 肺部 CT 变化

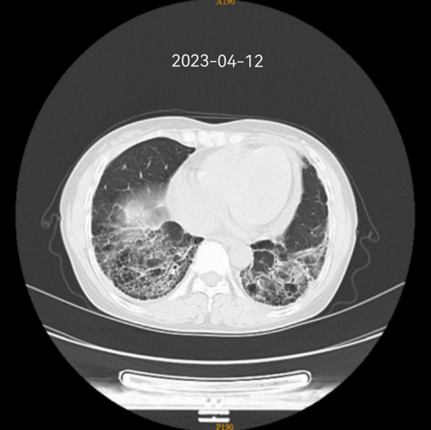
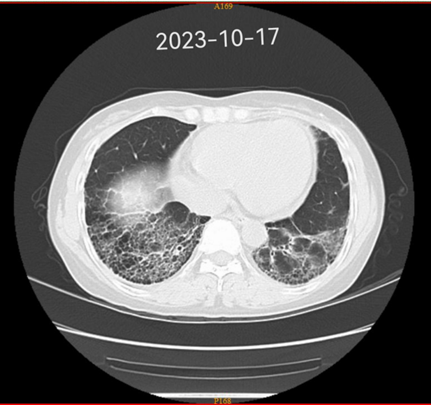
03 诊疗经过
诊断:系统性红斑狼疮 结缔组织病肺间质纤维化 血液系统损害
治疗经过
结合病史、实验室及影像学检查结果综合考虑,诊断“系统性红斑狼疮 结缔组织病肺间质纤维化”。
建议患者使用吡非尼酮抗纤维化,因经济原因拒绝,考虑肺间质病变较前进展,调整治疗方案为泼尼松(12.5mg qm)+ 羟氯喹(200mg bid) +甲氨蝶呤(10mg qw)+艾拉莫德(25mg qd)联合生物制剂泰它西普治疗,曾一度好转,但出现耐药,数月后再次反复出现咳嗽、皮疹、发热、hs-CRP、ESR水平再次升高。
2023-05因咳嗽、皮疹症状加重,复查胸部CT肺间质纤维化病变较前进展,将治疗方案调整为泼尼松(12.5mg qm)+ 羟氯喹(200mg qd) +甲氨蝶呤10mg qw)+艾拉莫德(25mg qd)+托法替布(5mg bid),2023-10门诊随访时患复诉皮疹、咳嗽减轻、无再发热,查血hs-CRP、ESR水平降至正常范围,Hb也升至正常值,肺间质病变未进一步进展,目前门诊规律随访中。
04 诊疗体会
系统性红斑狼疮(SLE)是一种慢性自身免疫性疾病,可累及多个系统损害。间质性肺病(ILD)是一种以炎症和/或纤维化为特征的多种慢性肺部疾病,可导致肺泡壁增厚,导致气体交换障碍。SLE不同于其他结缔组织病(CTD),ILD表现明显的SLE病例并不常见,其亚临床疾病发病率报道差异较大。SLE-ILD作为一种严重的并发症,其疾病特点为蜂窝状斑片异质纤维化和活跃的成纤维细胞灶。患者最初可能会出现呼吸困难和干咳,随着病情进展,呼吸困难会变得越来越严重,最终可能需要进行肺移植。
目前在临床上,SLE-ILD的治疗循证依据有限,通常是借鉴其他证据较多的结缔组织病相关的间质性肺病(CTD-ILD)的治疗方案。疾病进展及其严重程度是决定治疗方案时要考虑的两个主要因素,糖皮质激素和免疫抑制剂是治疗SLE-ILD的常用药物。
托法替布是首个JAK通路抑制剂,能降低炎性因子表达,延缓疾病发展,通过中断JAK/STAT信号通路来抑制多种细胞因子是一种有吸引力的选择;艾拉莫德(IGU)作为免疫调节剂类抗风湿药物,不仅作用于T淋巴细胞,也作用于B淋巴细胞,调节免疫平衡,可以下调循环中前炎症因子及部分炎症因子的水平,从而减轻全身炎症,改善患者整体状态。这两种药物的不同作用机制可以在多个通路上发挥作用,增加治疗效果。亦有体内和体外研究结果也表明,托法替布可以减缓CTD-ILD的进展。
基于上述药物的作用机制,我们为患者制定了多靶点联合治疗方案:MTX+糖皮质激素+氯喹基础上,给予托法替布联合IGU治疗SLE-ILD,使多种慢作用药甚至泰它西普耐药的这位患者病情得以改善,肺间质病变无继续进展。目前针对治疗SLE-ILD的药物还不能完全满足临床需求,仍需寻找新的药物和疗法。托法替布具有巨大的治疗潜力,可以作为一个治疗选择,但仍需要更多的病例及临床研究证明托法替布在SLE-ILD方面的临床疗效。
[参考文献]:
[1]Sendo S, Saegusa J, Yamada H, Nishimura K, Morinobu A. Tofacitinib facilitates the expansion of myeloid-derived
suppressor cells and ameliorates interstitial lung disease in
SKG mice. Arthritis Res Ther. 2019;21(1):184.
[2] Weilin Xie, Shuhua Wang, Yao LI. Clinical efficacy and safety of tofacitinib combined with iguratimod for rheumatoid arthritisassociated usual interstitial pneumonia.
[3] Zhao L, Mu B, Zhou R, Cheng Y, Huang C. Iguratimod ameliorates bleomycin-induced alveolar inflammation and
pulmonary fibrosis in mice by suppressing expression of matrix metalloproteinase-9. Int J Rheum Dis. 2019;22(4):686-694.
[4] Chen Z, Wang X, Ye S. Tofacitinib in amyopathic dermatomyositis-associated interstitial lung disease[J]. New England Journal of Medicine, 2019, 381(3): 291-293.
[5] Adelle S Jee, Tamera J. Corte, Current and Emerging Drug Therapies for Connective Tissue Disease Interstitial Lung Disease(CTD‑ILD), Drugsvolume79,pages1511–1528 (2019).
[6] Wells, A. U. & Denton, C. P.Interstitial lung disease in connectivetissue disease-mechanisms and management Nat. Rev.
Rheumatol. 10, 728–739(2014).
[7]邹庆华,路跃武,周京国,等.结缔组织病相关间质性肺疾病诊疗规范[J].中华内科杂志,2022,61(11):1217-1223.DOI:10.3760/cma.j.cn112138-20220525-00406.


