真实世界:NGS+IHC检测指导卵巢癌精准治疗的应用情况
时间:2023-11-21 17:26:34 热度:37.1℃ 作者:网络
本研究评估了卵巢癌患者精准治疗相关基因变异和免疫组化(IHC)特征,调查了真实世界精准治疗的应用及结果。回顾了 2015 年 1 月至 2021 年 5 月期间在韩国延世大学 Severance 医院诊断为卵巢癌并接受肿瘤下一代测序(NGS)的患者。此外,获取了胚系突变数据,以及错配修复缺陷(MMRd)、程序性死亡配体 1(PD-L1)表达和人表皮生长因子受体 2(HER2)表达 IHC 数据。评估了匹配疗法的使用及临床结局。在接受肿瘤 NGS 的 512 例患者中,403 例接受了胚系 panel 检测。在同时接受两项检测的患者中,肿瘤 NGS 识别了 39 例(9.7%)BRCA 突变患者和 16 例(4.0%)其他同源重组修复(HRR)相关基因突变患者,这些突变在胚系检测中未发现。单核苷酸变异最常见于TP53(82.2%)、ARID1A(10.4%)、PIK3CA(9.7%)和KRAS(8.4%)。在 122 例患者中观察到拷贝数变异。3.2% 的患者 MMRd,10.1% 的患者 PD-L1 高表达,6.5% 的患者 HER2 过表达。75 例患者(14.6%)基于 BRCA 突变,11 例患者(2.1%)基于其他 HRR 相关基因突变,接受了聚(ADP-核糖)聚合酶(PARP)抑制剂治疗。6例(1.2%)MMRd 患者接受了免疫治疗。28 例患者(5.5%)接受了靶向 HER2、成纤维细胞生长因子受体(FGFR)、叶酸受体 α(FRα)、RAS 和 PIK3CA 的其他匹配治疗。本研究对卵巢癌患者胚系突变、IHC 和肿瘤 NGS 数据进行了全面回顾,识别了精准治疗的候选者,其中一部分患者接受了匹配治疗。
研究背景
卵巢癌是最致命的妇科恶性肿瘤。大多数患者(61%)诊断时发生远处转移,尽管最初对化疗敏感,但最终对后续治疗产生耐药。卵巢癌的临床特征包括普遍的TP53突变,基因组高度不稳定性,广泛的拷贝数变异(CNV),以及高比例的同源重组缺陷(HRD)患者。此外,高级别浆液性癌是最常见的亚型,尽管不同种族之间存在差异。
在过去十年中,探索了基于下一代测序(NGS)和免疫组化(IHC)生物标志物,以更好地了解导致对治疗(包括靶向治疗)不同反应的基因组和其他生物学差异。然而,在日常临床中,除了2018年美国食品药品监督管理局(FDA)批准聚(ADP-核糖)聚合酶(PARP)抑制剂用于卵巢癌患者一线维持治疗外,卵巢癌的治疗在过去20年中没有改变。
尽管研究与实际治疗之间存在差异,但既往研究推荐肿瘤测序。例如,NGS可能有助于识别胚系BRCA突变以外的其他HRD相关基因致病性突变的患者。此外,对肿瘤样本进行IHC分析可能有助于识别免疫治疗和抗体-药物偶联物获益患者。为了实现个体化治疗,研究了不同种族卵巢癌患者的分子图谱。然而,数据来源于使用不同测序平台的不同机构或不提供患者实际治疗信息的大型数据库。目前尚不确定基于NGS或IHC分析的靶向生物标志物是否会转化为患者接受此类治疗并产生积极结果。因此,我们回顾了单中心接受肿瘤NGS的卵巢癌患者,收集了详细的临床资料,呈现真实世界匹配治疗情况。
研究结果
患者特征和整体基因图谱
512例患者接受了肿瘤NGS,大多数患者诊断为高级别浆液性癌(73.4%),处于晚期(88.9%)。483 例患者有详细的基因变异信息,包括单核苷酸变异(SNV)、CNV 和融合,可进行进一步分析。其中,454例(94.0%)患者检出SNV,122例(25.3%)患者检出CNV,16例患者(3.3%)检出融合。图 1A 展示了整体基因图谱,包括 18 个突变频率 ≥ 1% 的基因和另外 4 个至少有一例患者发生突变的 HRR 相关基因。基因变异特征因组织学亚型而异:非浆液性癌 TP53 突变频率较低,透明细胞癌 ARID1A 和 PIK3CA 突变频率较高,子宫内膜样癌 PTEN 突变频率较高,黏液性癌 KRAS 突变频率较高。CNV最常见于MYC(43.4%)、CCNE1(18.9%)、FGF23(11.4%)、ERBB2(8.2%)和FGF6(8.2%)(图1B)。最常见的基因融合是GOPC-ROS。SNV和CNV均包括在内时,439/483 例(90.9%)患者在 6 条功能和可靶向通路中,至少存在1条通路改变(图1C)。
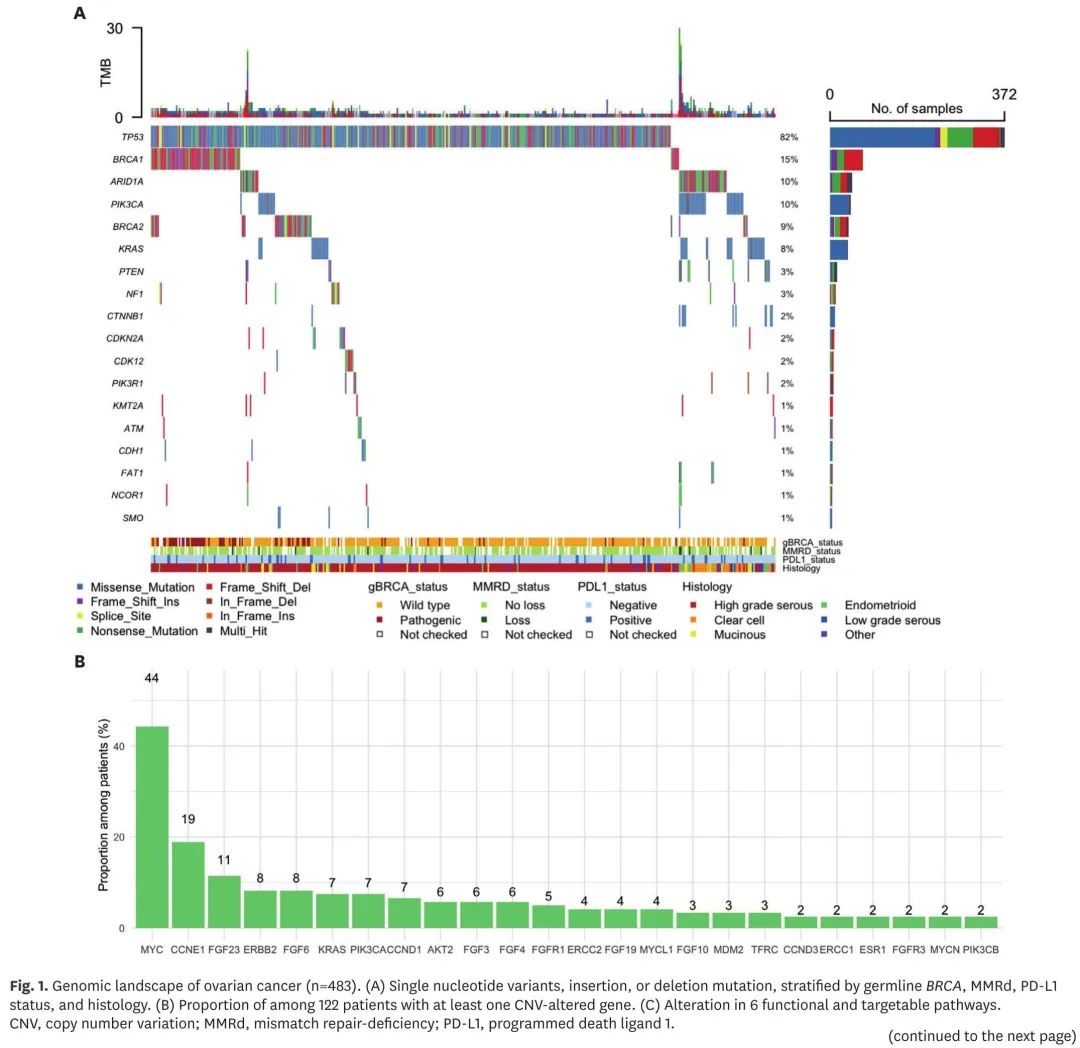
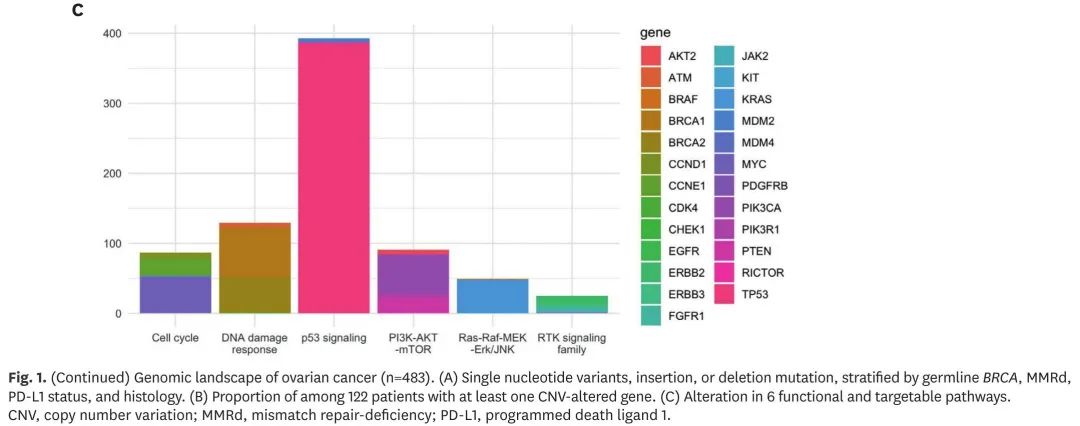
图1. 卵巢癌基因图谱(n=483)
基于肿瘤NGS的BRCA和其他非BRCA HRR突变
除肿瘤NGS外,403例患者进行了胚系panel检测,其中70例(17.4%)检出致病性BRCA突变,包括51例(12.7%)BRCA1和20例(5.0%)BRCA2。在非胚系BRCA突变患者中,体细胞BRCA突变见于37例(9.2%)患者。总体而言,在整个 512 例患者队列中,122 例患者具有胚系或体细胞 BRCA 突变。具体位点如图2A所示。在同时接受肿瘤NGS和胚系panel检测的患者中,107例(26.6%)检出HRR相关基因变异。在这些患者中,肿瘤 NGS 识别了 39 例 BRCA 突变患者(9.7%)和 16 例(4.0%)其他 HRR 相关基因突变(即 ATM、CDK12、CHEK2、RAD51B 和 RAD51D)患者,这些突变在胚系检测中未发现。根据胚系检测结果分层的HRR相关基因突变如图2B所示。关于匹配治疗,在 122 例胚系或体细胞 BRCA 突变患者中,75 例(61.5%)接受了 PARP 抑制剂治疗。这 75 例患者包括高级别浆液性癌(n=71)和子宫内膜样癌(n=4),高级别浆液性癌 PARP 抑制剂治疗的中位 PFS 为 12.02 个月(95% 置信区间 [CI]=8.9-16.6),子宫内膜样癌为 6.37 个月(95% CI,5.03-不适用)。按治疗阶段分层的体细胞BRCA突变患者PARP抑制剂治疗的PFS和OS如图2C所示。在 23 例非 BRCA HRR 相关基因突变患者中,11 例患者接受了 PARP 抑制剂治疗,包括基因变异、治疗阶段和结果在内的详细信息如图 2D 所示。
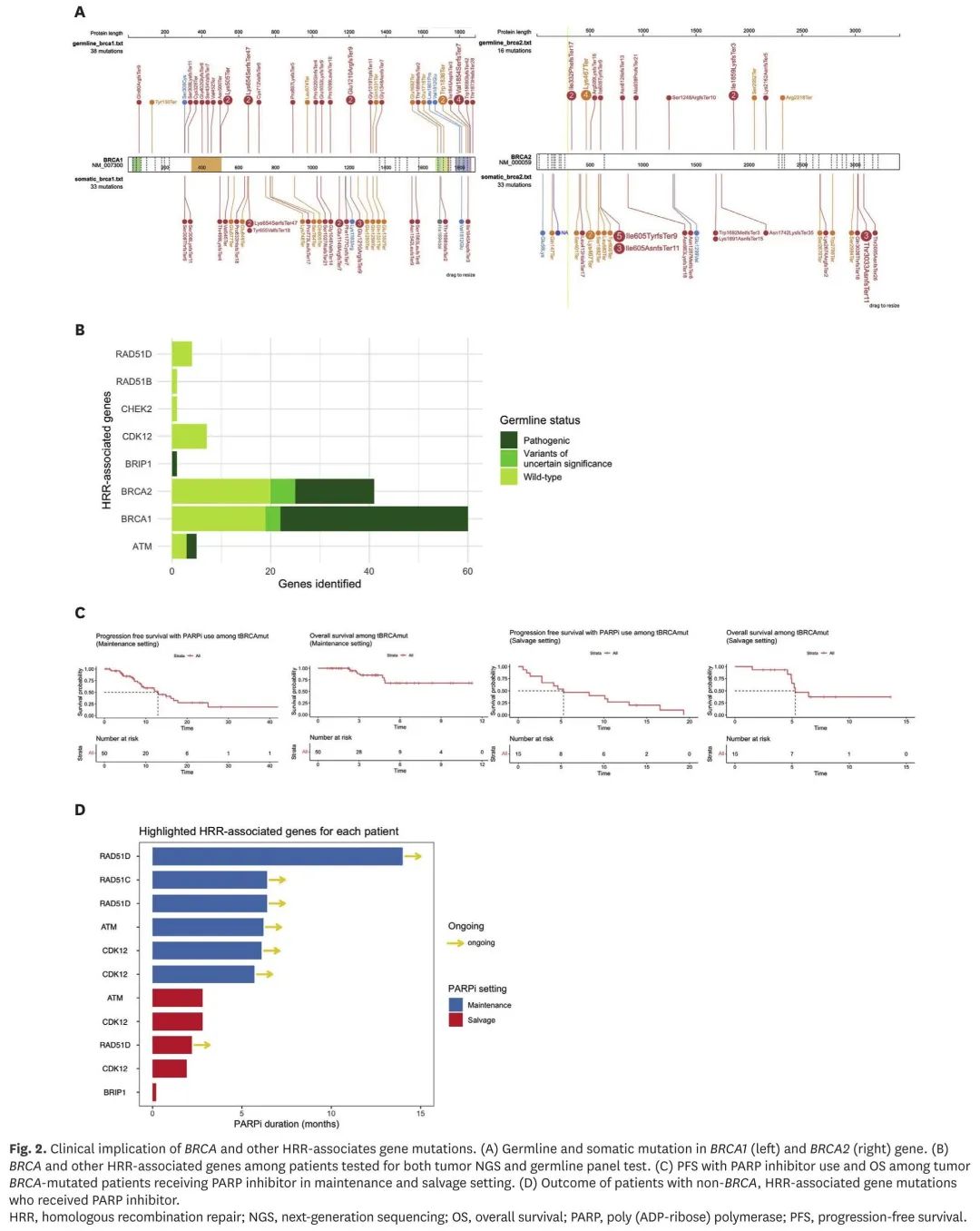
图2. BRCA和其他HRR相关基因突变的临床意义
按BRCA状态分层的IHC生物标志物
在 512 例患者中,IHC 结果显示,11/348 例(3.2%)患者 MMRd,37/367 例(10.1%)患者 PD-L1 过表达(CPS≥10 或 TPS≥25),11/168 例(6.5%)患者 HER2 过表达(3+)。此外,根据BRCA突变状态分析IHC生物标志物(图3)。在 2.6% 的 BRCA 野生型和 3.7% 的 BRCA 突变患者中观察到 MMRd(4 个 MMRd 相关蛋白任何 1 个表达缺失)(p = 1.000)(图3A)。PD-L1过表达在BRCA野生型患者和BRCA突变患者中的发生率分别为11.8%和4.5%(p = 0.076)(图3B)。按BRCA突变状态分层时,仅在BRCA野生型患者中观察到HER2 3+(图3C)。

图3. IHC结果
基于MMRd和HER2状态的匹配治疗结果
IHC显示MMRd的患者的基因图谱如图3D所示。11 例 MMRd 患者中,8 例有 TMB 和 MSI 值。在这 8 例患者中,2 例为子宫内膜样癌。这 2 例患者均 TMB-H;1 例患者同时 MSI-H,并携带胚系 MSH2 突变。在11例MMRd患者中,6例接受了免疫治疗,3例持久缓解(图3E)。关于HER2受体状态,HER2表达2+和3+患者的基因图谱如图3F所示。在148例同时有HER2 IHC和详细基因检测结果的患者中,10例患者HER2 IHC 3+,5例患者ERBB2扩增;4例患者HER2 IHC 3+同时ERBB2扩增。总体而言,在 168 例接受 HER2 受体状态检测的患者中,45 例(34.4%)HER2 2+,11 例(8.4%)HER2 3+。在接受 HER2 靶向药物治疗的 13 例患者中,5/6 例 HER2 3+ 的患者最佳反应为部分或完全缓解。
其他靶向治疗和可靶向基因变异
总体而言,28 例患者接受了靶向治疗,包括 HER2 靶向药物(n=18)、叶酸受体α(FRα)靶向药物(n=5)、成纤维细胞生长因子受体(FGFR)抑制剂(n=4)和变构 AKT 抑制剂(n=1)。在BRCA野生型患者中,根据MD安德森癌症中心(MDACC)和癌症基因组图谱(TCGA)数据库,基于SNV和CNV突变谱分别识别了98例和59例携带理论上可靶向治疗的基因突变的患者(图4)。
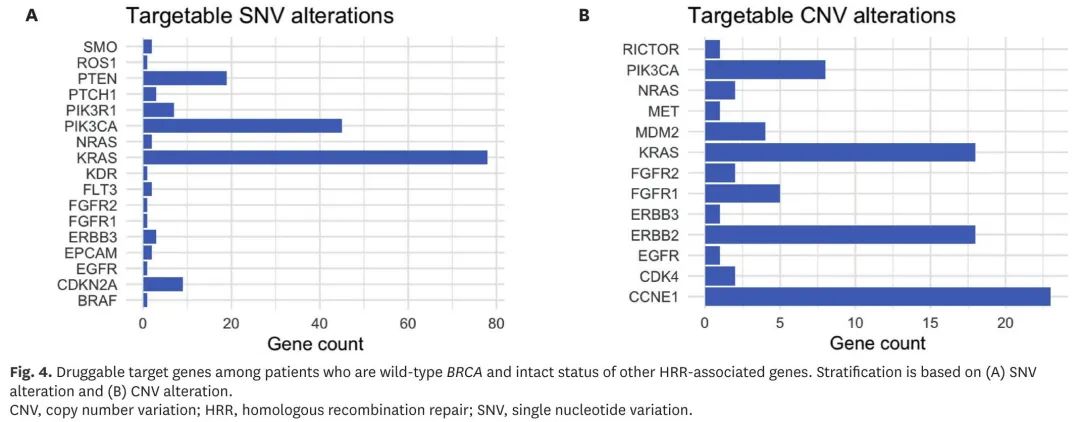
图4. BRCA和其他HRR相关基因野生型患者可靶向基因变异
讨 论
本研究是最大的单个三级中心队列研究之一,提供了有关不同组织学亚型患者基因和IHC图谱以及真实世界靶向治疗应用情况及结果的全面信息。根据基因图谱,95.6%的患者至少存在1个 SNV 或 CNV,91.3% 的患者至少存在 1 条通路改变,其中 p53 通路最常见。TP53突变的发生率为82.0%,高于先前报道的基于韩国人群的卵巢癌患者的61.5%,低于TCGA的96%。我们没有探索TP53的功能域或TP53与其他候选基因之间的基因相互作用,未来可能需要对TP53进行关于IHC特征和靶向治疗结局的研究。
我们的患者中很多为非浆液性癌,这些患者携带 TP53 以外的突变。每种组织学类型的高频基因突变与先前的报道一致:透明细胞癌中ARID1A和PIK3CA突变,子宫内膜样癌中PTEN和ARID1A突变,黏液性癌中KRAS突变。这些基因突变差异是每种组织学类型中不同肿瘤发生的基础,肿瘤NGS或可为了解非浆液性卵巢癌的突变异质性提供有用的信息,并为这些通常预后不良的患者寻找靶向治疗的机会。
关于BRCA突变,我们数据中,总体发生率为23.8%,与先前报道的数据相似。大多数BRCA野生型患者也可以从组织NGS中受益。在BRCA野生型患者中,根据MDACC和TCGA数据库,基于SNV和CNV,分别有28.3%和16.8%的患者存在可靶向变异。具体来说,无BRCA突变的患者可能具有其他可靶向特征,如CCNE1扩增。与TCGA数据类似,我们观察到CCNE1扩增的BRCA野生型患者比例较高,尽管由于BRCA突变患者数量有限,缺乏意义。此外,在22例患者(4.8%)中观察到BRCA以外的HRR相关基因突变,其中一半以上是通过肿瘤检测发现的。非BRCA HRR相关基因突变的发生率与既往报道的约5%相似。考虑到我们的胚系panel包括这些基因,且我们的患者中 78% 同时接受了胚系和肿瘤检测,即使在这种情况下,肿瘤 NGS 帮助识别了额外的 BRCA以外的HRR 相关基因突变患者,其中部分患者接受了 PARP 抑制剂治疗。
根据我们的IHC数据,PD-L1阳性患者的比例为10.1%,低于KEYNOTE-100研究中报道的24.3%。PD-L1表达对卵巢癌免疫治疗的预测价值仍然不确定,因为PD-L1阳性因肿瘤部位、检测方式及特定阈值而异。我们还利用四个MMRd蛋白IHC染色识别了11例潜在的MMRd患者,其中部分患者接受了免疫治疗。此外,HER2受体阳性率为26.8%,处于一项荟萃分析显示的15%-40%的范围内。仅在野生型BRCA患者中观察到HER2 3+,尽管由于患者数量有限,没有统计学意义。考虑到HER2表达与不良预后相关,HER2过表达的BRCA野生型患者可能是靶向治疗的潜在获益者,尤其是对于化疗难治性患者。
总体而言,29.7%的患者接受了PARP抑制剂和其他靶向治疗。与之前对卵巢癌匹配治疗的观察结果类似,除了PARP抑制剂外,潜在可用药突变的实际临床应用相当低。只有在临床试验中,复发或难治性疾病患者才能基于可靶向特征接受具有潜在益处的药物治疗。由于具有每种可靶向特征的患者数量相对较少,前瞻性伞式研究设计似乎更适合卵巢癌患者。
本研究的局限性包括单一中心回顾性设计。虽然我们纳入了特定时间范围内所有接受肿瘤NGS的卵巢癌患者,但只有晚期卵巢癌患者才被国家健康保险计划覆盖。此外,IHC 检测由临床医生决定,仅在部分患者中进行。因此,可能存在选择偏倚。我们的单中心设计允许收集详细的临床和组织病理信息,包括不同治疗阶段特定疗法的数据;然而,在统计学显著性方面,受到特定亚组患者人数少的限制,如TP53野生型或BRCA突变。关于测序结果的解释,本分析的局限性在于其基于测序报告,而非原始数据。尽管如此,我们认为,未来,纳入有详细临床信息的卵巢癌大队列,分析原始数据,有可能有新的发现。
总之,本研究通过全面回顾卵巢癌患者肿瘤NGS、胚系panel检测和IHC数据,识别了有可靶向特征:非BRCA HRR相关基因突变、HER2过表达和MMRd的患者。对于每一组,都呈现了基于这些可靶向特征接受匹配治疗的患者。此外,在PARP抑制剂治疗疗效低于BRCA突变患者的BRCA野生型患者中,基于SNV和CNV数据探索了可靶向突变。本研究是目前规模最大的研究之一,整合了详细的基因组、病理学和临床数据,包括匹配治疗的结果。这些发现将为进一步研究卵巢癌精准治疗的潜在候选者提供信息。
参考文献:
Kim YN, Chung YS, Lee JH, Park E, Lee ST, Kim S, Lee JY. Application of precision medicine based on next-generation sequencing and immunohistochemistry in ovarian cancer: a real-world experience. J Gynecol Oncol. 2023 Nov;34(6):e70. doi: 10.3802/jgo.2023.34.e70. Epub 2023 Jun 26. PMID: 37417298; PMCID: PMC10627761.



