【协和医学杂志】一种白细胞介素-6荧光免疫层析检测方法的临床评价
时间:2023-11-18 21:48:03 热度:37.1℃ 作者:网络
白细胞介素-6(IL-6)是一种多效性细胞因子,广泛参与免疫应答、造血、骨代谢及胚胎发育等生理过程,并在其中发挥重要调节作用[1-4]。
作为机体感染的重要炎症因子,IL-6可由单核细胞、淋巴细胞、巨噬细胞、肿瘤细胞等多种细胞分泌,当机体受到感染或发生炎症时,IL-6被迅速释放入血,通过促进免疫细胞增殖与分化,并引导其向感染部位迁移,同时上调炎症因子表达,进而发挥生理作用,达到促进机体抵御、清除病原体的目的[5]。
病理条件下,IL-6过表达可能对机体产生不利影响,如促进慢性炎症性疾病、自身免疫性疾病进展。在感染性疾病中(如型冠状病毒感染),过量的IL-6可诱导细胞因子风暴产生,导致免疫炎症反应和细胞损伤,进而使病情恶化[6-10]。
正常人体血液中IL-6水平低于7 ng/L,炎症、感染或合并自身免疫性疾病时血液中IL-6含量可显著升高,且与病情严重程度及疾病转归关系密切[1,5]。相较于C反应蛋白和降钙素原等炎症标志物,感染时血液中IL-6水平升高发生更早且持续时间更长,可辅助急性感染的早期诊断。IL-6>7 ng/L时表明存在轻微炎症或感染,150~250 ng/L时提示存在一般性细菌感染或全身性炎症反应,>250 ng/L时提示可能合并脓毒血症,>1000 ng/L时可预警重症感染且患者预后不良的风险极高[1],因此,测定并监测血液中IL-6水平有助于临床对疾病严重程度及预后风险进行评估。
目前,IL-6的检测方法以化学发光免疫分析法和荧光免疫层析法为主[11]。本研究以已投入临床使用的广州万孚生物荧光免疫层析法、西门子IMMULITE1000化学发光免疫分析法为参照,对一种新型荧光免疫层析法检测IL-6的试剂等效性进行评价,并评估该方法检测不同类型样本(血浆、血清)中IL-6含量的等效性,以期为临床开展IL-6快速检测提供更多选择。
1 材料与方法
1.1 样本来源
试剂等效性评价使用样本为2021年12月北京协和医院门诊或住院患者中疑似感染患者以及正常体检人群中无严重溶血、脂血或浑浊的104份临床剩余血清样本(采集自104人,其中男性47例,女性57例,年龄8~89岁);样本等效性评价使用样本为同时间段血浆、血清均包括的39对同源配对的临床剩余样本(采集自39人,男性12例,女性27例,年龄13~78岁)。
本研究已通过北京协和医院伦理审查委员会审批(审批号:HS-3363),并豁免患者知情同意。
1.2 研究方法
1.2.1 主要仪器与试剂
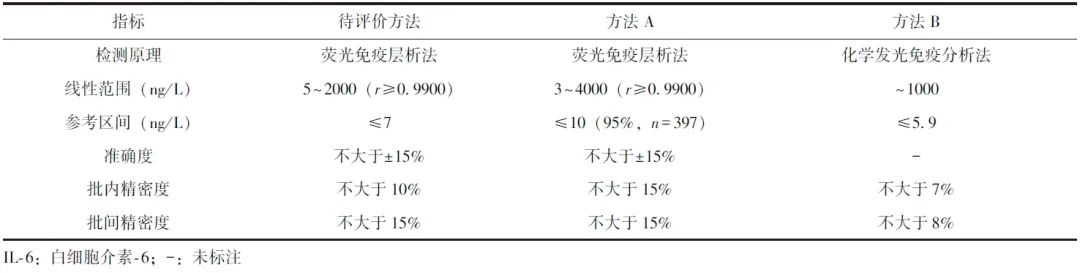
待评价方法的检测试剂为伊诺达生物科技(太原)有限公司研发的IL-6测定试剂盒(批号:FLS01210701),配套结果读取仪器为FIC-Q100N干式荧光免疫分析仪(苏州和迈精密仪器有限公司);作为参照的检测试剂分别为广州万孚生物技术股份有限公司生产的飞测IL-6荧光免疫层析法检测试剂盒(批号:W25114315A,下文简称“方法A”)、德国西门子公司生产的IL-6检测试剂盒(批号:0319)及配套的IMMULITE1000全自动化学发光仪(下文简称“方法B”)。3种检测试剂盒制造商标注的检测范围以及对IL-6的检测性能见表1。
表1 3种IL-6检测方法试剂盒标注的基本性能
1.2.2 试剂等效性评价
(1)定量检测:参考美国临床和实验室标准化协会(CLSI)EP9-A3文件[12],采用待评价方法与2种对比方法(方法A和方法B)平行测定104份血清标本IL-6水平,并分别以对比方法检测结果为X轴,待评价方法检测结果为Y轴,绘制散点图,计算回归方程Y=a+bX,并联合Passing-Bablok和Bland-Altman法分析不同检测方法的一致性和偏倚。
(2)医学决定水平处的预期偏倚:参照CLSI EP9-A2文件[13],获得待评价方法及2种对比方法在IL-6医学决定水平处(7 ng/L)的预期偏倚及其95%置信区间(CI),并计算3种方法的相对预期偏倚(预期偏倚/医学决定水平×100%)。
(3)定性检测:根据试剂盒制造商标注的参考区间判定各方法定性检测结果为“正常”或“异常”,计算符合率一致性及其分布情况。
1.2.3 血浆/血清样本等效性评价
采用待评价方法检测39对同源配对的血浆和血清样本IL-6水平,计算血清与血浆检测结果的一致性和偏倚,并进行回归分析。
1.3 统计学处理
采用SPSS 20.0软件和MedCalc 15.0软件进行统计学分析。采用Passing-Bablok和Bland-Altman法进行检测结果一致性及偏倚分析,采用Pearson法进行相关性分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 待评价方法与对比方法检测血清IL-6的定量结果比较
104份血清样本中,2份样本中的IL-6水平超出方法B检测范围(>1000 ng/L),故定量分析时予以剔除。余102份血清样本中,3种方法检测IL-6水平的Passing-Bablok回归方程斜率为1.1552~1.3072,截距为-7.0950~3.5396(R 2 均>0.9390),相关性系数r为0.9691~0.9892,其中待评价方法与方法A的回归方程为Y=-7.0950+1.1924X(R 2=0.9448),与方法B的回归方程为Y=-2.6143+1.3072X(R 2=0.9391),见图1A~1C。
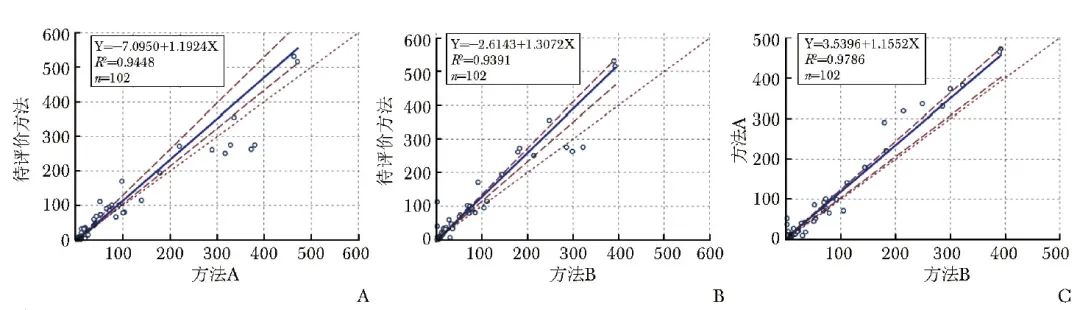
图1 待评价方法与方法A、方法B检测血清IL-6水平的Passing-Bablok图(A、B、C)
IL-6:同表1
Bland-Altman偏倚分析显示,3种方法检测血清标本IL-6水平的偏倚为-3.0~11.9,其中待评价方法与方法A的偏倚最小(-3.0),7.8%(8/102)的数据位于最大允许误差范围(即1.96倍标准差范围)外;待评价方法与方法B的偏倚居中(8.0),6.9%(7/102)的数据位于最大允许误差范围外;而方法A和方法B的偏倚最大(11.9)。上述位于最大允许误差范围外数据对应的IL-6检测值均>50 ng/L,见图1D~1F。
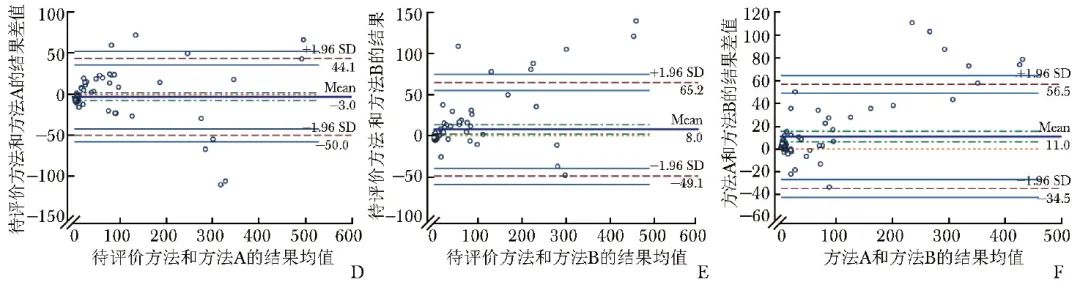
图2 待评价方法与方法A、方法B检测血清IL-6水平的Bland-Altman图(D、E、F)
IL-6:同表1
2.2 待评价方法在医学决定水平处的预期偏倚
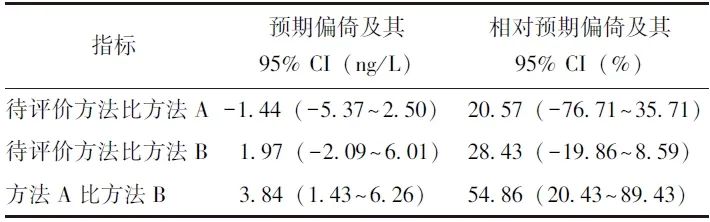
以方法A为参照时,待评价方法在医学决定水平处(7 ng/L)的预期偏倚为-1.44(95% CI:-5.37~2.50)ng/L,该95% CI包含了允许误差(±15%,-1.05~1.05 ng/L),表明偏倚可被接受,提示待评价方法与方法A血清IL-6检测结果相当。
以方法B为参照时,待评价方法在医学决定水平处的预期偏移为1.97(95% CI:-2.09~6.01) ng/L,该95% CI亦包含了允许误差,表明偏倚可被接受,提示待评价方法与方法B血清IL-6检测结果相当。方法A与方法B之间的预期偏倚为3.84(95% CI:1.43~6.26)ng/L,允许误差小于预期偏倚95% CI下限(表2),提示此两种方法的检测结果不相当。
表2 3种方法在医学决定水平处的偏倚值
2.3 待评价方法检测血清IL-6定性结果的符合率
将104份血清样本的测定结果按照3种检测试剂制造商标注的参考区间判定为“正常”或“异常”,并进行符合率分析(由于仅为定性分析,上文提到的2份IL-6含量超过方法B的检测范围的样本未予以排除)。
结果显示,待评价方法与方法A、方法B之间的总符合率分别为84.6%(88/104)和83.7%(87/104),“正常”结果的符合率分别为96.2%(50/52)和96.1%(49/51),“异常”结果的符合率分别为73.1%(38/52)和71.7%(38/53),而方法A和方法B之间的总符合率仅为77.9%(81/104)。
待评价方法与2种对比方法定性结果不一致的数据分布范围分别为(0~7.628)比(6~19.7)(待评价方法 比 方法A)和(1.25~7.2)比(7~30.7)(待评价方法比方法B)。此外,9份样本均被3种方法检测为IL-6浓度高值(>150 ng/L),另1份样本被待评价方法及方法A判定为高值,方法B测定结果为144 ng/L,接近高值判定界值,见表3。
表3 3种方法检测血清样本IL-6定性结果分析
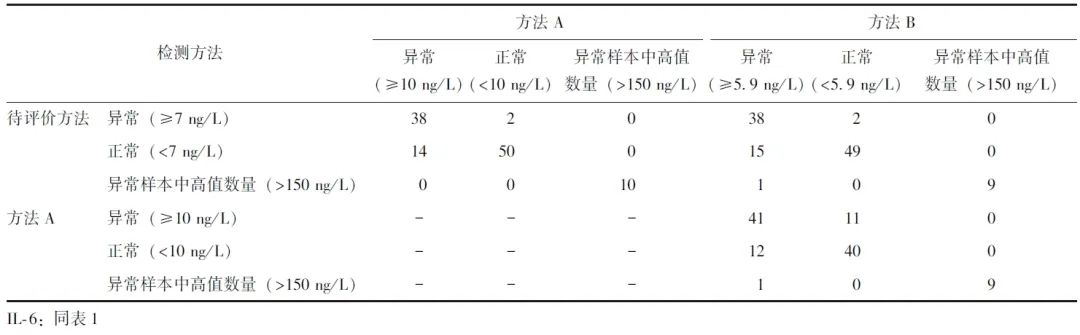
2.4 待评价方法检测同源配对血浆、血清样本的等效性
采用39对同源配对的血浆、血清样本对待评价方法的样本等效性进行评估,结果显示待评价方法检测同源配对血浆、血清标本IL-6水平的Pearson相关性系数为0.999,Passing-Bablok回归分析方程为Y=0.9043X,截距为0,R 2=0.9984(P<0.0001),见图2A。Bland-Altman偏倚分析显示,仅1个(2.6%,1/39)数据位于最大允许误差范围之外,见图2B。
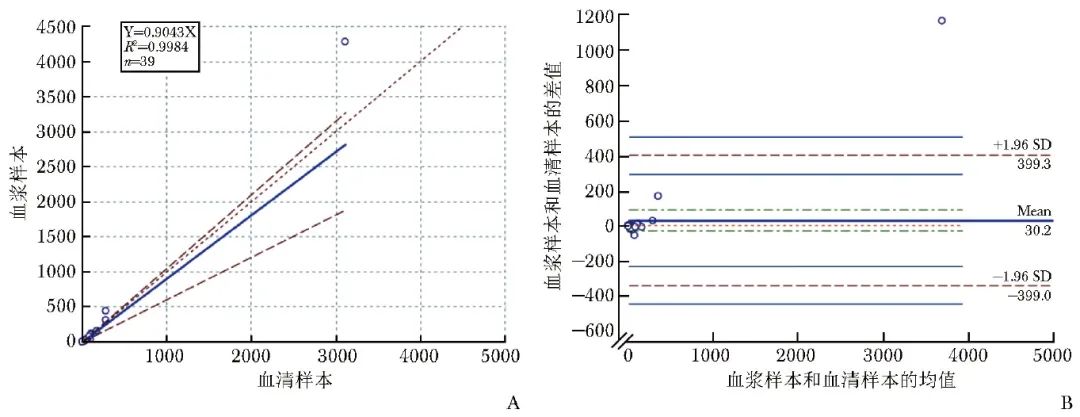
图2 待评价方法检测同源配对血清和血浆标本中IL-6水平的Passing-Bablok图(A)和Bland-Altman图(B)
IL-6:同表1
3 讨论
IL-6是炎症介质网络中的一种关键性炎症因子,对正常情况下生理功能的调节及病理情况下疾病的调控中均发挥重要作用。实验室血清IL-6检测是评估多种炎症性疾病病情严重程度及判断预后的必要手段[1-2]。
目前,临床广泛应用的IL-6检测方法包括化学发光免疫分析法和荧光免疫层析法,其中前者虽具有较高的灵敏度、特异度,但检测速度较慢,且对检测设备、操作及环境要求较高;后者的灵敏度、特异度和稳定性均较好,且操作简单、检测速度快、受环境中自然荧光的干扰小,无需特殊的辅助仪器,对医疗条件较差的基层医疗机构仍适用。
在新的检测系统或试剂应用于临床实验室前,应对其性能与实验室已应用的检测原理相同或不同的检测方法进行对比研究,以评价新试剂盒在临床应用的可行性及其优劣势。
本研究以已应用于临床的广州万孚生物技术股份有限公司飞测IL-6荧光免疫层析法检测试剂盒(方法A)、德国西门子公司IMMULITE1000化学发光免疫层析法IL-6检测试剂盒(方法B)为参照,探究了待评价方法[伊诺达生物科技(太原)有限公司IL-6荧光免疫层析法检测试剂盒]检测血清标本中IL-6水平的等效性。
定量检测结果显示,3种检测方法的相关性系数分布于0.9691~0.9892,待评价方法与方法A(-3.0)、方法B的Bland-Altman偏倚(8.0)均较小,提示待评价方法与方法A和方法B检测血清样本IL-6水平均具有良好的一致性和相关性;分别以方法A、方法B为参照时,待评价方法在医学决定水平处预期偏倚的95% CI均包含允许误差,表明该方法与方法A或方法B均等效。
定性结果分析表明,待评价方法与方法A(84.6%)、方法B的总符合率(83.7%)亦较高。极少量位于Bland-Altman偏倚最大允许误差范围外数据对应的IL-6检测值均>50 ng/L,并不影响IL-6定性结果的判定。
此外,与其有相同检测原理的方法A相比,待评价方法和目前临床常用的标准检测方法B——化学发光免疫层析法之间的定性符合率更高(83.7% 比 77.9%),定量检测结果Bland-Altman分析所示的偏倚程度(8.0 比 11.9)以及在医学决定水平处的预期偏倚(1.97 ng/L 比 3.84 ng/L)亦均小于方法A与方法B之间的偏倚程度,提示待评价方法可满足临床快速检测的需求。
本研究进一步针对血浆样本和血清样本检测结果进行了对比分析,结果显示待评价方法对血浆与血清样本的检测结果具有良好的一致性且不存在统计学差异,仅1个(2.6%)数据位于Bland-Altman偏倚分析的最大允许误差范围之外,提示该方法可选择采集血浆样本或血清标本进行IL-6检测,为临床提供了更多选择。
本研究局限性:虽然待评价方法与方法A、方法B之间定性检测结果的总符合率高于方法A和方法B之间的总符合率,但仍有进一步提升空间,对定性结果不一致的数据进行分析后发现,其均分布于各方法的阴阳性截点值(cut-off point)附近。由于本研究纳入样本较少,无法识别出该方法检测结果与化学发光免疫分析法检测结果不一致或假阳性/假阴性的IL-6水平分布具体范围,故若检测结果位于该灰区区域时,临床解读需结合患者症状及其他检查综合确定。
综上,伊诺达生物科技(太原)有限公司研发的IL-6测定试剂盒与目前临床应用的相同原理的快速检测方法或临床标准检测方法化学发光免疫分析法,检测血清IL-6水平具有良好的一致性和相关性,且适用于血浆样本的检测,一定程度上可满足临床检测需求。在未来研究中,可通过大样本数据确定不同试剂盒之间检测结果的关系,建立换算方程,确保不同检测方法均可进行量值传递,并将不同方法间的差异降至最低,以实现最精准的临床检测。
参考文献
[1]Hirano T. IL-6 in inflammation, autoimmunity and cancer[J]. Int Immunol, 2021,33: 127-148.
[2]Hunter CA, Jones SA. IL-6 as a keystone cytokine in health and disease[J]. Nat Immunol, 2015,16: 448-457.
[3]Giraldez MD, Carneros D, Garbers C, et al. New insights into IL-6 family cytokines in metabolism, hepatology and gastroenterology[J]. Nat Rev Gastroenterol Hepatol, 2021,18: 787-803.
[4]Choy E, Calabrese LH. Neuroendocrine and neurophysiological effects of interleukin 6 in rheumatoid arthritis[J]. Rheumatology (Oxford), 2018,57: 1885-1895.
[5]Jones SA, Jenkins BJ. Recent insights into targeting the IL-6 cytokine family in inflammatory diseases and cancer[J]. Nat Rev Immunol, 2018,18: 773-789.
[6]Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study[J]. Lancet, 2020,395: 1054-1062.
[7]Kang S, Kishimoto T. Interplay between interleukin-6 signaling and the vascular endothelium in cytokine storms[J]. Exp Mol Med, 2021,53: 1116-1123.
[8]Han H, Ma Q, Li C, et al. Profiling serum cytokines in COVID-19 patients reveals IL-6 and IL-10 are disease severity predictors[J]. Emerg Microbes Infect, 2020,9: 1123-1130.
[9]Dhar SK, Vishnupriyan K, Damodar S, et al. IL-6 and IL-10 as predictors of disease severity in COVID-19 patients: results from meta-analysis and regression[J]. Heliyon, 2021,7: e6155.
[10]甘世伟, 章晓红, 陈红. 白介素6与冠状病毒肺炎关系的研究进展[J]. 中华临床医师杂志(电子版), 2020,14: 573-576.
[11]张文琪. 荧光定量免疫层析法检测白介素6的建立及应用[D]. 广州:华南理工大学, 2017.
[12]CLSI. EP9-A3: Measurement Procedure Comparison And Bias Estimation Using Patient Samples[S]. Wayne,PA:CISI,2013.
[13]CLSI. EP9-A2: Method Comparison and Bias Estimation Using Patient Samples[S]. Wayne,PA:CISI,2002.


