读书报告 | SCLC患者免疫治疗的临床获益与肿瘤抗原递呈能力相关
时间:2023-11-01 17:40:02 热度:37.1℃ 作者:网络
导读
SCLC占所有肺癌的13%-15%,全球每年新发患者约25万例,约2/3的初诊患者为广泛期。尽管广泛期SCLC患者通常对一线铂类为基础的联合化疗方案敏感,但大多数患者会在一年内经历化疗耐药并复发转移。在一线化疗中加入ICB(PD-1或 PD-L1)可以改善广泛期SCLC患者的无进展生存期(PFS)和总生存期(OS)。小部分SCLC患者会对ICB产生持久应答(例如,使用durvalumab将3年生存率从5.8%提高到17.6%),大多数SCLS患者获益甚微(中位生存期仅从10.5个月提高到12.9个月)。因此,更好地了解SCLC的潜在生物学及其与免疫系统的相互作用,明确影响免疫应答的决定性因素,确定有助于持久临床获益(DCB durable clinical benefit,DFS≥6个月)的机制,将为SCLC患者的个体化治疗提供有价值的信息并改善预后。
SCLC细胞表面MHC-I类分子低表达、抗原递呈障碍和CD8+Teff浸润耗竭因素均可促进免疫逃逸。本文了探索ICB治疗SCLC获得持久获益的预测性生物标志物,系统地研究CheckMate 032研究中单纯接受ICB治疗的患者(nivolumab或nivolumab/ipilimumab),取其肿瘤组织标本,探索性分析SCLC亚型、抗原递呈关键决定因素的表达、CD8+Teff浸润程度等因素与ICB治疗(PD-1抗体或PD-1+Ctla-4 )获得DCB之间的相关性。既往有研究显示,YAP1高表达的SCLC-Y型患者高表达IFN-γ应答相关基因,有较高的T细胞炎症相关基因评分,是免疫治疗获益的人群,本研究发现SCLC-Y亚组的炎症特征基因基线水平虽然较其他3个亚型偏,但未达到统计学意义。
抗原递呈机制(APM)是肿瘤抗原被正确识别、处理并呈递到CD8+细胞毒性T细胞,并启动T细胞免疫杀伤肿瘤细胞的重要过程。本研究预设了一个影响编码抗原递呈机制(APM)的基因谱,包括HLA-A、HLA-B、HLA-C、B2M、TAP1和TAP2等关键基因,筛选APM-high、APM-med、APM-low三种不同患者与免疫治疗DCB相关性。抗原递呈相关基因(APM)确实在SCLC-Y中强烈富集,且与炎症相关基因密切相关。此外, SCLC中抗原呈递机制经常受到表观遗传学抑制,EZH2和LSD1是2个关键的负向表观遗传因子,本研究显示LSD1、 EZH2的高表达与更差的OS显著相关。
CD8+ T细胞是介导ICB疗效的主要效应细胞了,肿瘤微环境内CD8+T淋巴细胞浸润程度可预测ICB疗效,本研究亦证实CD8+ T细胞浸润与炎症、APM及预后正相关。
综上所述,虽然本研究显示SCLC的4个亚型免疫治疗DFS、OS无显著差距, 但YAP1高表达与更高的炎症基因水平、更高的APM基因富集呈正相关。SCLC-YAP1亚型有助于改善肿瘤免疫微环境,筛选免疫治疗优势人群。此外,EZH2和LSD1做为2个关键的负向APM调节因子,可为后续逆转耐药提供重要靶点(J Thorac Oncol. 2023 May 18;S1556-0864(23)00554-3. doi: 10.1016/j.jtho .2023.05.008)。
抗原递呈在肿瘤免疫治中的作用
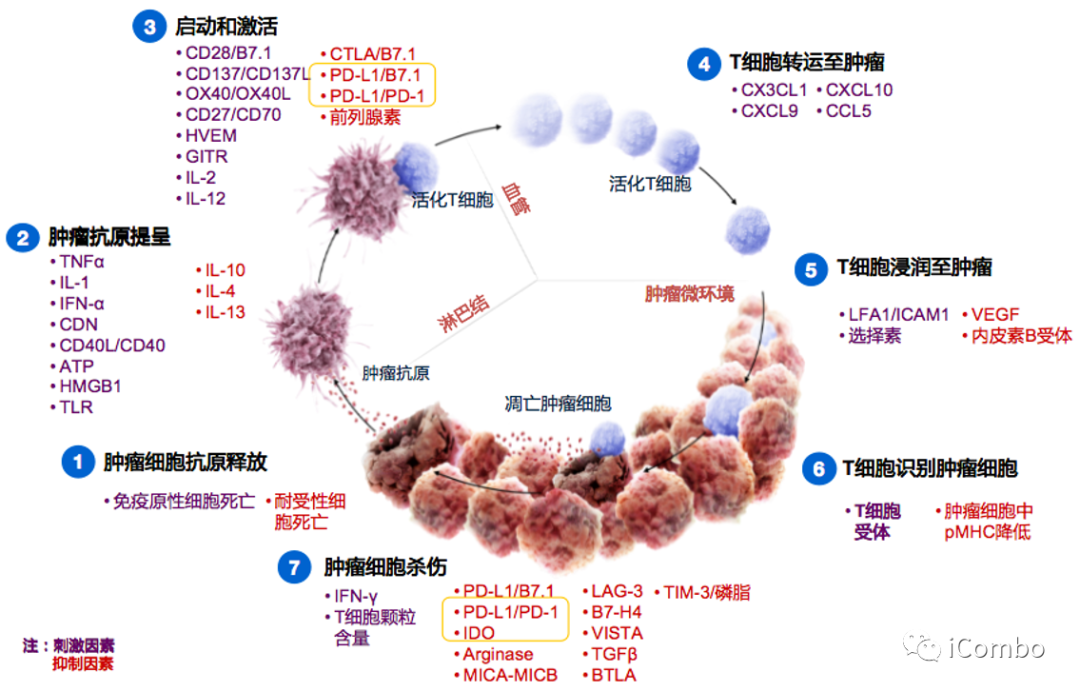
肿瘤免疫包括肿瘤细胞抗原释放、肿瘤抗原提呈、启动和激活、T细胞转运至肿瘤、T细胞浸润至肿瘤、T细胞识别肿瘤细胞、肿瘤细胞杀伤。
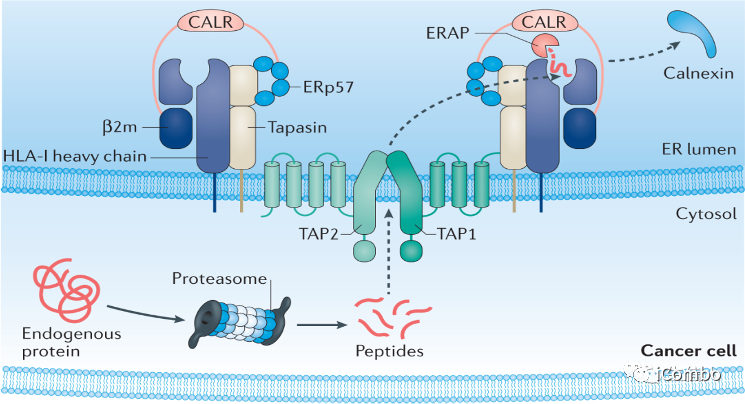
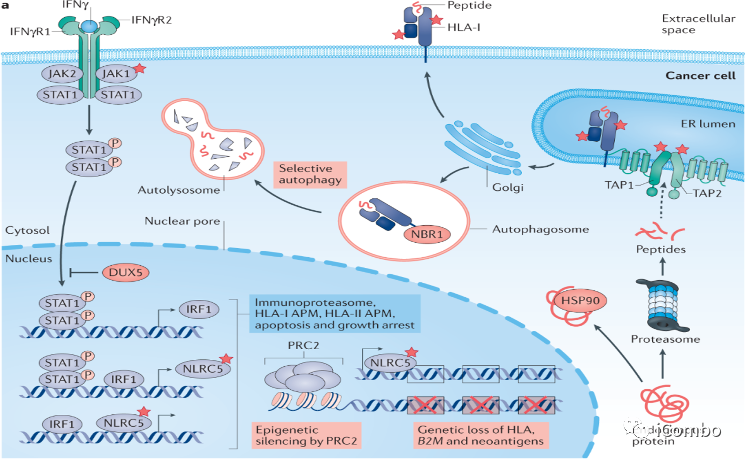
CD8+T细胞是抗癌免疫的主要细胞,通过特异性识别肿瘤细胞上主要组织相容性复合物(MHC;脊椎动物)或人类白细胞抗原(HLA;人类)呈递的抗原肽,被激活并杀死肿瘤细胞。由于在肿瘤部位存在抑制信号,所以肿瘤特异性T细胞通常功能失调。在部分患者中,通过免疫检查点抑制(ICI)消除这些抑制信号可导致T细胞重新激活,并提高临床疗效。细胞表面的HLA-1复合物由三部分组成:HLA-1重链,β2-微球蛋白(β2m)和源自内源性蛋白质的8-12个氨基酸肽。HLA-1复合物本身是APM的一个组成部分,参与了HLA-1呈递肽的过程(上图)。蛋白酶体是主要的酶复合物,其将细胞蛋白加工成肽,然后由ATP结合盒转运蛋白TAP1和TAP2转运到ER中。HLA-1上的肽加载发生在ER中,并由肽加载复合物(PLC)中的几种辅助蛋白和分子伴侣协助。一旦形成了稳定的HLA-1肽复合物,就可以转移到细胞表面。炎症环境中,抗原呈递可以被上调,主要是通过活化淋巴细胞产生的细胞因子IFNγ,通过JAK–STAT信号传导途径的IFNγ受体信号传导可诱导多种APM成分,包括顺式或反式的HLA-1重链和β2m(下图),该回路可增强免疫反应,并增强对靶细胞的识别和杀伤能力。
SCLC的四种分子亚型
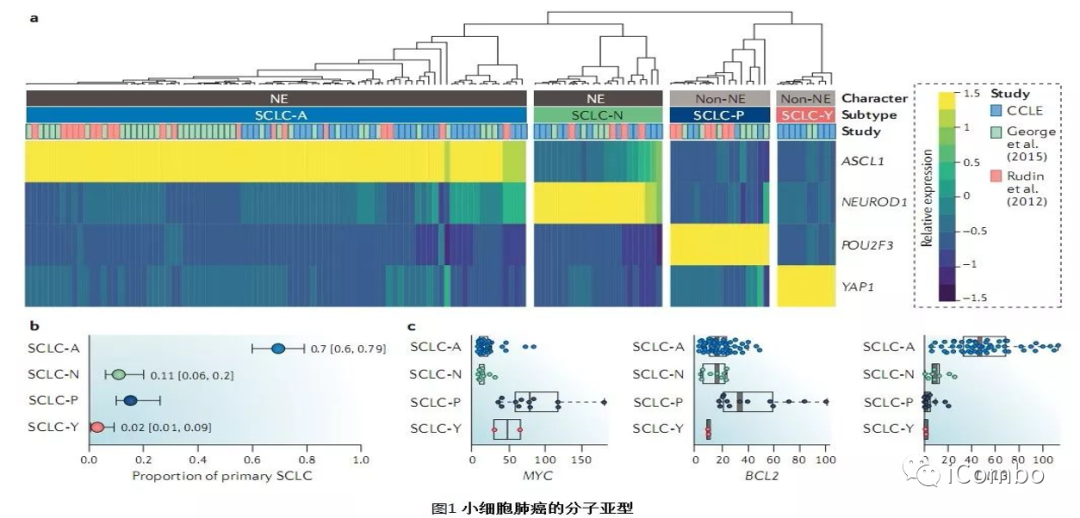
四种SCLC亚型,主要由转录因子ASCL1、NEUROD1和POU2F3的差异表达或上述三种转录因子标记的低表达伴炎症基因YAP1高表达定义:
-
SCLC-A型(ASCL1高表达):对BCL-2抑制剂或PARP抑制剂联合免疫检查点抑制剂敏感
-
SCLC-N型(NeuroD1高表达):对Aurora激酶抑制剂敏感;
-
SCLC-P型(POU2F3高表达):对PARP抑制剂和核苷类似物敏感;
-
SCLC-Y型(YAP1高表达):对免疫检查点抑制剂敏感。
其中SCLC-A型和SCLC-N型属于神经内分泌肿瘤,伴有神经内分泌分化驱动基因INSM1及TTF-1等高表达;
SCLC-P和SCLC-Y亚型为非神经内分泌表型,伴有上皮间质转化、NOTCH、HIPPO信号通路等激活。


CheckMate 032,一项多中心、开放标签、1/2期试验,评估单用ICB治疗(nivolumab或者联合ipilimumab)SCLC患者规模最大的临床研究,研究的SCLC队列旨在评估纳武利尤单抗±伊匹单抗用于复发性SCLC的疗效和安全性。晚期SCLC一线或多线含铂双药化疗失败后,无论PD-L1表达水平,均可以入组。患者随机分配接受N 单药(3mg/kg,Q2w)或N+I联合方案(N 1mg/kg+ I 3mg/kg 或N 3mg/kg + I1mg/kg,Q3w,4周期后,N 3mg/kg,Q2w维持)。主要研究结果为独立评审委员会评估的ORR和DOR。与纳武利尤单抗单药组相比,联合伊匹木单抗组在复发性SCLC中能获得更高的肿瘤缓解:22% vs 12%,但两组间OS无显著差异。对该研究的综合探索性分析显示,存在高水平组织TMB(tTMB)的SCLC患者采用联合治疗方案较单药组能获得更优疗效;但两组肿瘤细胞上PD-L1的表达水平均未显示出与临床结果的相关性。
研究方法
1.患者选择
本研究从Checkmate032(NCT01928394 n=460)所有入组患者中筛选了286个可获得SCLC肿瘤组织的样本,进行全转录组RNA测序(RNA-seq)分析,其中156例采用单药nivolumab治疗,130例采用nivolumab + Ipilimumab联合治疗。根据SCLC亚型(SCLC- a、-N、-P和-Y)与免疫治疗持久获益相关性的基因表达特征,通过免疫组化进一步探索潜在的生物标志物。
durable benefit=DCB(durable clinical benefit):持久获益,DFS≥6个月
2.RNA测序
RNA样品用Illumina Truseq RNA外显体方法进行文库制备,然后在Illumina Novaseq平台上采用末端配对策略进行测序,每个样本的目标读取深度为50 M。
3.免疫组化检测MHC-I和CD8
MHC-I:委员会认证的病理学家根据肿瘤细胞表达的频率和强度进行评分。评分包括评估在任何强度水平上显示MHC-I表达的肿瘤细胞的总百分比(MHC-I~肿瘤细胞/总肿瘤细胞)和“组织得分”(H-score)
CD8 IHC 评分以CD8+免疫细胞占总细胞的百分比表示。
4.生信学分析
研究结果
基线人口统计学和临床特征
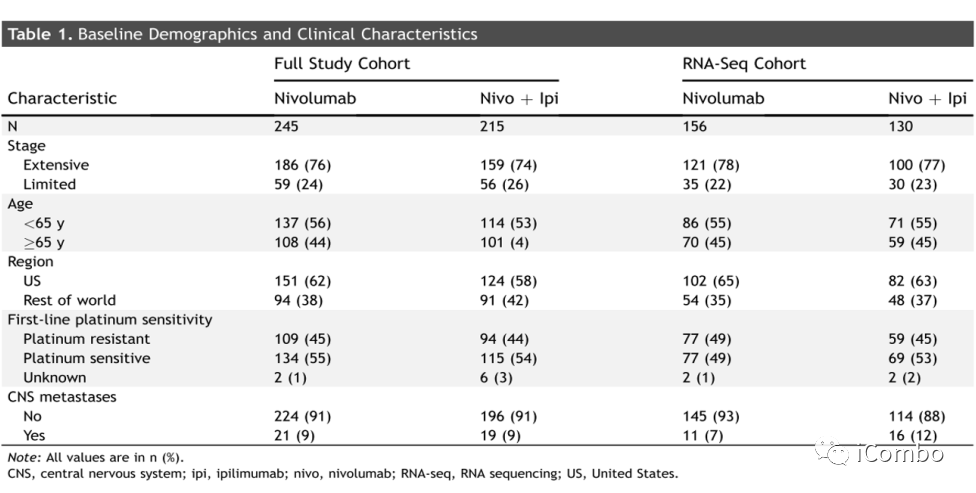
入组患者SCLC亚型划分
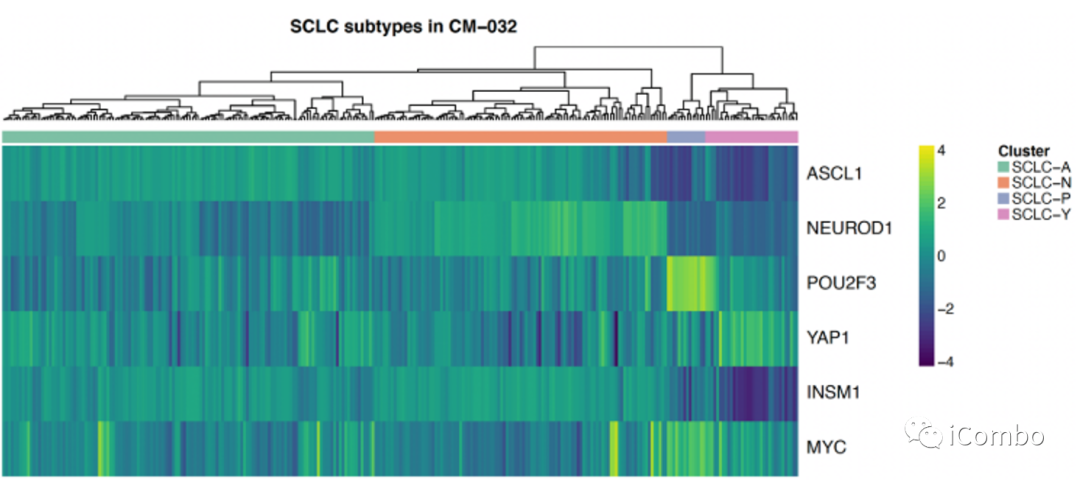
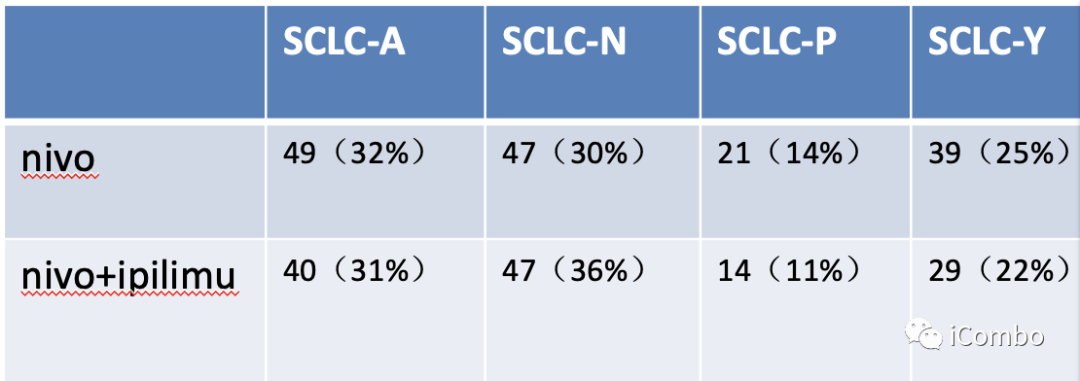
图1:CheckMate 032筛选的SCLC患者肿瘤中的差异基因表达。根据ASCL1、NEUROD1、POU2F3和YAP1的相对表达量,对286例SCLC进行SCLC- a、-N、-P和-Y的亚型划分,各个亚型患者在2个免疫治疗组基本平衡。
SCLC亚型对免疫治疗效果的影响
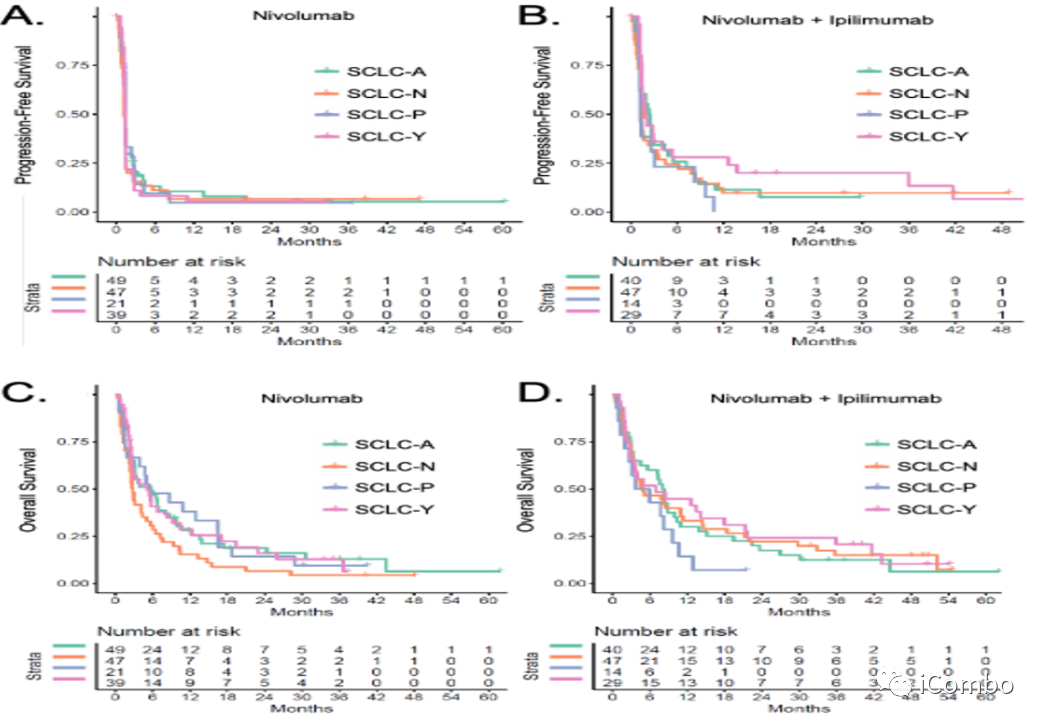
CheckMate 032研究的两组患者中,本研究试图探索SCLC转录亚型与PFS和OS之间的相关性。在4个确定的亚型中,任何一个特定的亚型均没有发现与结果(PFS、OS)有统计学意义的相关性。
SCLC各亚型的炎症特征与APM相关性
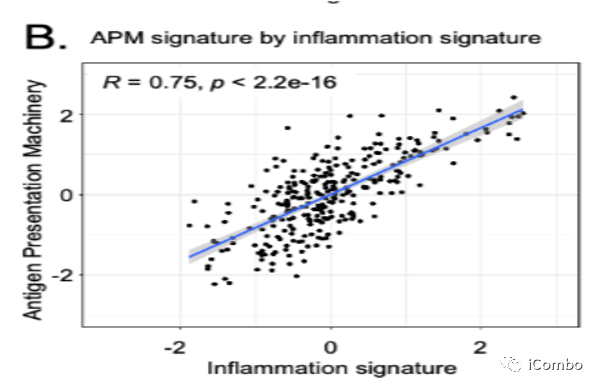
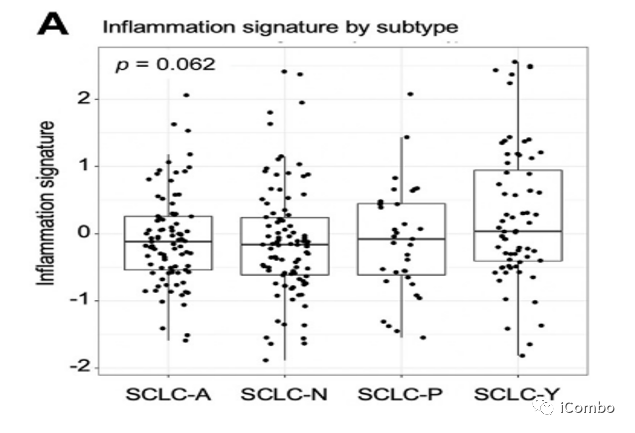
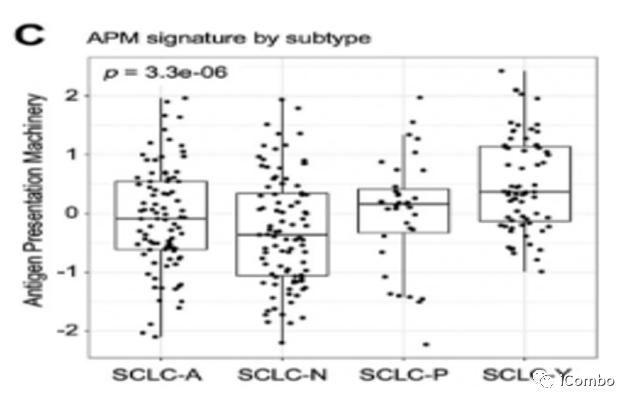
基因表达谱的分析显示,与其他转录组相比,SCLC-Y亚组的炎症特征基因基线水平较高,但未达到统计学意义(p=0.062;图1A);APM基因在SCLC-Y中强烈富集(p < 10-5图1C),且APM与炎症特征确实密切相关(R=0.75 P=2.2 ×10-16图1B)
APM与炎症特征及预后正相关
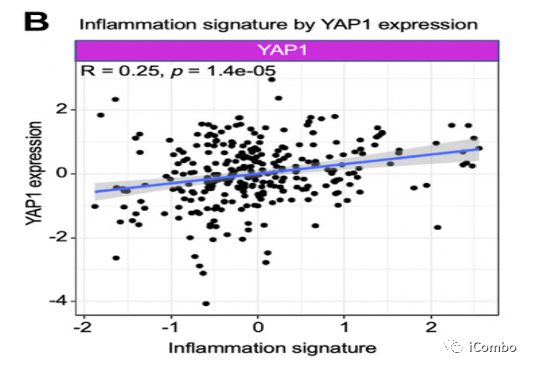
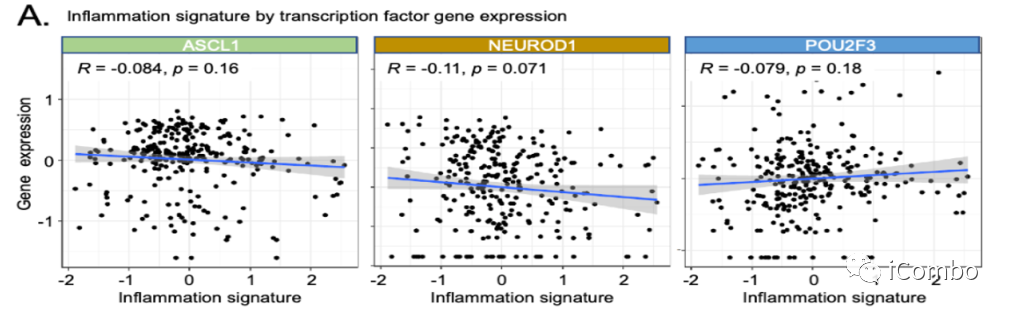
YAPl基因表达确实与炎症特征显著相关(R=0.25,p=0.00014),而ASCL1、NEUROD1、POU2F3基因表达与炎症特征无显著关联。
APM高表达与OS延长正相关
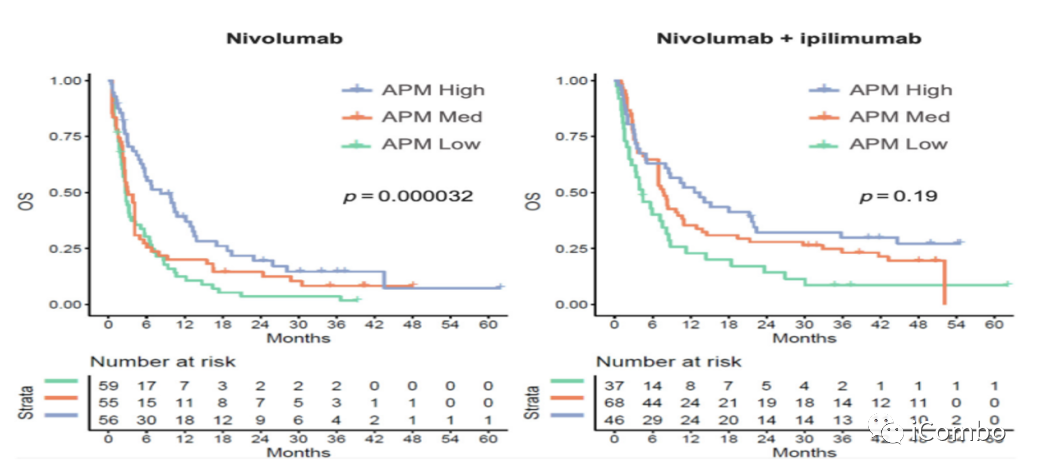
在nivo单药治疗的患者中,APM表达与OS显著相关(p=3.2 × 10-4),在联合使用nivo + ipilimu并具有更高APM特征表达的患者中,生存率也有改善的趋势(p=0.19)。
CD8+Teff、MHC-I高表达与OS延长正相关
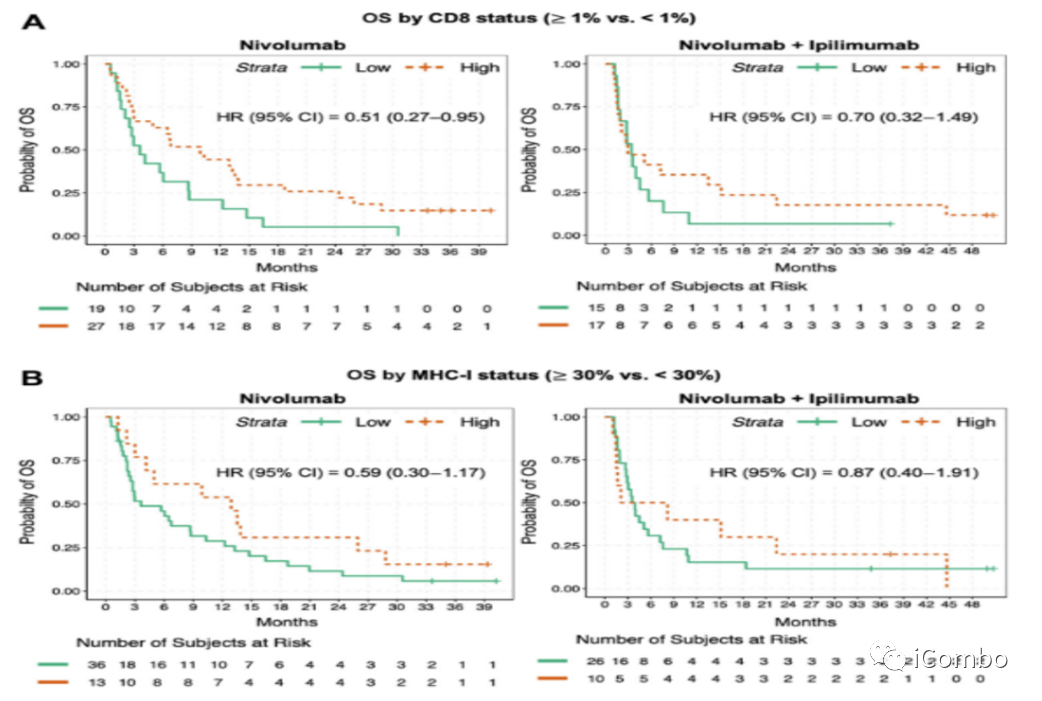
2个治疗组中,肿瘤组织 CD8+Teff和MHC-I的高表达与更好的OS趋势正相关。
CD8+ T细胞浸润与炎症、APM及预后正相关
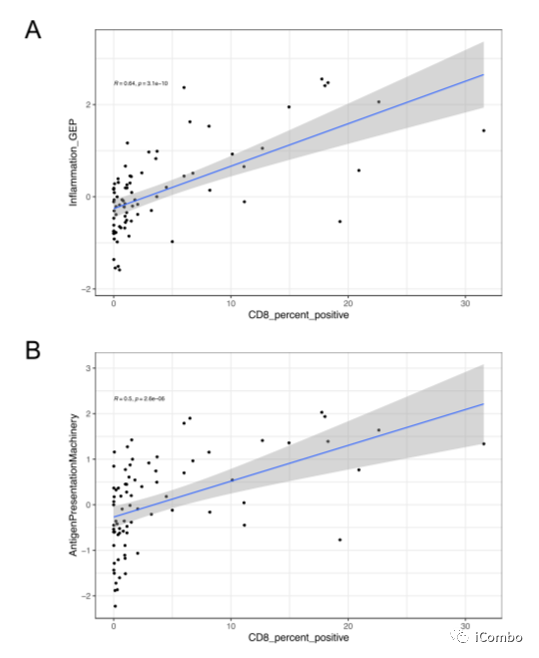
基于免疫组化(IHC)将CD8+ T细胞浸润作为一个连续变量进行评估,肿瘤的炎症基因表达与CD8+ T细胞浸润程正相关(R=0.64; p=3.1×10-10 ) CD8+T细胞对肿瘤的识别完全依赖于MHC-I背景下的抗原递呈。

预后:CD8浸润状态分为阴性(<1%的肿瘤细胞)或阳性(≥1%的肿瘤细胞)两组,接受nivo治疗的CD8阳性患者的OS相对于CD8低的患者有所改善(HR=0.51, 95% CI:0.27-0.95);在接受nivo+ipilimu联合治疗的患者中观察到类似的趋势(HR=0.7, 95% CI: 0.32-1.49)。
ICB持久受益患者的基因富集—KEGG基因数据库
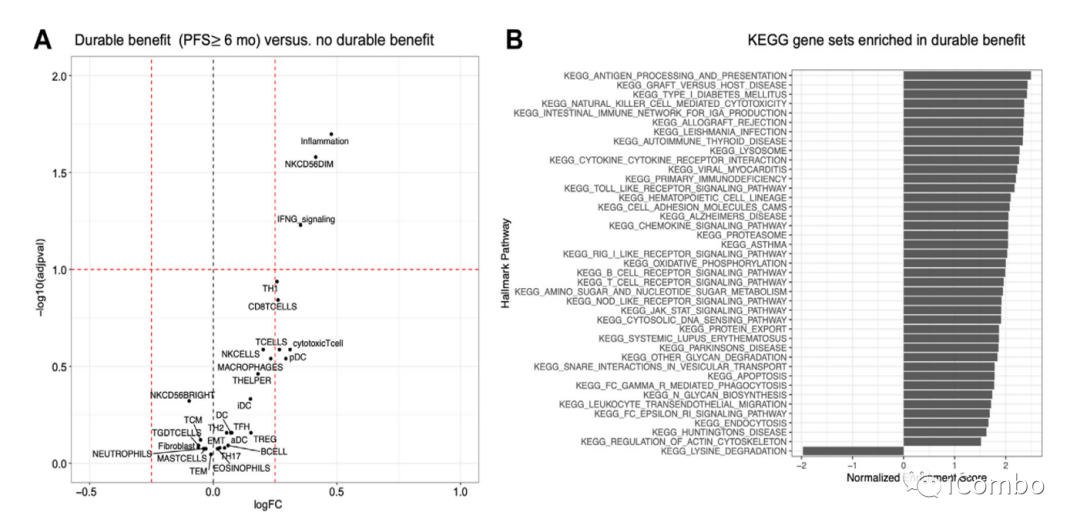
a)ICB 持久效益(DCB)相关基因的火山图:获得DCB的肿瘤组织具有更高水平的炎症、自然杀伤(NK)细胞激活和干扰素γ信号。
b)DCB与抗原加工和呈递、T细胞增殖相关的多个路径相关( KEGG基因数据库)
SCLC-Y中巨噬细胞、NK细胞特征基因富集
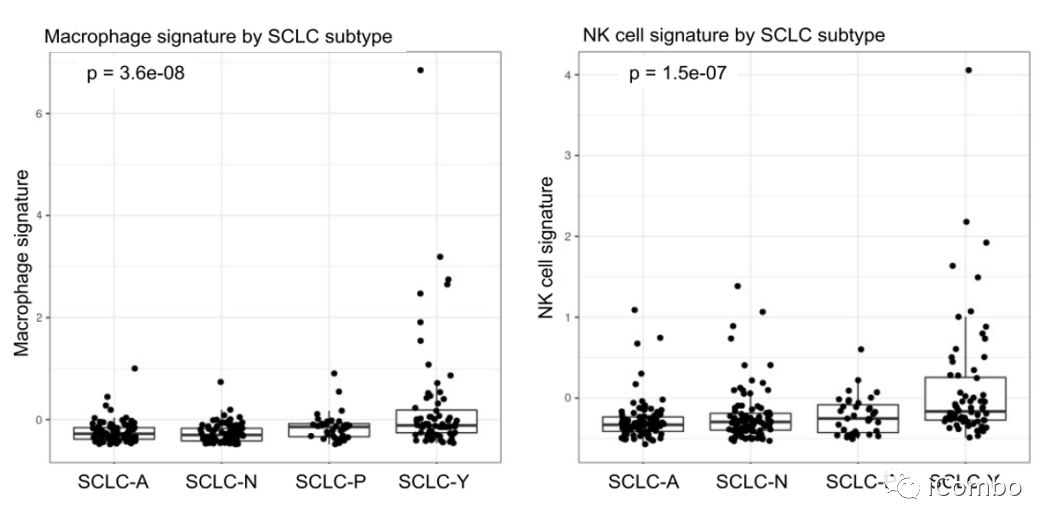
补充的图S8:本研究基因的富集和通路分析也提及了其他免疫细胞类型,巨噬细胞和NK细胞的特征性基因在SCLC-Y亚型中明显升高
APM表观遗传学差异与OS
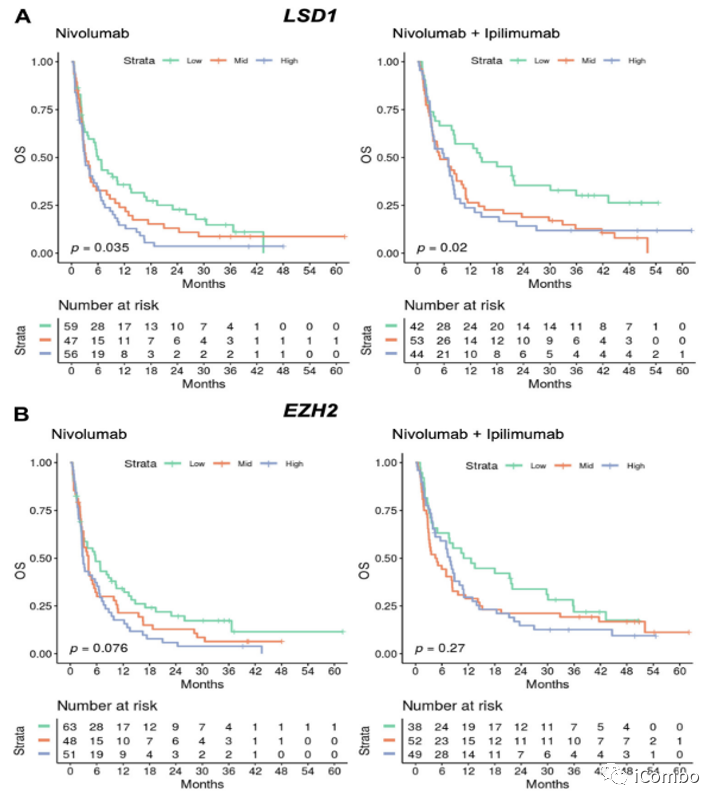
EZH2 :是组蛋白甲基转移酶和polycomb抑制复合物2(PRC2)的催化亚单位,可通过抑制肿瘤内抗原呈递、免疫细胞迁移和增强CD4+T调节细胞(Treg)的抑制活性来促进免疫逃避。
LSD1 赖氨酸特异性去甲基化酶, 是肿瘤免疫疗法强有力的抑制靶点,LSD1抑制剂联合PD-1/PD-L1抑制剂可作为一种新的癌症治疗手段,目前已有6个TCP类不可逆性LSD1抑制剂(TCP、GSK2879552、IMG-7289、ORY1001、INCB059872和ORY-2001)进入临床试验,单独或与其他药物联用治疗小细胞肺癌和急性髓系白血病;2个可逆抑制剂CC-90011和SP-2577已进入I/II期临床用于实体肿瘤瘤的治疗。
EZH2和LSD1是SCLC中MHC-I表达和抗原递呈的关键因素,LSD1、 EZH2的高表达与更差的OS显著相关。
结果
SCLC的4种分子亚型与免疫治疗的生存获益无关, 但SCLC-YAP1亚型的YAP1高表达与更高的炎症基因水平、更高的APM基因富集呈正相关,该亚型仍有助于改善肿瘤免疫微环境,筛选免疫治疗优势人群。
APM-high与免疫治疗的生存有关(p=0.000032),CD8+T细胞浸润≥1%免疫治疗的生存有关(风险比=0.51,95%置信区间:0.27-0.95)
MHC-I 表达水平较高( ≥ 30%)的患者在 ICB 治疗后也有更高的生存率
EZH2 、LSD1基因表达与接受ICB患者较差的生存相关,靶向抑制免疫细胞活性的表观遗传因子可以通过重塑肿瘤微环境(TME)来增强抗肿瘤免疫,提高SCLC患者免疫治疗的临床效益。


