反常性痤疮的生物治疗进展
时间:2023-10-31 14:38:58 热度:37.1℃ 作者:网络
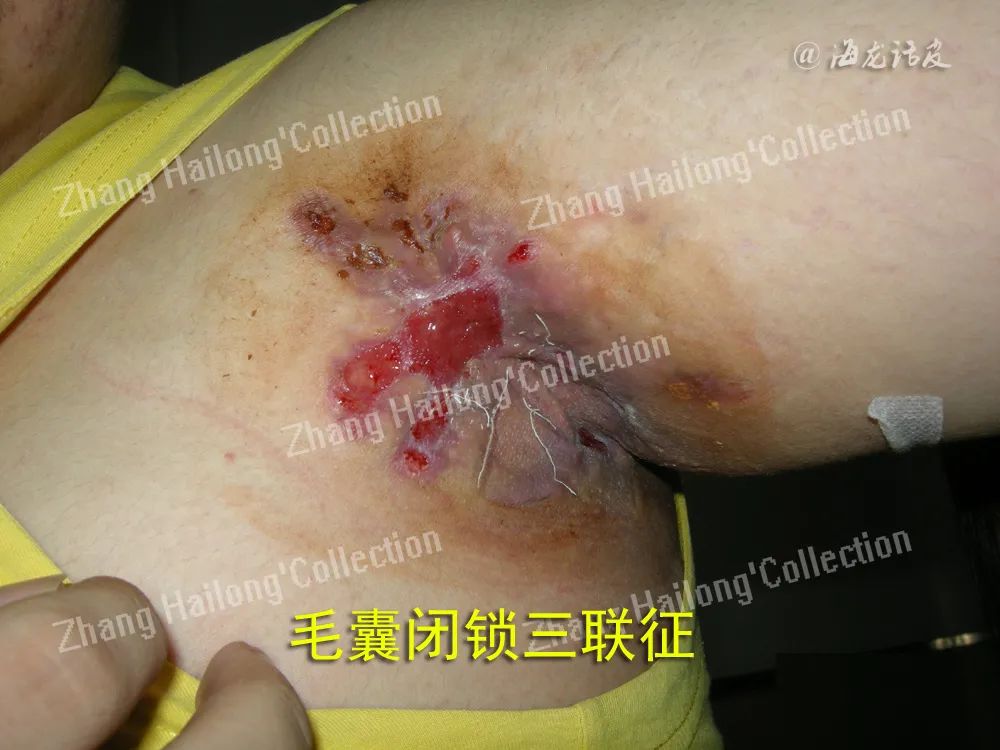
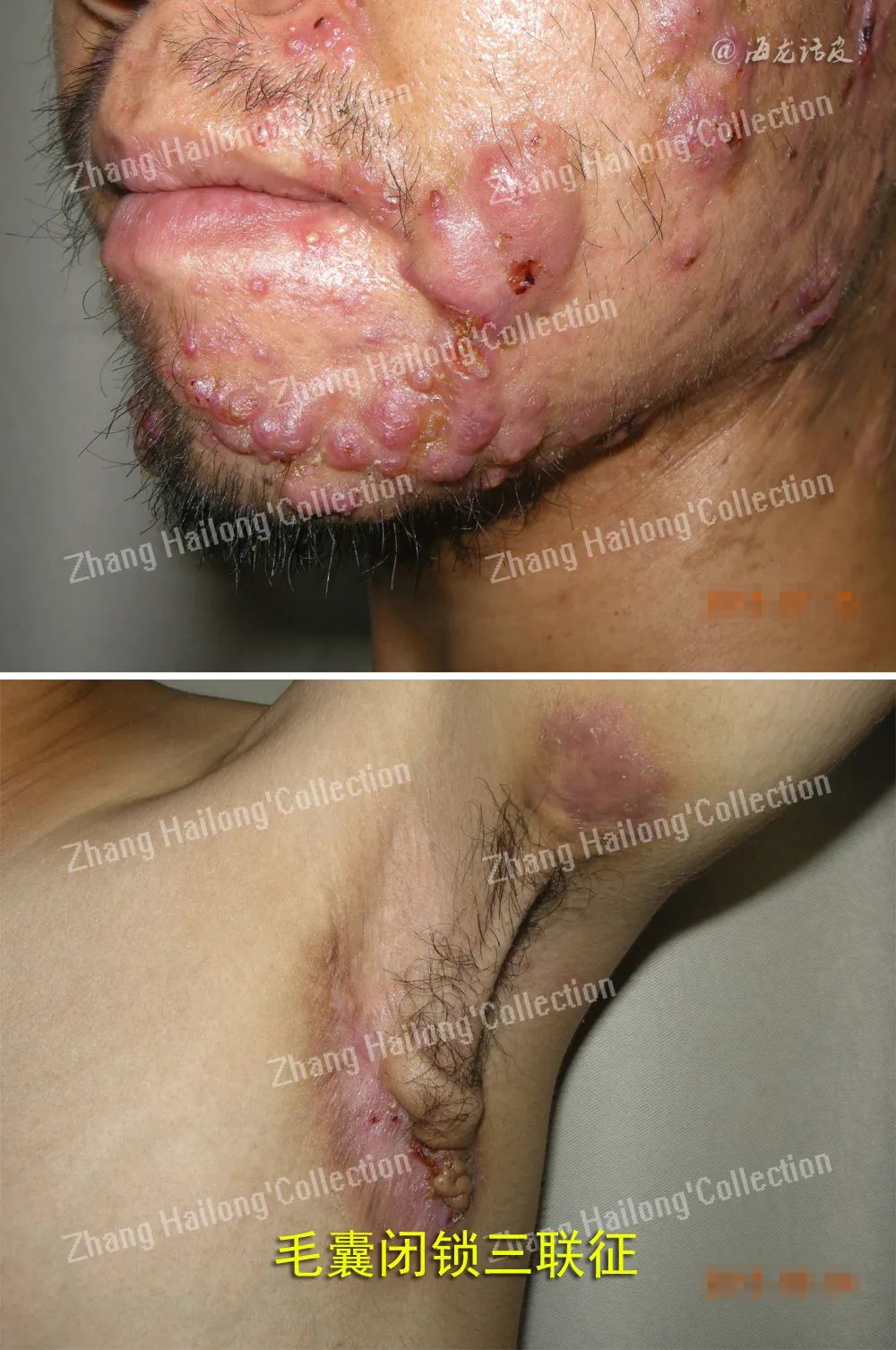
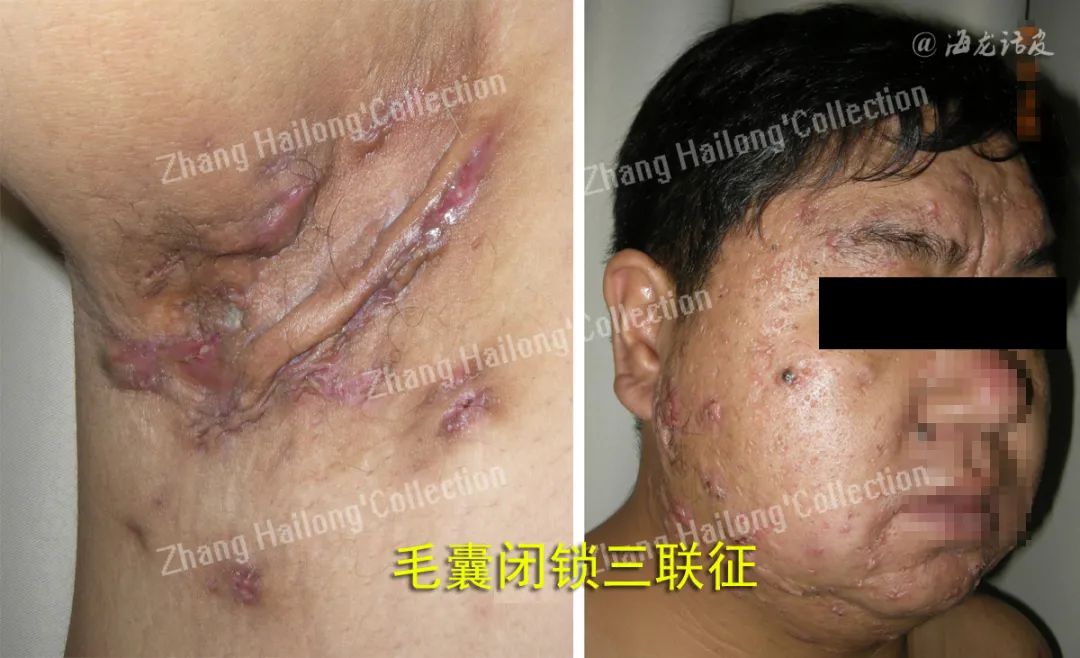
反常性痤疮(acne inversa,AI)又称化脓性汗腺炎(hidradenitis suppurativa,HS),是一种反复发作的慢性炎症性皮肤病,患病率小于1%,严重影响患者生活质量。AI的病因和发病机制尚未明确,目前认为遗传、免疫、炎症以及肥胖、吸烟等因素均与发病及病情加重相关。
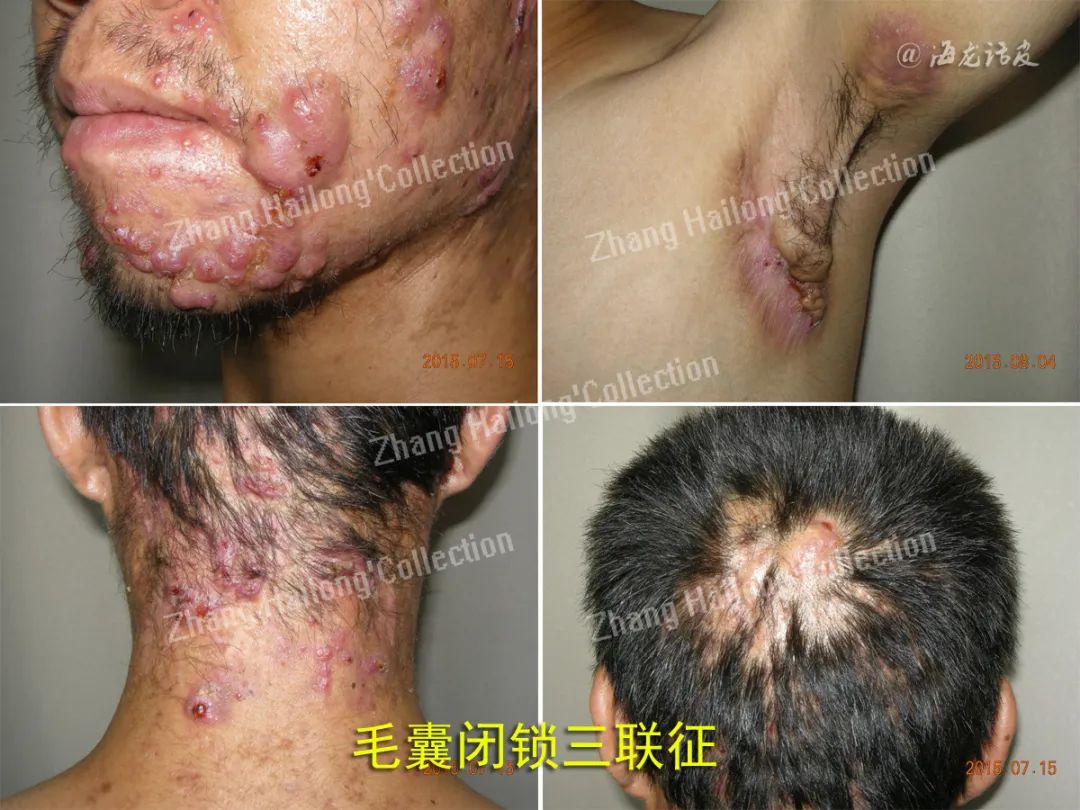
临床上常以Hurley分级用于评估病情严重程度,动态评估治疗反应时多采用反常性痤疮临床反应(Hidradenitis suppurativa clinical response,HiSCR)。其他方法包括医师整体评估法(physician′s global assessment,PGA)、国际反常性痤疮严重评分系统(international hidradenitis suppurativa severity score system,IHS4)、皮肤病生活 质量指数(dermatology life quality index,DLQI)、改良Sartorius评分量表(modified sartorius score,mSS)等。
本病尚缺乏针对性治疗方法,目前治疗目的仍在于缓解病情、改善患者生活质量。近年来随着对本病发病机制的进一步认识,以及生物制剂的研究进展,生物制剂也成为了顽固性中重度AI患者 的治疗选择。目前正式批准用于治疗AI的生物制剂非常有限,仍需开展更多研究以探究生物制剂在治疗AI中的疗效、安全性及适当的剂量。
TNF⁃α抑制剂
阿达木单抗(adalimumab):是靶向TNF⁃α的全人源单克隆抗体,是目前唯一经美国食品药品监督管理局(FDA)批准用于治疗AI的生物制剂。常用剂量为第0天160mg,第15天80mg,第29天起40mg/周皮下注射。两个多中心Ⅲ期临床试验评估了阿达木单抗对中重度AI患者的疗效,试验组分别有41.8%及58.9%的患者在第12周时到达HiSCR,即与基线相比,脓肿和炎性结节总数至少减少50%,且脓肿和瘘道数量没有增加,而安慰剂组仅为26.0%及27.6%,与治疗前相比患者的疼痛评分及mSS评分明显改善,脓肿、炎性结节数量明显减少,DLQI评分显著改善,两组的安全性无显著差异,无严重不良反应事件。
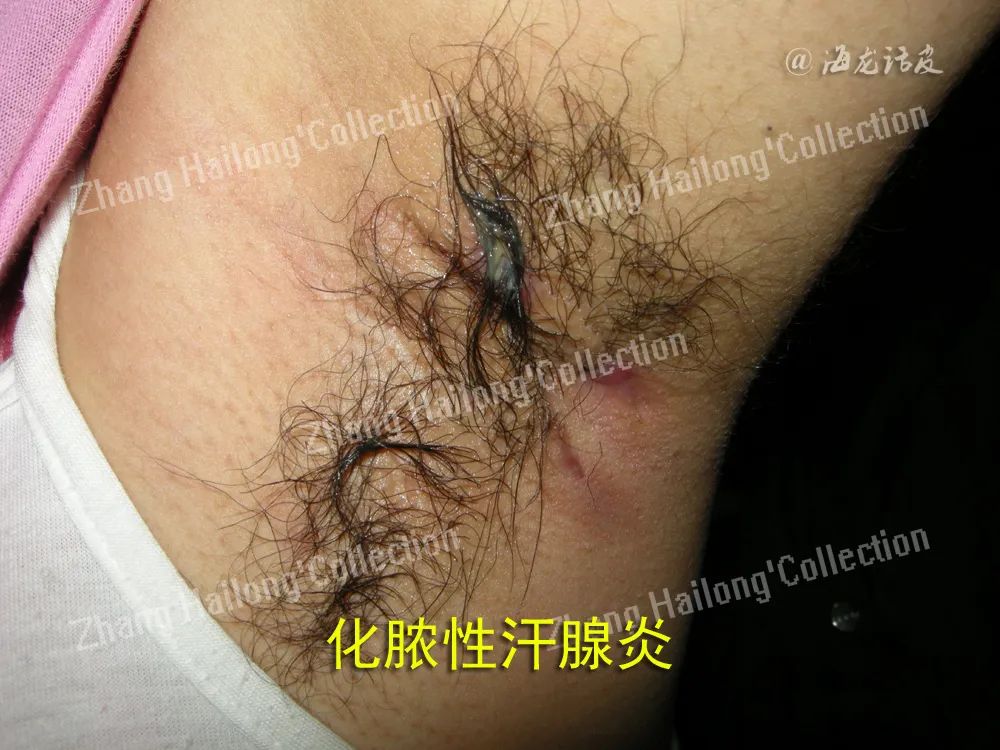
英夫利西单抗(infliximab):是靶向于TNF⁃α的人鼠嵌合单克隆抗体。目前虽未被正式批准用于AI治疗,但已在临床研究中证实有效。常用剂量为第0、2、6周5mg/kg诱导治疗,之后每8周5mg/kg维持治疗(静脉滴注)。一项治疗中重度AI的开放性Ⅱ期临床试验中,与安慰剂组相比 ,试 验组化脓性汗腺炎严重程度指数(hidradenitis suppurativa severity index,HSSI)改善达到50%的人数比例更高,但未达到显著性差异,以DLQI、VAS及PGA评分作为次要终点时观察到试验组较安慰剂组显著改善,其中5例持续随访52周,在22周时仍有效。
依那西普:有小样本临床观察报道了依那西普可降低AI患者疾病活动程度、提高患者DLQI。但多项Ⅱ期临床研究长期随访发现,依那西普治疗中重度AI的疗效与安慰剂相比未见明显优势。
IL⁃12/IL⁃23单抗
乌司奴单抗(ustekinumab)是靶向作用于IL⁃12及IL⁃23的全人源单克隆抗体。一项开放性研究中,17例AI分别在第0、4、16、28d接受45mg或90mg(体重>100kg患者)乌司奴单抗治疗,8例在第40周时脓肿及炎性皮损数量减少50%,6例在40周时mSS评分改善超过50%。不良反应与治疗银屑病的报道相似,主要为上呼吸道感染及头痛。
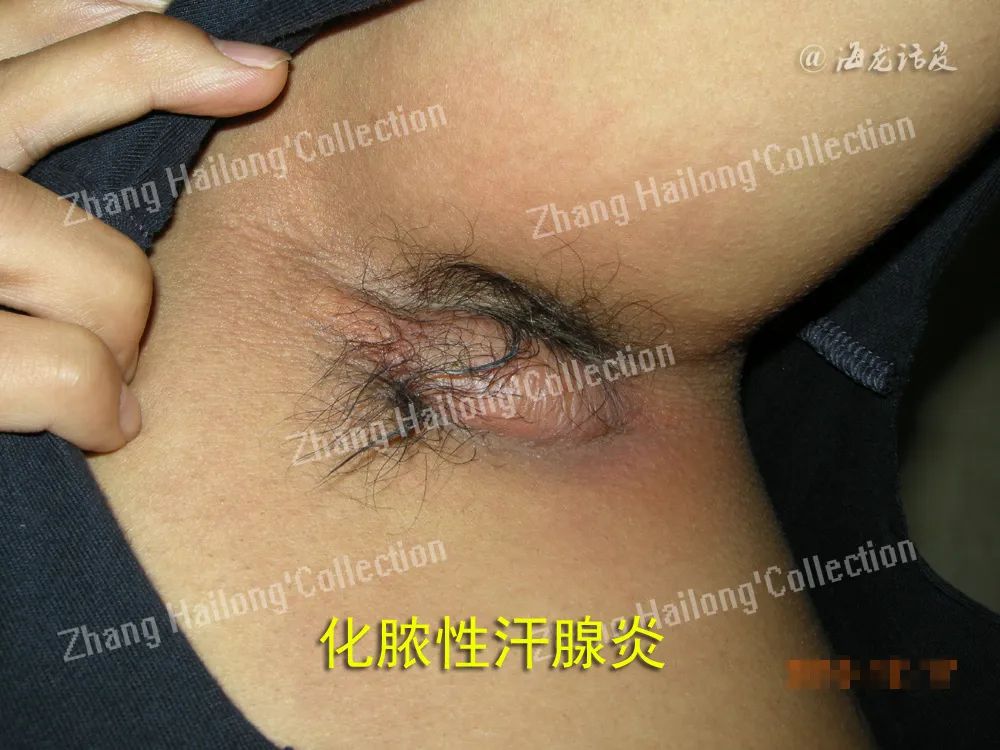
IL⁃23单抗
guselkumab是靶向作用于IL⁃23的全人源单克隆抗体,Kovacs和Podda报道3例重度AI使用了与治疗银屑病相同剂量的guselkumab后IHS4评分显著改善,无明显不良反应。一项回顾性研究观察了8例中重度AI,分别在第0、4周给药100mg,之后每8周给药1次,后续随访中5例AI病情改善。
IL⁃1抑制剂
阿那白滞素(anakinra):是一种细胞表面的受体拮抗蛋白,为重组的IL⁃1受体拮抗剂。一项开放性研究中,6例中重度AI接受皮下注射阿那白滞素100mg/d共8周,完成治疗的5例mSS评分明显降低,未出现严重不良反应,但在第16周时所有患者的mSS评分均恢复至基线。另外一项随机双盲安慰剂对照试验中,9例AI患者接受阿那白滞素治疗12周,7例患者在第12周时达到HiSCR。随后随访24周,其间1例患者病情复发,但出现复发的时间比安慰剂组晚。
bermekimab:是一种全人源IL⁃1α单克隆抗体,目前尚未被FDA批准用于治疗任何疾病。一项随机安慰剂对照试验观察了20例中重度AI,每2周给药7.5mg/kg共12周。试验组6例达到HiSCR,安慰剂组仅1例在末次治疗结束后随访12周,与安慰剂组相比试验组仍然维持有效,未发现与药物相关的严重不良反应。目前仍有正在进行的Ⅱ期临床试验(NCT03512275、NCT04019041)。
IL⁃17抑制剂
苏金单抗(secukinumab)是一种全人源IL⁃17A 单克隆抗体。一项为期24周的开放性试验中,9例中重度AI在起初5周内每周给药300mg,之后每4周给药1次,共24周。第24周时6例AI达到HiSCR,常见的不良反应为上呼吸道感染。一些病例报道采用与治疗斑块状银屑病相似的剂量治疗AI,结果提示用药8周甚至1年时均有效。目前仍有正在进行的Ⅰ期及Ⅲ期临床试验(NCT03099980、 NCT03713632、NCT03713619)。
其他生物制剂
近年来陆续出现了一些新型生物制剂用于治疗AI,如作用于IL⁃17通路的bimekizumab,一项Ⅱ期临床试验(NCT03248531)已完成,结果尚未公布。另一个靶向于IL⁃17的生物制剂CJM112已经完成Ⅱ期临床试验 (NCT02421172),结果尚未发表。靶向作用于补体C5a的IFX⁃1也正在进行治疗AI的临床研究。一项开放性Ⅱ期临床研究观察了12例HurleyⅢ级的AI使用IFX⁃1治疗,第50天时9例AI、第134天时10例AI达到HiSCR。还有一项IFX⁃1的Ⅱ期临床试验已结束(NCT03487276),结果尚未公布。其他正在开展临床试验的生物制剂包括靶向CD40的单克隆抗体以及粒细胞集落刺激因子(G⁃CSF)抗体等以上生物制剂的进展值得关注。
结语
FDA已经批准阿达木单抗用于中重度AI患者的治疗,目前的研究数据显示,阿达木单抗也是目前对于AI患者疗效最为可靠且安全的生物制剂,其对病情的控制以及在AI维持治疗方面都较其他药物有明显的优越性。其他生物制剂如英夫利西单抗、阿那白滞素等药物虽对AI的治疗显示出一定疗效,但因报告病例数较少或治疗后期复发率较高,使其在临床应用中面临挑战。乌司奴单抗及苏金单抗在对AI患者的使用中借鉴了银屑病的治疗剂量,取得一定成效,但仍需更多的临床试验确定其治疗AI的最佳方案。
从最新研究的生物制剂来看,补体C5a抑制剂在分子试验结果和目前的小样本临床试验结果中都提示对AI患者可能有 潜在的应用前景,但因目前研究样本量过小,尚缺乏说服力。未来仍需更多设计严谨、更有说服力的大样本临床研究来验证这些生物制剂在AI 治疗中长期应用的有效性及安全性。
参考文献:
[1]苑辰,闫言,王宝玺.反常性痤疮的生物治疗进展[J].中华皮肤科杂志,2023,56(3):270-273.
[2]中国反常性痤疮/化脓性汗腺炎诊疗专家共识制订小组. 中国反常性痤疮/化脓性汗腺炎诊疗专家共识(2021版)[J]. 中华皮肤科杂志, 2021,54(2):97⁃104.
[3]Ingram JR, Jenkins⁃Jones S, Knipe DW, et al. Population⁃based clinical practice research datalink study using algorithm modelling to identify the true burden of hidradenitis suppurativa[J]. Br J Dermatol, 2018,178(4):917⁃924.
[4]其他文献略。


