读书报告 | 肿瘤骨转移的机制
时间:2023-10-20 17:49:18 热度:37.1℃ 作者:网络
导读
肿瘤微环境(TME)内细胞及其分泌的分子在癌症发病机制中起着至关重要的作用,因此是热门的治疗靶点。在综述“The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth”一文中,作者详细复习了肿瘤骨转移的机制。
骨骼是与播散性肿瘤细胞(DTC)生物学相关研究最多的器官之一,大部分患者会发生骨转移,特别是乳腺癌和前列腺癌。骨微环境包括组织固有的成骨细胞、破骨细胞和骨细胞,以及脂肪细胞、丰富的血管系统和免疫细胞,以及丰富的骨髓和细胞外基质。骨内膜微环境促进播散性肿瘤细胞(DTC)和骨固有细胞之间的双向相互作用,最终促进疾病进展。另外,癌细胞可诱导成骨细胞和破骨细胞分泌RANKL、IL-6、IGF和基质降解酶等因子,促进肿瘤的转移性生长和骨质溶解。骨微环境中的成骨细胞衍生的细胞因子可以通过EZH2依赖性方式、表观遗传调控促进乳腺癌或前列腺癌DTC的干性,增强其在多器官之间的转移扩散。骨微环境可以表观遗传调节DTC中的雌激素表达,或促使其进入非增殖的静止状态,从而产生对内分泌、靶向、化疗的耐药性。此外,骨血管周围生态位(PVN)可以通过多种血管粘附分子保护DTC免受化疗的影响。值得关注的是,骨转移病灶可能是肿瘤发展的加油站,及时打断骨转移微环境与肿瘤干细胞的相互作用可能有助于延缓疾病进展(Cancer Cell.2023 Mar 13;41(3):374-403. doi: 10.1016/j.ccell .2023.02.016)。
背景
肿瘤微环境(TME)是指肿瘤细胞产生和生存的内部环境,包括丰富多样的免疫细胞、癌细胞、癌相关成纤维细胞、内皮细胞、周细胞以及其他因组织而异的细胞类型,如脂肪细胞和神经元。
TME内细胞及其分泌的分子在癌症发病机制中起着至关重要的作用,因此是热门的治疗靶点。TME的细胞组成和功能状态因肿瘤发生的器官、癌细胞的内在特征、肿瘤分期和患者特征而不同,肿瘤抑制性的,也可以是肿瘤支持性的。
骨骼是与播散性肿瘤细胞(DTC)生物学相关研究最多的器官之一。大部分患者会发生在骨的微转移,特别是乳腺癌和前列腺癌。骨微环境包括组织固有的成骨细胞、破骨细胞和骨细胞,以及脂肪细胞、丰富的血管系统和免疫细胞,以及丰富的骨髓和细胞外基质。

Figure 1. 原发性肿瘤进展和转移的微环境调控
肿瘤微环境(TME)在癌症进展的所有阶段被描绘与关键的代表细胞类型显示。TME 包括多种免疫细胞、癌相关成纤维细胞(CAFs)、内皮细胞和细胞外基质(ECM)等。这些成分可能因组织类型而异,并随着肿瘤的进展而共同进化。正常的组织微环境可以通过抑制免疫细胞、成纤维细胞和外基质的功能抑制肿瘤的生长。然而,肿瘤要向前发展,必须避开这些功能,转而影响TME中的细胞成为肿瘤促进细胞,导致原发部位增殖、侵袭和体内注入的增加。TME的细胞和因子在准备转移前生态位、调节肿瘤细胞在循环中的生存、促进外溢出等方面也发挥着重要作用。在转移阶段TME有助于控制转移细胞的休眠,从这种状态出现,以及随后的转移分枝。
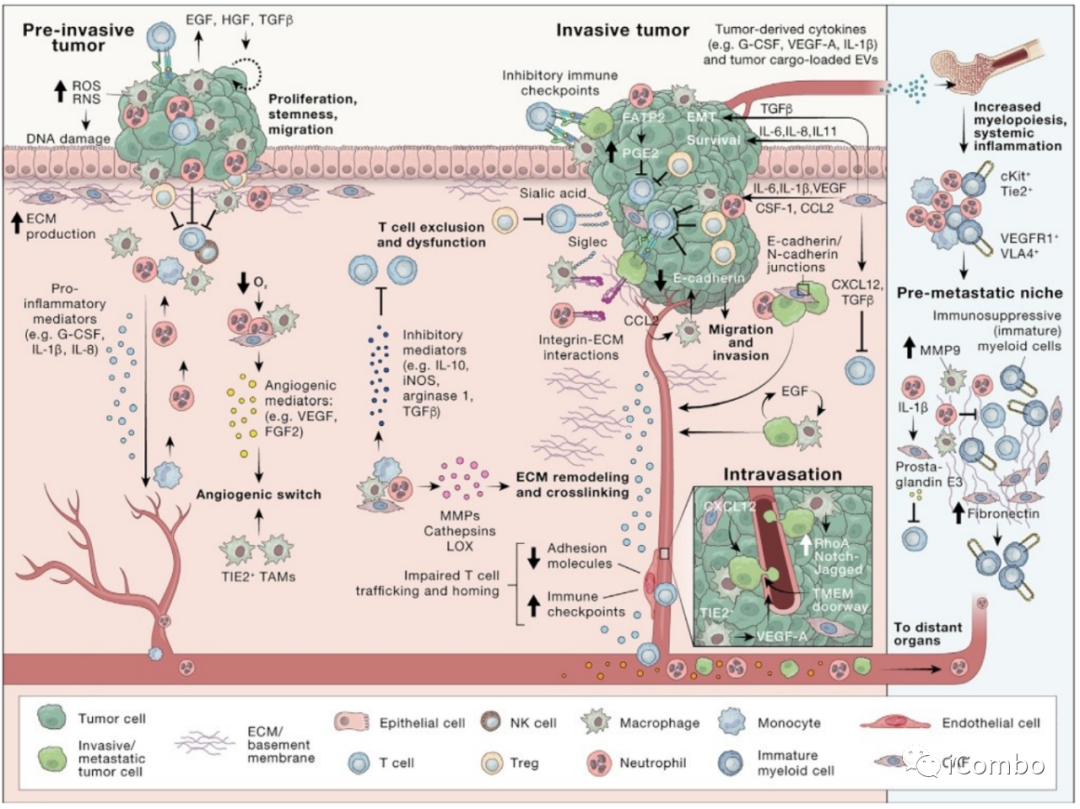
Figure 2. 原发肿瘤进展与TME内复杂的相互作用
原发肿瘤生态位由多种间质细胞和免疫细胞支持。在肿瘤开始的早期阶段,癌细胞可能成为免疫系统破坏的目标。成纤维细胞和巨噬细胞最初也可以帮助抑制肿瘤生长,但它们可能最终会受到癌症发展的影响,获得促肿瘤功能。
例如,肿瘤相关的巨噬细胞(TAMs)可以通过分泌生长因子、细胞因子和蛋白酶来支持血管生成和侵袭。CAFs 可以被激活,分泌 ECM 蛋白和血管生成因子,包括 VEGF-A,从而进一步促进了复杂交织的初级 TME。在静脉滴注过程中,巨噬细胞定位于血管周围龛位,在那里,它们可以帮助癌细胞通过 TMEM 门穿过血管屏障。
Bone metastasis
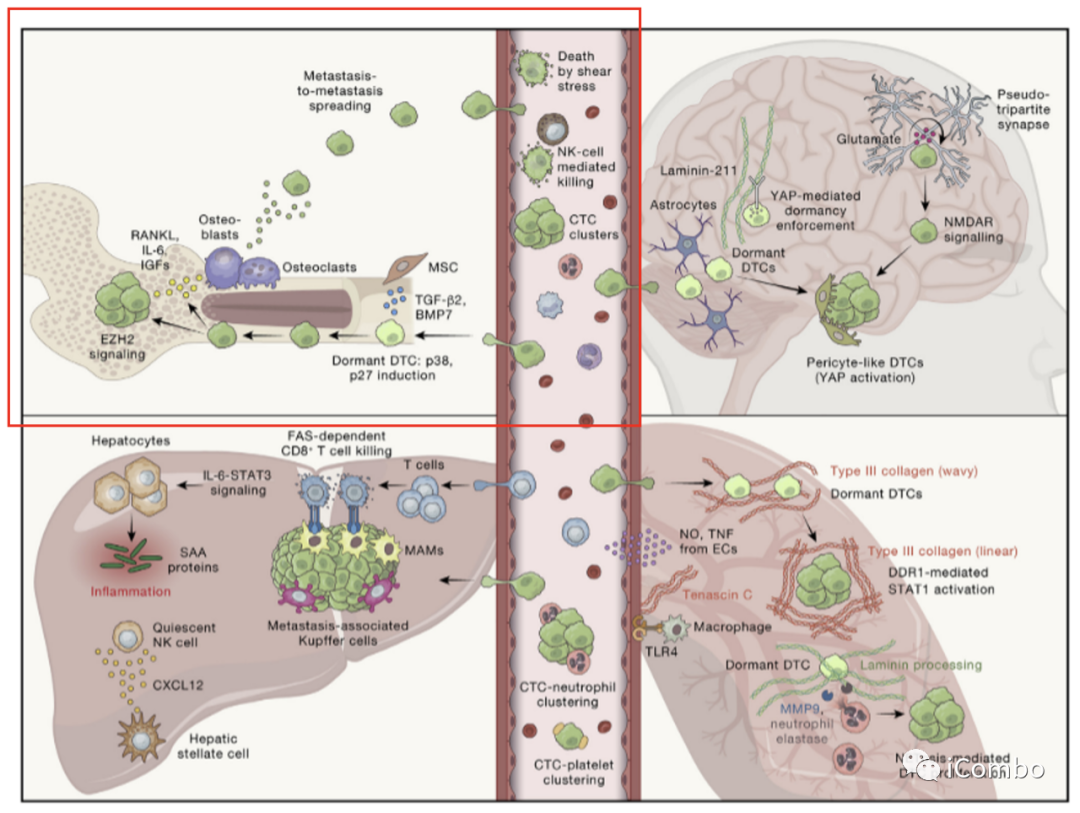
Figure 3.不同组织环境下转移细胞的调控
循环中转移细胞的命运可以被认为是不同类型免疫细胞之间的“战斗”,如图中间所示,中性粒细胞和血小板促进循环肿瘤细胞(CTC)的生存,而自然杀伤细胞(NK)等适应性免疫细胞可以消灭 CTC。
一旦癌细胞外溢到次生组织,微环境必须允许其定植和扩张,以发展明显的疾病。参与调节这一过程的 TME 细胞类型包括间充质干细胞(MSCs)和转移相关巨噬细胞(MAMs)。
这里显示了四个主要的器官,骨、脑、肝和肺,它们共享并具有组织特异性的机制来控制播散性肿瘤细胞(dtc)的命运。
-
骨微环境包括组织常驻成骨细胞、破骨细胞和骨细胞,以及脂肪细胞、丰富的血管细胞、免疫细胞、丰富的骨髓和细胞外基质(ECM)。这导致了动态相互作用,在稳态下调节造血干细胞(HSC)的发育,但最终可能被纳入伴随骨破坏和骨折的骨转移的“恶性循环”中。
-
在播散性肿瘤细胞DTC定植的早期阶段,这些细胞可以占据骨中的不同壁龛,大多数DTC位于骨髓中,通常在诊断出明显转移之前很久。
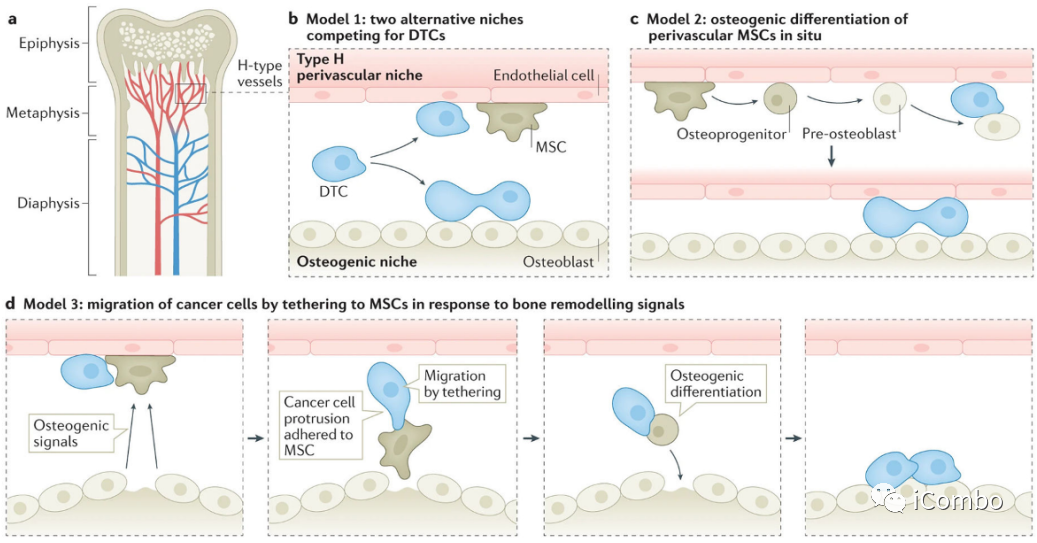
Satcher, R.L., and Zhang, X.H.F. (2022). Evolving cancer-niche interactions and therapeutic targets during bone metastasis. Nat. Rev. Cancer 22, 85–101.
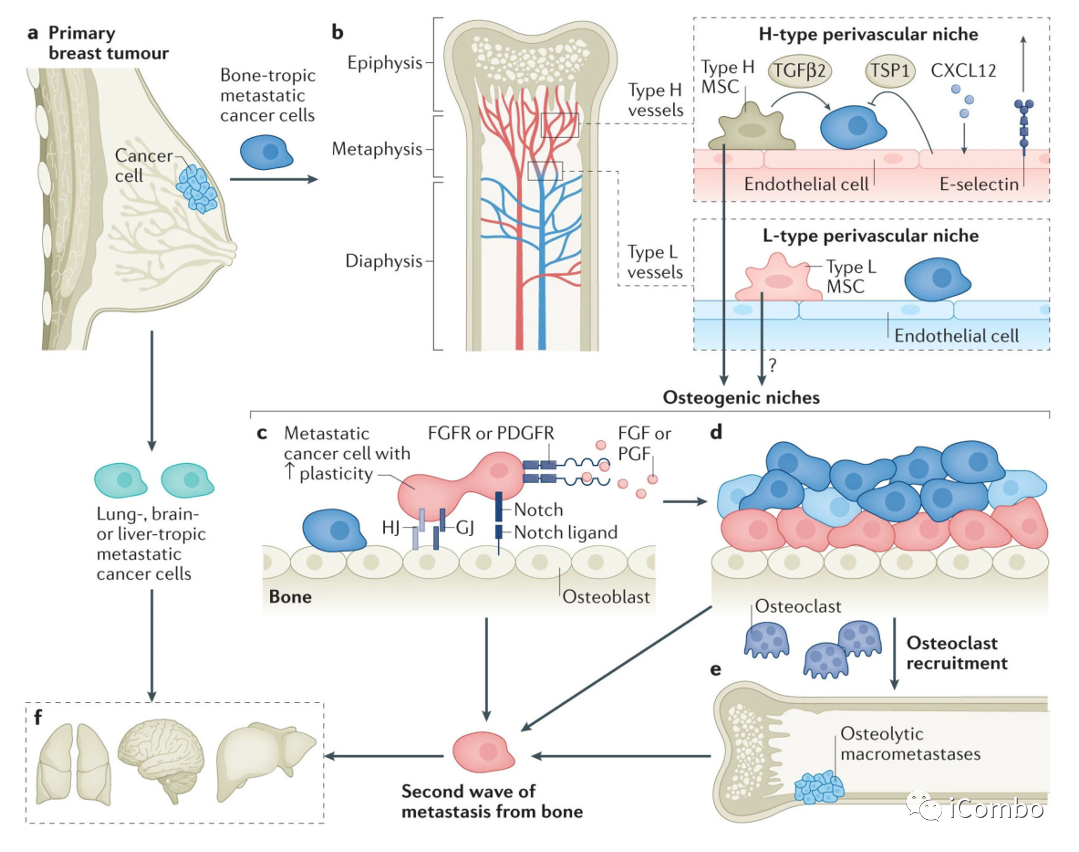
DTC向骨转移及其他方向发展的历程。
a.转移性器官亲和性可能由遗传性状编码,并通过各种机制出现在原发肿瘤中。
b.血管DTC提供第一个立足点。骨髓中的血管系统是高度不均匀的。最值得注意的是,毛细血管可以分为连接小动脉的h型和连接静脉的l型。h型和l型血管可能代表不同的壁龛,内皮细胞和血管周围细胞彼此不同。血管周围间充质细胞产生的TGF-β2和内皮细胞产生的TSP1可能介导癌细胞的细胞静止。CXCL12和E-selectin之间的相互作用也可能决定癌细胞相对于生态位的命运和定位。血管周围间充质细胞具有间充质干细胞(MSC)活性,可能有助于成骨。
c.成骨生态位通过多种机制促进DTC向微转移的进展,包括异型粘附连接(hAJs)、间隙连接(GJs)和Notch信号的直接相互作用。成骨细胞也可能分泌激活整合素信号的TSC。此外,骨微环境产生的FGF2和PDGF-DD的旁分泌信号增强了癌细胞的表型可塑性。
d.随着微转移瘤的生长,留在成骨细胞附近的癌细胞可能保持其可塑性,而那些被推开的癌细胞可能恢复到更分化的状态。
e.破骨细胞的募集和激活启动恶性循环,并推动溶骨性大转移的进展。
这是引起症状并导致临床诊断的阶段。
研究1
在骨髓(BM)微环境中,乳腺癌(BC)弥散性肿瘤细胞(DTC)可以保持休眠数十年,NG2+/Nestin+间充质干细胞(MSCs)促进造血干细胞的休眠。研究发现动脉周围BM驻留的NG2+/Nestin+ MSCs也可以指示BC-DTC进入休眠。NG2+/Nestin+ MSCs产生TGF-β2和BMP7,激活依赖于TGFBRIII和BMPRII的静止通路,通过p38激酶信号传导和p27诱导激活dtc的静止通路。使用NG2-CreER驱动的MSCs基因缺失或MSCs中TGF-β2的条件敲除导致休眠的p27+/Ki67- dtc的骨转移产物生长。无全身复发的ER+ BC患者BM中TGF-β2和BMP7的检测频率更高。该研究结果提供了HSC休眠生态位控制BC-DTC休眠的直接证据,并提示衰老或影响NG2+/ Nestin+ MSC生态位稳态的外部因素可能导致休眠中断和BC骨复发。
Nobre, A.R., Risson, E., Singh, D.K., Di Martino, J.S., Cheung, J.F.Wang, J., Johnson, J.,Russnes, H.G., Bravo-Cordero, J.J., Birbrair, A.,et al. (2021). Bone marrow NG2(+)/Nestin(+) mesenchymal stem cells drive DTC dormancy via TGFbeta2. Nat. Cancer 2, 327–339. h
研究2
通过多种方法,证明了骨微环境促进乳腺癌和前列腺癌细胞进一步转移并建立多器官继发性转移。研究发现促进转移的作用是由表观遗传重编程驱动的,这种重编程赋予骨病变播散的癌细胞干细胞样特性。此外,研究发现EZH2活性的增强介导了细胞干性和转移能力的增加。

Zhang, W., Bado, I.L., Hu, J., Wan, Y.W., Wu, L., Wang, H., Gao, Y., Jeong, H.H., Xu, Z., Hao, X., et al. (2021). The bone microenvironment invigorates metastatic seeds for further dissemination. Cell 184, 2471– 2486.e20.
这项研究中证明了骨微环境不仅允许癌细胞进一步扩散,而且似乎增强了这一过程。仍然存在的一个关键问题是继发性转移从初始骨病变扩散的时间:这是发生在骨病变出现症状和临床可检测之前还是之后。答案将分别决定是否应在辅助或转移情况下实施治疗干预措施。研究发现在诊断现有病变之前可能会发生进一步的转移。
本研究表明,EZH2活性的增强为肿瘤细胞在骨微环境中进一步转移的表观遗传重编程提供了基础。EZH2通过抑制谱系特异性转录程序维持乳腺癌细胞的去分化和干细胞样状态在临床前模型中,药理学或遗传学上靶向EZH2可抑制肿瘤生长、治疗耐药和转移。该研究中EZH2抑制剂在体外或原发注射部位不能抑制细胞生长,而EZH2抑制剂的短暂处理或诱导性敲低EZH2在癌细胞中均可显著减少继发性转移,这表明靶向EZH2可能阻断转移扩散而不是肿瘤生长。
研究3
成骨生态位通过EZH2介导的表观基因组重编程增强转移性ER+乳腺癌细胞的表型可塑性。内质网表达的时空异质性导致干性和内分泌抗性增加。靶向EZH2可恢复内分泌敏感性,并与标准的抗ER治疗协同作用。
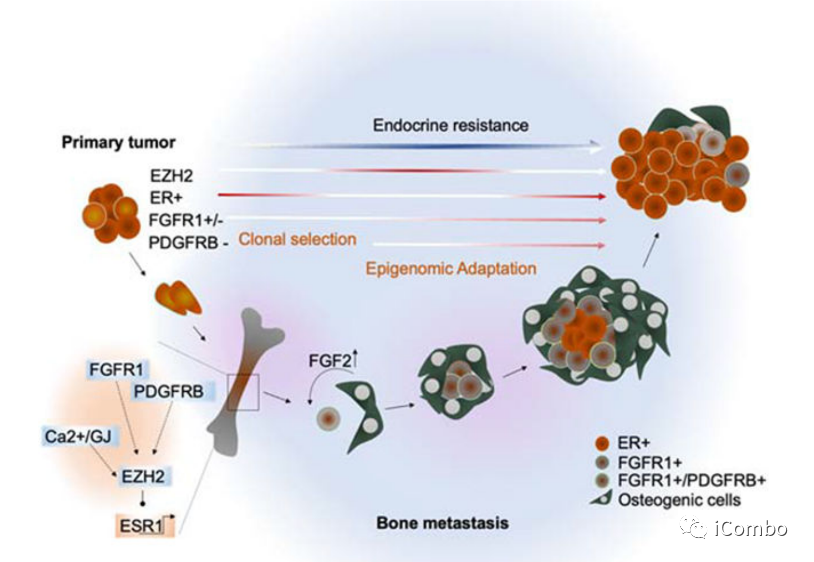
Bado, I.L., Zhang, W., Hu, J., Xu, Z., Wang, H., Sarkar, P., Li, L., Wan, Y.W., Liu, J., Wu, W., et al. (2021). The bone microenvironment increases phenotypic plasticity of ER(+) breast cancer cells. Dev. Cell 56, 1100– 1117.e9. h
研究4
成骨细胞和破骨细胞可被癌细胞诱导分泌包括RANKL、IL-6、IGFs和基质降解酶在内的因子,这些因子共同促进转移生长、骨溶解和骨骼变化,这些变化是晚期骨转移临床表现的基础。
最近的临床前研究发现,骨血管周围生态位(PVN)可以通过包括整合素b1、avb3和VCAM-1在内的血管粘附分子,独立于细胞周期状态,保护DTC免受化疗的影响。因此,阻断PVN和DTC之间整合素介导的相互作用使这些细胞对化疗变得敏感,并显著提高了生存率。
Carlson, P., Dasgupta, A., Grzelak, C.A., Kim, J., Barrett, A., Coleman, I.M., Shor, R.E.,Goddard, E.T., Dai, J., Schweitzer, E.M., et al. (2019). Targeting the perivascular niche sensitizes disseminated tumour cells ll Cancer Cell 41, March 13, 2023 401 Review to chemotherapy. Nat. Cell Biol. 21, 238–250. h
骨转移的新治疗靶点
-
a)癌细胞与血管周围生态位细胞(包括内皮细胞和周细胞)之间的分子串扰。
-
b)破骨细胞祖细胞向成熟破骨细胞分化的治疗靶点。
-
c)癌细胞和成骨细胞之间的直接细胞间相互作用和旁分泌。
-
d)骨转移过程中介导癌细胞与细胞外基质相互作用的整合素通路。
-
虚线圈表示恶性循环的范式,包括癌细胞分泌PTH和PTHrP激活成骨细胞,成骨细胞分泌RANKL驱动破骨细胞分化,骨吸收时从骨基质释放TGFβ和IGF1,相互促进癌细胞进展。
小结
骨微环境可能参与于骨转移伴随骨破坏和骨折的“恶性循环”:
-
骨内膜微环境促进播散性肿瘤细胞(DTC)和骨固有细胞之间的双向相互作用,可能最终促进疾病进展。
-
癌细胞可诱导成骨细胞和破骨细胞分泌包括RANKL、IL-6、IGF和基质降解酶在内的因子,促进转移性生长、骨质溶解和骨骼变化。
-
骨微环境中的成骨细胞衍生的细胞因子可以通过EZH2依赖性方式、表观遗传调控促进乳腺或前列腺DTC的干性,增强多器官间的转移扩散。
-
骨微环境可以表观遗传地调节DTC中的雌激素表达,或进入不增殖的静止状态,从而获得对内分泌疗法、靶向疗法/全身化疗的耐药性。此外,骨血管周围生态位(PVN)可以通过多种血管粘附分子保护DTC免受化疗的影响。


