Nature子刊:从进化角度探索癌症治愈的决定因素
时间:2023-10-08 11:18:50 热度:37.1℃ 作者:网络
癌症对于大多数人来说都不是陌生的话题,全球数据预测人一生中发生癌症的风险约为20% (IARC)。随着癌症筛查的普及、治疗手段的进步,许多癌症的治愈率大大提高,然而对于一些晚期癌症,我们仍然缺乏良策。究竟是什么因素决定了癌症的治愈率?
近期,英国伦敦癌症研究所 Mel Greaves 及美国犹他大学 Joshua D. Schiffman 等研究者在 Nature Ecology & Evolution 发表题为 Evolutionary determinants of curability in cancer 的观点论述。他们认为不同癌症的发展起源和随后的生态制约因素共同决定了肿瘤克隆的形成、进化及药物敏感性,最终影响治愈率。从可以被成功治愈的癌症特征入手,或许可以找到应对难治性癌症的新思路。

耐药是癌症进化的必然趋势
大多数癌症起源于突变的单个细胞,子代细胞在复杂的组织生态环境系统中经历演进,逐渐形成独特的基因型和表型。癌症治疗的效果、最终是否会出现耐药,很大程度取决于癌症确诊是发生在演进过程中的什么阶段。虽然很多早期癌症可以通过手术或局部放疗达到治愈,但是确诊时已是晚期的癌症(特别是肺癌、卵巢癌、胰腺癌)往往是治疗的“老大难”。
尽管联合用药一定程度上可以延长患者寿命,但是IV期癌症患者治愈的希望仍然渺茫,问题并非是缺乏有效的靶向药物,而是肿瘤耐药似乎难以避免。治疗初期肿瘤可能明显缩小,然而随后就会出现侵袭性更强的耐药癌细胞。即使是在很多晚期癌症中大放异彩的免疫疗法,也不得不面对耐药的问题,比如,肺癌通过人类白细胞抗原缺失(HLA loss)得以成功逃脱免疫监视。
耐药性是癌细胞在系统治疗过程中发生的适应性进化,抗癌治疗对于药物耐受性高的癌细胞起到了正向选择的作用,这一点和抗生素耐药的发生机制类似。这种优胜劣汰的策略遵循的是古老的进化原则,经历抗癌药物威胁的癌细胞也正是启用了这种自我保护机制,再加上真核细胞本身就具有的复杂信号通路、表观遗传可塑性,癌细胞生存能力不能强化似乎在所难免。换句话说,肿瘤学家试图寻找治疗策略的关键,是如何破坏细胞在20多亿年进化过程中习得的生存本能。
决定癌症“可治愈性”的生物学因素是什么?
不可否认,有一小部分癌症虽然高度恶性、甚至确诊时已经发生转移,但仍能够被化疗有效地治愈,比如儿童前体B细胞急性淋巴细胞白血病、睾丸精原细胞瘤、绒毛膜癌、儿童Wilms瘤的常见亚型等。当然,特定肿瘤的治愈率可能随着治疗方案的优化得到改善,然而即使在联合疗法不断进步的今天,仍然存在一些总是发生耐药或转移、难以被攻克的癌症,可见癌症的“可治愈性”背后存在生物学机制。
针对这个问题,原文作者提出了图1所示的科学假设。这个假设的前提是进化过程中癌细胞的特性(内在特性或进化中习得特性)与周围微环境、适应性景观的相互作用,共同决定了抗癌治疗后肿瘤克隆的不同“命运”。
在这个假设中,“可治愈性”和难治性癌症的第一个区别在于发育起源的不同:可治愈的癌症往往起源于胚胎或胎儿组织中,细胞遵循TP53-依赖凋亡,癌细胞对抗癌药物高度敏感;而难治性癌症(比如常见的成人癌症)主要生发于成熟组织的复制上皮细胞中。第二个区别体现在癌细胞的生存经历:难治性癌症在经历了缺氧等微环境造成的生存瓶颈之后,发展出特殊技能(TP53功能失活),逐渐进化为突变多样、干细胞占比高的耐药克隆,而“可治愈性”癌症则成功绕过了这些生存瓶颈,仍停留在进化程度较低的幼稚阶段,保留了对抗癌药物的敏感性。
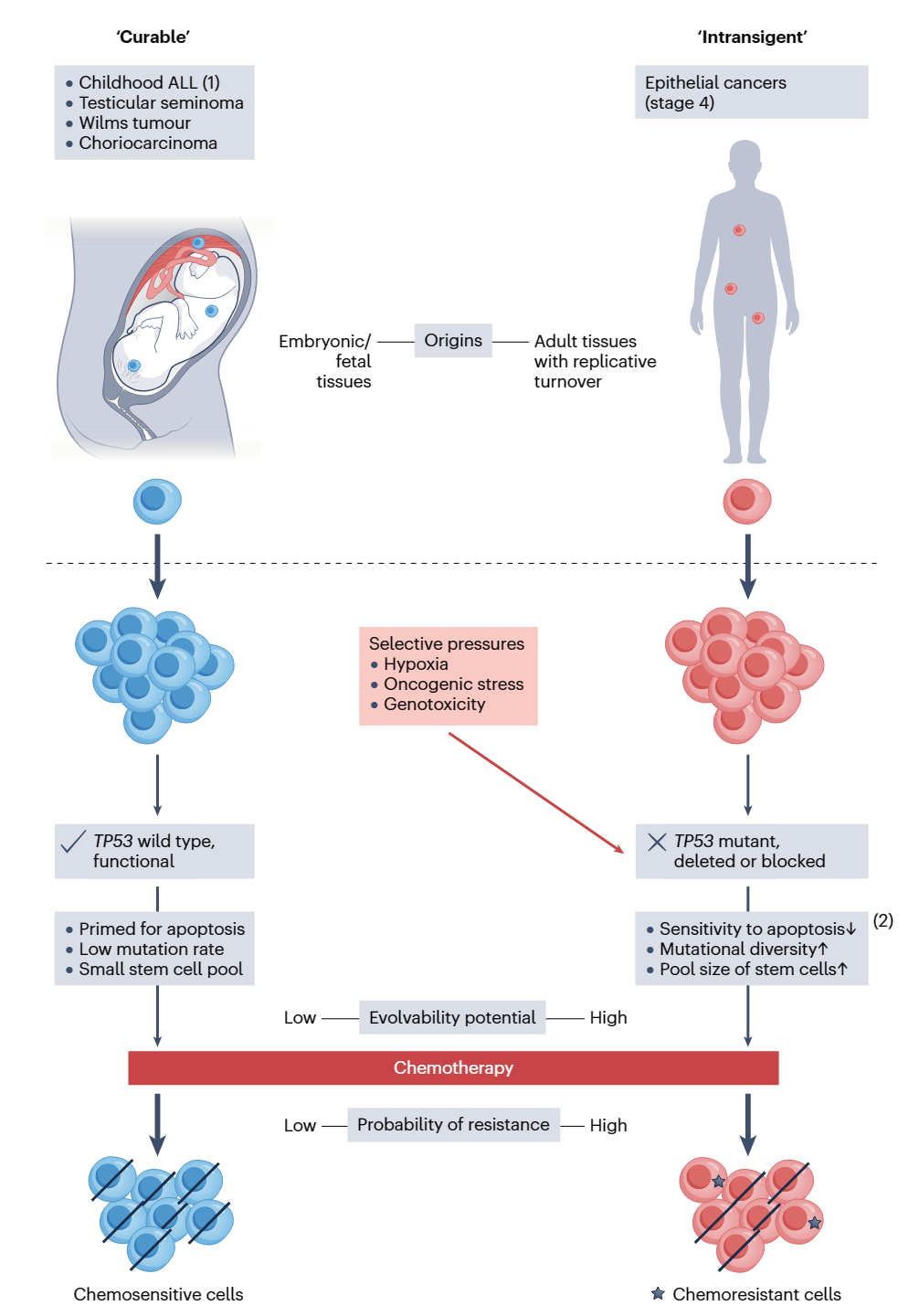
图1. “可治愈性”或难治性癌症的生物学决定因素模型。注:(1)儿童急性淋巴细胞白血病是一种异质性很强的疾病,是前体B细胞急性淋巴细胞白血病中治愈率很高的一种亚型;其他亚型的预后相对较差。同样,Wilms瘤中相对常见的亚型预后较好。此外,睾丸精原细胞瘤的高治愈率并不适用于所有男性生殖细胞癌症。(2)缺氧条件下选择出的TP53突变提高了克隆的多种适应能力,其中最主要的是细胞存活力增加。
难治性癌症是如何炼成的?
TP53蛋白作为细胞应激的关键传感器,当细胞应激或出现DNA损伤时,它能够及时地按下细胞周期的暂停键,启动DNA修复或细胞凋亡程序。不难推测,这位忠实的基因组“守门人”在癌症中不可能毫发无损,大多数预后糟糕的成人或儿童癌症都存在TP53的功能失活,即使TP53本身没有突变,也往往存在TP53通路上其他基因的变异。虽然极少数晚期癌症拥有完好的TP53通路,但“可治愈性”癌症的TP53通路似乎总是完好无损。TP53失活在难治性肿瘤中的高发生率可能是趋同进化的产物,也就是说,不同类型的癌症为了应对普遍的生存压力,找到了适应环境的共同解决方案。
那么究竟是哪些压力选择性地促进了癌细胞TP53失活呢?环境暴露(比如太阳紫外线B、香烟中的致癌物、放疗和部分药物)具有遗传毒性,可以直接改变基因稳定性、诱发复制压力,导致TP53失活。最常见压力则来自于肿瘤微环境中的代谢应激、炎症、免疫压力和缺氧。由于大多数克隆最初都局限于成熟组织中的分区结构之中,随着癌细胞的增殖,势必面临氧气不足的情况。为了应对缺氧危机,肿瘤诱发周围微血管形成,但是这些新生成血管因为粗制滥造,灌注能力很差,根本无法解决燃眉之急。
肿瘤缺氧和TP53突变有什么关系呢?研究发现TP53通路突变总是在缺氧肿瘤中发生富集,这是因为,虽然大多数癌细胞在缺氧的压力下发生了TP53依赖性凋亡,但是有些癌细胞因为偶然发生了TP53突变,不能正常启动TP53依赖性凋亡,得以逃过一劫,并逐渐成为优势克隆。由于TP53依赖性凋亡通路失活,这些幸存下来的突变克隆对于放化疗药物甚至免疫治疗耐受度也变高了。
此外,TP53失活的癌细胞不再能叫停细胞周期,癌基因驱动的细胞增殖扩张也没法被抑制。TP53功能缺失挽救了本该葬生在缺氧环境中的癌细胞,意外地提高了肿瘤的适应性,给抗癌症药物治疗带来很大挑战。更糟糕的是,缺氧的环境模拟了胚胎发育中常见的间充质干细胞微生态,TP53失活的癌细胞还可能为了应对低氧的情况发生转录失调,从而促进上皮间质转化,肿瘤克隆进一步获得自我更新功能和转移能力,使得TP53突变克隆的主导优势更为显著。
“可治愈性”癌症如何走上了不同的道路?
“可治愈性”癌症不仅是TP53野生型,而且在遗传毒性或细胞毒性药物作用下发生TP53性死亡(比如顺铂治疗下的睾丸癌)。这些肿瘤如何能够绕过难治性癌症所要面对的生存瓶颈,仍然达到增殖的目标呢?
首先,“可治愈性”癌症对于TP53依赖性凋亡通路可能存在不同的敏感性。比如,很少分裂的肌肉组织细胞对于TP53依赖性凋亡就很不敏感,上皮细胞(常见成人癌症的起源)比较敏感,而血液细胞、胚胎和胎儿细胞、生殖细胞(“可治愈性”癌症常见起源)最为敏感。这些高敏感细胞往往有很高的TP53表达,且线粒体随时为细胞凋亡做好了预备。从胚胎发育的角度来说,TP53依赖性细胞凋亡是“命运”使然,那些没有收到转移、分化信号的细胞和那些存在DNA损伤的多余细胞都将面临消亡的结局。
在上文中提及的“可治愈性”癌症中都能观察到这种预设的结局。睾丸癌被认为起源于胚胎发育中向生殖腺嵴迁移的原始生殖细胞,这些细胞对于DNA损伤十分敏感,很容易启动凋亡以维持生殖细胞的基因完整性。儿童前体B细胞急性淋巴细胞白血病来源于出生前胎儿肝脏中的祖B细胞,确诊时肿瘤克隆停滞在前体B细胞阶段,而这一阶段TP53依赖性凋亡是细胞的常态。绒毛膜癌起源于胚盘滋养细胞,正常的滋养细胞局限于妊娠期,对于凋亡高度敏感,这也解释了为什么绒毛膜癌对于遗传毒性药物反应良好。Wilms瘤源于迁移、分化的胚胎间充质细胞,确诊时肿瘤克隆仍保留不成熟的表型,这一发育过程也伴随着多余细胞的凋亡。从发育学角度看,这些罕见的“可治愈性”癌症由于保留了对凋亡通路的高度敏感性,从而能够被化疗治愈。
然而这些癌症是如何能够在增殖过程中不用经历缺氧等生存困境的呢?一方面,这些癌症都有丰富的血液供应。在儿童急性淋巴细胞白血病患者的骨髓中,不仅可以观察到弥漫分布的癌细胞,还可以看到广泛的新生血管,强大的促血管生成功能帮助肿瘤逃脱缺氧应激,也同时促进了肿瘤的播散。这一特点减少了耐药性的产生,也促进了抗癌药物的渗透。同理,绒毛膜癌生发于血供本身就很丰富的胎盘,睾丸癌所在的部位也有丰富的血管网络以维持生精功能。
另一方面,基因组学的不稳定会加速肿瘤克隆的进化、获得耐药性,而“可治愈性”癌症较少出现基因组的不稳定。一个典型的例子就是急性淋巴细胞白血病,儿童和成人不同亚型的预后差异很大一部分就取决于基因组学的差异。儿童急性淋巴细胞白血病预后比成人好很多,因为前者的基因组相对更稳定、自我更新细胞很少,限制了克隆进化和耐药性的发展,而那些临床疗效不佳的亚型往往存在TP53功能的抑制和强大的癌基因。
综上,这篇论述通过比较“可治愈性”和难治性肿瘤的进化进程,指出了癌症的发育起源、演进中的生存瓶颈决定了临床的结局,而抗癌治疗作为生存瓶颈的一部分原因,对于癌症“命运”也有重要作用。文中特别强调了TP53失活、缺氧等微环境是解释肿瘤耐药的关键机制。虽然肿瘤进化似乎是难以避免的,但是随着对癌症这个疾病更深入的认识,我们仍然有希望通过更多、更先进的治疗策略驾驭肿瘤的发展轨迹,达到降低耐药、增加治愈率的目标。
DOI: 10.1038/s41559-023-02159-w


