CAR-巨噬细胞的研究现状与挑战
时间:2023-04-17 11:16:58 热度:37.1℃ 作者:网络
CAR-T细胞治疗是一种细胞免疫疗法,是指通过基因克隆技术将具有特异性抗原识别域和T细胞激活信号的遗传物质转移到T细胞中,使T细胞与肿瘤细胞表面的特异性抗原结合直接激活的方法。CAR-T细胞已成功用于治疗循环系统恶性肿瘤,如B细胞源性恶性肿瘤。CAR-T治疗成功后,人们又将CAR策略应用于NK细胞,开发出了类似于CAR-T治疗的CAR-NK细胞疗法。
单核吞噬细胞系统(MPS)的两种主要细胞类型是单核细胞和单核细胞衍生的巨噬细胞,它们都具有吞噬功能。MPS选择性地吞噬外部目标如微生物,然而,巨噬细胞无法识别和攻击肿瘤。即使在肿瘤组织内,巨噬细胞也不会在吞噬或抗原呈递中发挥作用,而是转变为免疫抑制M2型,阻止免疫系统清除肿瘤细胞。
此外,除了巨噬细胞吞噬的阳性信号外,还有相反的信号阻止巨噬细胞吞噬目标肿瘤细胞,如CD47。这些信号自从被发现以来就成为一个热门的研究领域。
鉴于目前CAR-T细胞治疗的成功和CAR-NK细胞的发展潜力,研究人员对开发用于肿瘤免疫治疗的CAR巨噬细胞(CAR-M)产生了极大的兴趣。CAR-M的出现为治疗实体瘤开辟了新的可能性:用特异性CARs修饰人巨噬细胞,以提高巨噬细胞对肿瘤的吞噬活性和抗原呈递。
目前使用CAR-M治疗癌症已进行了多种尝试。研究人员设计了嵌合抗原受体吞噬细胞(CAR-P),它可以引导巨噬细胞吞噬特定的靶细胞。

研究证明,表达Megf10或FcRv胞内结构域的CAR-P可促进对靶抗原的吞噬能力。CAR-PMegf10可以特异性地触发对靶向配体的吞噬作用,通过酪氨酸磷酸化的局部信号级联反应启动吞噬,TCR-CD3ζ可能通过招募syk激酶而促进CAR-P的吞噬作用。
全细胞吞噬是比较罕见的,而啃咬靶细胞更为频繁,这表明CAR-P巨噬细胞与靶细胞之间的相互作用不足以触发直接的全细胞吞噬。已有研究发现,PI3K信号在大靶点的内吞过程中起重要作用,可以促进巨噬细胞的吞噬作用。研究人员将pI3K p85亚单位与CAR-P-FcRv连接起来,形成一个“串联”CAR(CAR-Ptandem)。CAR-Ptandem具有较好的全细胞吞噬功能。

宾夕法尼亚大学的研究人员使用含有CD3-ζ胞内结构域的抗HER2的CAR-M。在两种实体瘤移植的异位小鼠模型中,单次注射抗HER2-CAR-M可降低肿瘤负荷,延长小鼠存活时间。在人源化小鼠模型中还发现, HER2-CAR-M能够将M2巨噬细胞转化为M1巨噬细胞,诱导炎症性肿瘤微环境,增强T细胞的抗肿瘤细胞毒性。此外,还发现HER2-CAR-M可能产生表位扩散,为避免肿瘤免疫逃逸提供了新思路。

Zhang等人利用诱导多能干细胞(iPSCs)表达CAR结构并分化为巨噬细胞,命名为CAR-iMac。研究表明,表达CAR的iPSCs能分化为巨噬细胞样细胞,在无抗原的情况下,CAR-iMac更接近M2极化状态。然而,在存在特异性抗原的情况下如CD19,CAR介导的信号促进了CAR-iMac的吞噬作用,并导致CAR-iMac向促炎的M1型的转化。iPSC来源的巨噬细胞可能成为髓系肿瘤免疫治疗的重要细胞来源。
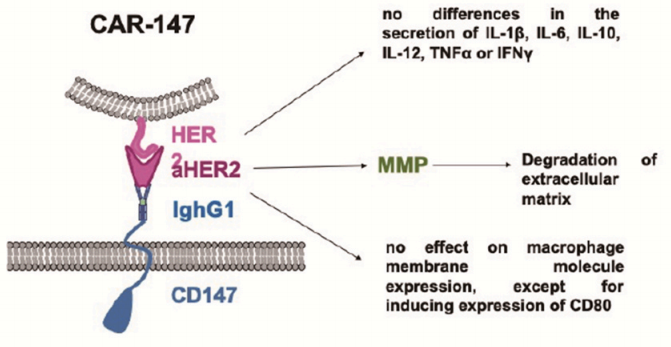
CAR-T治疗实体瘤无效的一个重要原因是T细胞难以进入肿瘤组织。这是因为实体瘤细胞外基质(ECM)形成的物理屏障阻止了T细胞进入肿瘤组织。ECM由高度有序的纤维分子、糖蛋白和其他大分子产生,其合成和降解主要受基质金属蛋白酶(MMPs)和金属蛋白酶组织抑制剂(TIMPs)的调控,而巨噬细胞就是MMP的重要来源。
研究人员设计了一种CAR-147的结构,它由靶向人HER2的单链抗体、IghG1的铰链区和小鼠CD147分子的跨膜和细胞内区域组成。CAR-147与HER2+人乳腺癌细胞共培养后,在CAR-147巨噬细胞中诱导多个MMP的表达,证明CAR-147能特异性识别HER2抗原,有效激活巨噬细胞中MMP的表达。CAR-147巨噬细胞在体外不抑制肿瘤细胞增殖,但静脉注射CAR-147巨噬细胞可显著抑制4T1乳腺癌小鼠模型的肿瘤生长。同时发现用CAR-147巨噬细胞治疗的肿瘤中T细胞所占的比例远高于对照巨噬细胞治疗的肿瘤,说明CAR-147巨噬细胞能破坏肿瘤细胞外基质,促进T细胞向肿瘤浸润。
直到2020年11月,两个基于CAR-M策略的临床试验已经获得FDA的批准。第一个是来自CARISMA Therapeutics的候选药物CT-0508,它用抗HER2的CAR-M治疗复发/难治性HER2过度表达的肿瘤患者(I期临床试验)。另一个是Maxyte的MCY-M11,它利用mRNA转染PBMC表达靶向间皮素的CAR(包括CAR-M),治疗复发/难治性卵巢癌和腹膜间皮瘤患者,目前正在招募志愿者进行I期临床试验。

关于CAR-M的临床转化,有几个方面需要注意:第一,CAR-M的安全性和有效性是该疗法的基础,虽然已经通过动物实验进行了验证,但CAR-M在人体内的安全性和有效性仍有待验证;其次,可靠的细胞来源和扩增是CAR-M临床应用的必要条件,CAR-M可由PBMC或iPSCs制备。此外,与T细胞不同,巨噬细胞发生GVHD的风险较低,这意味着可以提前生产产品,供患者按需使用。第三,还有一个问题必须考虑,目前,CAR-M多采用病毒转染的方法,可能会诱发插入突变, CRISPR/Cas9为解决这一问题提供了新的可能性,仅需一周即可完成CAR-T基因的编辑。
与CAR-T和CAR-NK细胞相似,CAR-M细胞由识别特定肿瘤抗原的细胞外信号传导域、跨膜区域和细胞内激活信号区域组成。目前,对细胞外信号域的研究主要几种在几种常见的肿瘤靶点,如CD19和HER2。
与CAR-T细胞不同,CAR-M细胞具有以下三个优点。
1)由于肿瘤细胞周围基质形成的物理屏障,T细胞不能进入肿瘤环境,而巨噬细胞可以明显地浸入肿瘤环境中。TAM在肿瘤侵袭、转移、免疫抑制和血管生成中起着重要作用。CAR-M能降低TAM的比例,影响TAM的细胞表型,对肿瘤的治疗有积极作用。
2)CAR-M除了具有吞噬肿瘤细胞的作用外,还具有促进抗原提呈能力和增强T细胞杀伤的作用。
3)与CAR-T相比,CAR-M的循环时间有限,非肿瘤靶向毒性较小。
尽管CAR-M有很大的潜力成为一种强有力的肿瘤免疫治疗方法,但要达到预期的效果还需要克服许多问题。首先是细胞数量的限制:无论是在体外还是在体内注射后,巨噬细胞都不会增殖。患者只能接受有限数量的巨噬细胞,这可能会影响治疗效果。二是与巨噬细胞在体内的迁移特性有关。注射后,外源性巨噬细胞通过肺部,然后大部分留在肝脏,不利于癌症的治疗。三是复杂的肿瘤微环境。尽管CAR-M在小鼠模型中取得了很好的效果,但人类实际的肿瘤微环境要比动物模型复杂得多。最后,由于肿瘤细胞的高度异质性,靶抗原的表达可能不够。这一问题在CAR-T治疗中一直非常突出。临床研究发现,大多数被CAR-T细胞去除的肿瘤细胞都有高水平的靶抗原表达。可以预见,这也将成为CAR-M疗法发展的一大障碍。
CAR-M疗法在动物实验中已显示出其有效的抗肿瘤能力。与CAR-T和CAR-NK相比,CAR-M作为一种新的细胞免疫疗法有其独特的优势,但也有许多不足需要克服。因此,在今后的临床治疗中应注意最大限度地提高CAR-M的有效性和安全性。我们有理由相信,随着科学技术的进一步发展,CAR-M很快将在患者身上显示出疗效,为肿瘤免疫治疗再添助力!
参考文献:
1.CAR-macrophage: A new immunotherapy candidate against solid tumors. Biomed Pharmacother. 2021 Jul;139:111605.


