Nat Immunol:迟洪波团队发现大脑中特化的T细胞减缓了阿尔茨海默病的进展
时间:2023-09-21 20:37:45 热度:37.1℃ 作者:网络
炎症和免疫异常是阿尔茨海默病(AD)和其他神经退行性疾病的特征。小胶质细胞可引发神经炎症,从而导致阿尔茨海默病,而适应性免疫细胞也会在阿尔茨海默病患者体内发生表型改变。然而,适应性免疫细胞在AD发病机制中既表现出有害作用,也表现出保护作用,这可能归因于适应性免疫系统的时间调节或功能异质性。此外,细胞间通讯正在成为决定炎症以及感染和癌症等疾病结果的关键因素,然而我们对脑实质中这种通讯的调控及其对神经炎症的贡献还缺乏了解。
2023年9月7日,来自美国圣裘德儿童医院 (St Jude Children’s Research Hospital)的迟洪波和苏伟(第一作者)研究团队在Nature Immunology 上发表题为“ CXCR6 orchestrates brain CD8+ T cell residency and limits mouse Alzheimer’s disease pathology”的文章,发现共表达CXCR6和PD-1的大脑驻留CD8+ T细胞,其存在于患有AD人和小鼠大脑的斑块相关小胶质细胞中。研究还发现CD8+ T细胞阻碍AD进展,包括β淀粉样蛋白沉积和认知能力下降。
配体-受体相互作用分析可识别小胶质细胞和CD8+ T细胞之间存在的CXCL16–CXCR6细胞间通讯。Cxcr6缺乏会损害脑PD-1+ CD8+ T细胞的积累、组织驻留和克隆扩增。Cxcr6或CD8+ T细胞缺失最终会增加小胶质细胞中促炎细胞因子的产生,CXCR6调控脑CD8+ T细胞-小胶质细胞的共定位。总的来说,该研究揭示了脑CD8+ T细胞和CXCR6在小鼠AD发病机制中的保护作用,并揭示了微环境特异性细胞间通讯协调组织稳态和免受神经炎症的损害。

免疫细胞的改变发生在 AD 患者的外周和中枢神经系统(CNS) 以及小鼠模型中,但对发生疾病相关病理变化的脑实质中非小胶质细胞免疫细胞的变化却知之甚少。研究人员首先对来自 5xFAD和非转基因(Non-Tg)对照小鼠的脑实质(以下称脑)或脑膜硬膜和蛛网膜组织(以下称脑膜)的 CD45int/+CD11b+(主要是小胶质细胞)和 CD45+CD11b-(非小胶质细胞免疫细胞)细胞进行了 scRNA-seq 分析,发现正如预期的那样,疾病相关小胶质细胞(DAM)仅限于 5xFAD 小鼠,惊讶的发现,5xFAD 小鼠 CD8+ T 细胞的频率升高,而 CD4+ T 细胞或 γδ T 细胞的频率则没有升高。细胞流式和免疫组化结果也显示CD8+ T 细胞的积累在小鼠疾病模型和AD 病人里非常保守,这一积累的效果主要特异的表现在脑实质,而不会在脑膜或者其他组织肺和肝脏中发生。通过研究缺乏 CD8+ 和 CD4+ T 细胞的 TCRα 缺陷 5xFAD 小鼠(5xFAD; Tcra-/-小鼠)和CD8+ T 细胞的选择性丧失(5xFAD; B2m-/- 小鼠),发现Aβ 斑块负担增加,记忆功能下降,证实了CD8+ T 细胞对AD的发展保护作用。
细胞间通讯网络影响着中枢神经系统的组织稳态和病理学。然而,人们对 AD 中细胞间通讯的具体信号、区段和背景仍知之甚少,尤其是非小胶质细胞的免疫细胞。对单个趋化因子配体-受体对的分析表明,CXCL16-CXCR6 是 5xFAD 小鼠小胶质细胞和CD8+ T 细胞之间排名最靠前的配体对。在人类中,CXCL16 的表达也发生了与 AD 相关的改变,这表明小鼠 AD 模型和人类之间对 CXCL16 的调控是一致的。CXCR6的缺失导致5xFAD小鼠脑实质中CD8+ T cell明显的下降,5xFAD; Cxcr6-/- 小鼠脑膜中的 CD8+ T 细胞减少,但脾、肝和肺中的 CD8+ T 细胞基本没有变化,因此这种影响是中枢神经系统特有的。与此同时,CXCR6 缺乏与 5xFAD 小鼠脑 CD8+ T 细胞减少和疾病病理加剧有关。
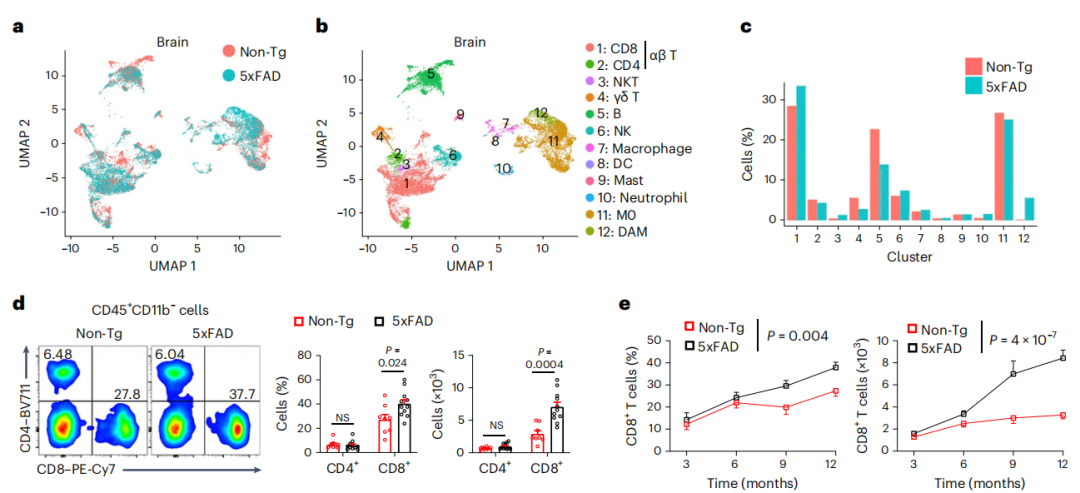
CD8+T细胞在AD中积累并保护小鼠免受AD相关病变(图源自Nature Immunology)
为了进一研究组织特异性如何影响CD8+ T 细胞的积累和功能,研究人员对 scTCR-seq 和 scRNA-seq 进行了配对分析,以确定 5xFAD 和Non- Tg 小鼠大脑和脑膜中克隆扩增的 T 细胞群。结果表明CD8+ T细胞的克隆扩增表现出组织和疾病的特异性。为了确定可标记克隆扩增的脑 CD8+ T 细胞的假定分子,我们计算了单个基因的表达与克隆型频率之间的皮尔逊相关系数,结果发现 Pdcd1(编码 PD-1)是与克隆扩增细胞相关性最高的基因。此外,成像分析表明,在 5xFAD 小鼠和AD症患者的大脑中,CD8 和 PD-1 共同表达。与脑膜相比,CD8+ T 细胞克隆扩增更倾向于发生在大脑中,因此支持具有 TRM 细胞表型的 CD8+ T 细胞克隆扩增具有中枢神经系统分区特异性和疾病相关性。这些结果共同表明,CXCR6对于小鼠AD背景下脑CD8+ T细胞的TRM细胞编程至关重要,并揭示了CXCR6在连接脑CD8+ T细胞克隆扩增和组织驻留程序中的关键作用。
为了探讨CD8+ T细胞是如何在AD的发生起到保护作用的,高分辨率共聚焦成像显示,在 5xFAD 小鼠的 Aβ 斑块附近,CD8+ T 细胞或 CD3+ T 细胞与 Iba1+ 小胶质细胞共聚焦。在 AD 患者的大脑中也观察到 CD8+ T 细胞与 Aβ 和 IBA1+ 小胶质细胞如此接近。因此,CD8+ T细胞与小胶质细胞或Aβ的共定位是小鼠模型和人类中的一种保守现象。同时,大脑 CD8+ T 细胞的缺失或减少会导致小胶质细胞的炎症状态升高。
进一发现,克隆扩增的 Pdcd1+CD8+ T 细胞富集了这种调节性 CD8+ T 细胞特征,与抑制相关分子 CD73、LAG3、CD39 和 TIGIT 以及 CXCR6 的表达增加有关。为了直接检测 CD8+ T 细胞是否对小胶质细胞有抑制作用,采用体外系统从脾脏 CD44hiCD8+ T 细胞产生 PD-1+CD8+ T 细胞,并与原代小胶质细胞进行共培养。在有 PD-1+CD44hiCD8+ T 细胞存在的情况下,受刺激的小胶质细胞中 TNF-α 和 pro-IL-1β 的表达减少,这与培养的 PD-1+CD44hiCD8+ T 细胞上免疫抑制标记物(以及 CXCR6)的表达增加一致。同样,CXCR6+CD8+ T 细胞也表现出这种抑制作用。来自 5xFAD 小鼠的脑源性 CD8+ T 细胞也能抑制小胶质细胞产生促炎细胞因子。然而,CD73缺陷的5xFAD(5xFAD; Nt5e-/-)小鼠的脑CD8+ T细胞在体外抑制小胶质细胞促炎细胞因子产生方面存在一定缺陷,这表明CD73可能部分促进了脑CD8+ T细胞的抑制机制。因此,PD-1+CD8+ T 细胞抑制了小胶质细胞促炎细胞因子的产生。
总之,该研究强调,在 Aβ 斑块负荷增加的情况下,组织驻留的 CD8+ T 细胞的积累起到了维持小胶质细胞功能平衡的作用。此研究表明Aβ斑块负荷可能会引发促炎性小胶质细胞增生,而CD8+ T细胞则在后期聚集,并在减轻小胶质细胞炎症状态以限制Aβ斑块进一步形成和认知能力下降方面发挥平衡作用。由 CXCL16-CXCR6 介导的小胶质细胞和 CD8+ T 细胞之间的双向相互作用以及脑驻留 CD8+ T 细胞的免疫调节作用可能是神经退行性疾病的重要免疫治疗靶点。
参考消息:
https://www.nature.com/articles/s41590-023-01604-z


