【协和医学杂志】系统性红斑狼疮患儿血清降解单糖水平变化及其意义
时间:2023-09-15 11:02:02 热度:37.1℃ 作者:网络
系统性红斑狼疮(SLE)是一种多系统、多脏器受累的慢性自身免疫性疾病,抗自身细胞核成分的抗核抗体大量生成并激活补体系统,导致多系统靶器官损伤是其主要疾病特征[1];该病多见于20~40岁育龄女性,但儿童亦可患病,且SLE患儿更易出现多系统损伤[2]。SLE发病原因可能涉及淋巴细胞过度激活、自身抗体产生等多方面因素[3],但确切机制尚未完全阐明。
蛋白的糖基化修饰是自然界普遍存在的生物学现象,为蛋白质翻译过程中或翻译后的一种重要加工过程。其在蛋白质的生物学功能表达调控中发挥重要作用,如大部分免疫细胞膜表面的免疫相关受体(Toll样受体、T淋巴细胞受体、B淋巴细胞受体等)均由糖蛋白构成,糖蛋白几乎涉及了机体免疫网络的全部环节[3],故对于免疫系统而言,蛋白的正确糖基化意义重大。
作为自身免疫性疾病,SLE发病可能与蛋白质糖基化修饰异常导致新抗原表位产生,进而激活免疫细胞、破坏免疫耐受平衡相关[4-6],且有研究发现IgG糖基化改变与SLE疾病活动度相关,并可能为SLE的诱发因素[7-8],但目前临床对糖基化与SLE的相关性仍缺乏全面认识。
异常糖基化与聚糖的变化密不可分,后者为一类分子结构复杂且数量庞大的多糖,由多种结构相同或不同的单糖通过糖苷键结合而成,由于其结构复杂,直接分析聚糖变化在SLE发病中的作用难度较大。
研究显示,聚糖降解后以单糖的形式存在,血清降解单糖水平一定程度上可反映聚糖数量和结构变化[9],且已证实血清降解单糖水平在2型糖尿病、心血管疾病、过敏性紫癜等多种疾病中呈独特性改变[10-12],但目前SLE患儿血清降解单糖变化特征及其临床意义的相关研究较匮乏。
本研究以健康儿童为对照,探究SLE患儿血清甘露糖、氨基葡萄糖、氨基半乳糖、N-乙酰氨基葡萄糖、半乳糖5种降解单糖水平变化,并分析其与SLE疾病活动度、淋巴细胞亚群、免疫球蛋白等指标的相关性,以期为SLE病因学研究和病情评估提供新的思路。
1 资料与方法
1.1 研究对象及分组
本研究为回顾性病例对照研究。研究对象为2019年1月—2022年3月青岛大学附属医院儿童肾脏风湿免疫科首次确诊并住院治疗的SLE患儿(SLE组)及同期于该院体检且年龄、性别与SLE患儿按1:1比例相匹配的健康儿童(对照组)。
SLE组纳入标准:(1)诊断符合2012年国际系统性红斑狼疮研究临床协作组(SLICC)制定的SLE分类标准[13],且血清标本采集前4周内未行激素、免疫抑制剂治疗;(2)年龄≤18岁;(3)研究相关临床资料无明显缺失。
排除标准:(1)合并其他自身免疫系统疾病,如混合结缔组织病、类风湿关节炎、药物性狼疮、干燥综合征等;(2)合并糖尿病、全身感染以及严重肝肾功能不全者。
对照组纳入标准:体检证实无研究相关疾病,如肿瘤、糖尿病、感染性疾病、肝肾功能不全等。排除标准:研究相关临床资料明显缺失。
本研究已通过青岛大学附属医院伦理审查委员会批准(审批号:QYFYWZLL26173),并豁免患儿及其监护人知情同意。
1.2 方法
1.2.1 基线资料收集
收集SLE组患儿CD3+ T淋巴细胞计数、CD4+T淋巴细胞计数、CD4+T/CD8+ T淋巴细胞比值、自然杀伤(NK)细胞计数、B淋巴细胞计数等外周血淋巴细胞亚群指标,IgA、IgE、IgG、IgM等免疫球蛋白指标,以及补体C3、C4水平。
采用系统性红斑狼疮疾病活动指数(SLEDAI)评估疾病活动度,SLEDAI评分≤6分、7~12分、>12分分别为轻度疾病活动、中度疾病活动和重度疾病活动[13]。
1.2.2 血清标本采集
采集SLE患儿及健康儿童清晨空腹(餐后6 h)外周静脉血4 mL置于无菌抗凝管中,离心后取上清液200 μL,置于-80 ℃超低温冰箱中保存备用。
1.2.3 血清降解单糖水平检测
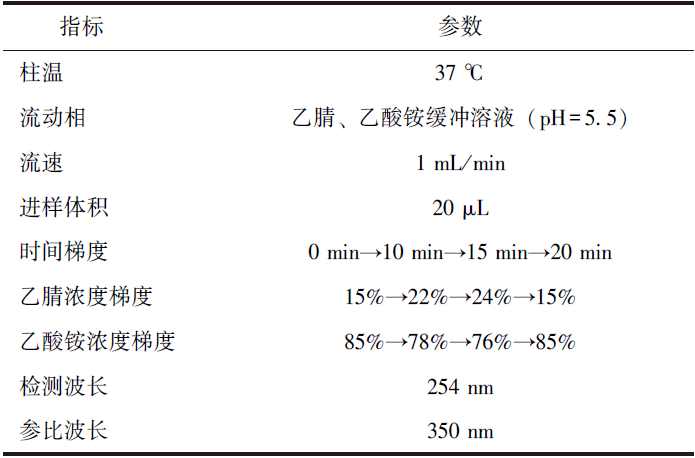
采用高效液相色谱(HPLC)技术检测两组血清5种降解单糖水平,仪器为高效液相色谱仪(美国Agilent公司),检测方法如下:取一个洁净的EP管,依次加入盐酸溶液(6 mol/L)10 μL、鼠李糖(1 g/L)5 μL及血清5 μL,混匀后将EP管置于聚合酶链式反应仪中,运行酸解程序(100 ℃ 10 min,4 ℃ 5 min);向EP管中加入氢氧化钠溶液(3 mol/L)、1-苯基-3-甲基-5-吡唑啉酮(0.5 mol/L)各20 μL,运行衍生程序(70 ℃ 40 min,4 ℃ 10 min);向EP管中加入乙酸铵缓冲溶液20 μL、氯仿100 μL,萃取后离心(离心半径30 cm,13 300 r/min 离心15 min),取50 μL上清液进行HPLC分析(参数见表1)。
表1 高效液相色谱仪分析的各项参数
将标准单糖混合溶液等梯度浓度稀释为10个梯度,通过HPLC分析可获得单糖标准品HPLC色谱图(图1A)。

图1A 高效液相色谱图 单糖标准品
以单糖标准品浓度为横坐标,对应的HPLC峰面积为纵坐标,绘制单糖标准曲线,并计算单糖标准曲线方程式。将血清标本降解单糖HPLC色谱图(图1B)的峰面积代入标准曲线方程式,即可获得血清降解单糖浓度。
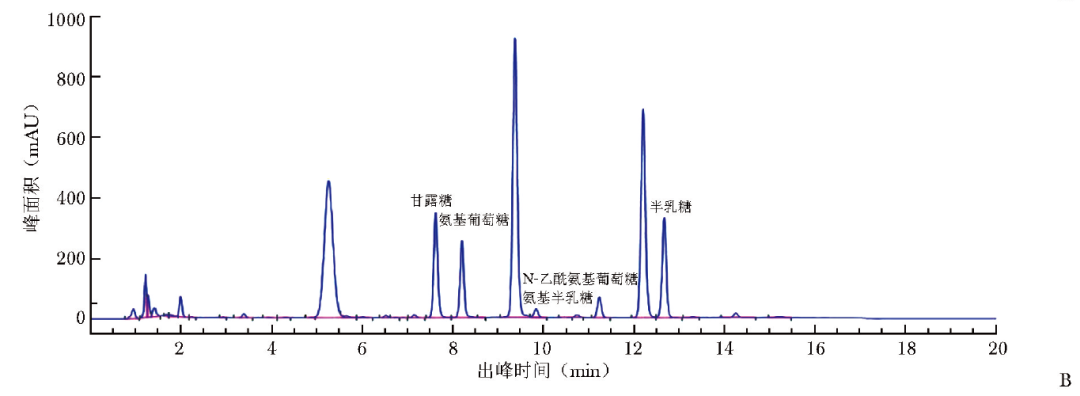
图1B 高效液相色谱图 血清样本
1.3 样本量估算
因既往无类似研究,根据预实验结果设定SLE患儿半乳糖升高的概率为0.9,健康对照儿童为0.15,两组样本比例为1:1,在检验水准α为0.05、把握度(1-β)为90%的情况下,经估算SLE患儿、健康对照儿童最低所需样本均为40例。
1.4 统计学处理
采用SPSS 25.0和GraphPad Prism 8软件进行统计学分析。血清降解单糖水平及SLEDAI评分为正态分布计量资料,以均数±标准差表示,SLE组与对照组组间比较采用t 检验;SLE组不同疾病活动度患者的比较采用单因素方差分析(组间两两比较采用Bonferroni检验)。采用Pearson线性相关法分析血清降解单糖水平与SLE患儿SLEDAI评分及免疫指标的相关性。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入与排除标准的SLE患儿45例,健康对照儿童50名。SLE组男童7例,女童38例;年龄(14.35±2.45)岁;轻度疾病活动13例、中度疾病活动15例、重度疾病活动17例。对照组男童8名,女童42名;年龄(13.75±2.17)岁。SLE组与对照组以及不同疾病活动度SLE患儿间性别、年龄差异均无统计学意义(P 均>0.05)。
SLE组患儿中,SLEDAI评分为(15.11±3.68)分,CD3+ T淋巴细胞计数为(0.64±0.36)×109/L,CD4+ T淋巴细胞计数为(0.24±0.21)×109/L,CD4+T/CD8+T淋巴细胞比值为0.62±0.22,NK细胞计数为(0.32±0.13)×109/L,B淋巴细胞计数为(0.61±0.44)×109/L,IgA为(3.13±0.38)g/L,IgE为(355.8±40.0)U/L,IgG为(15.68±5.39)g/L,IgM为(1.48±0.85)g/L,C3为(0.74±0.46)g/L,C4为(0.13±0.11)g/L。
2.2 SLE患儿血清降解单糖水平变化
SLE组血清甘露糖、氨基葡萄糖、氨基半乳糖、N-乙酰氨基葡萄糖、半乳糖水平均高于对照组(P 均<0.05),见图2。
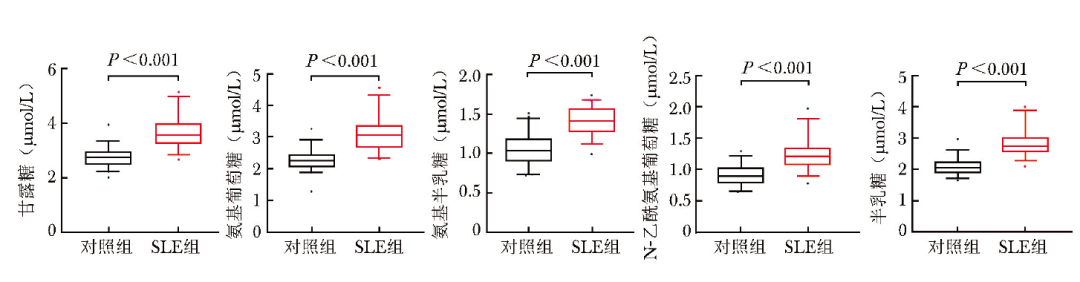
图2 SLE组与对照组5种血清降解单糖水平比较
SLE:系统性红斑狼疮
2.3 不同疾病活动度SLE患儿血清降解单糖水平变化
重度疾病活动SLE患儿血清甘露糖、N-乙酰氨基葡萄糖、半乳糖水平高于中度疾病活动患儿(P 均<0.05),且中度疾病活动患儿上述三种降解单糖水平高于轻度疾病活动患儿(P 均<0.05),不同疾病活动度SLE患儿的氨基葡萄糖、氨基半乳糖水平均无显著差异(P 均>0.05),见图3。

图3 不同疾病活动度SLE患儿5种血清降解单糖水平比较
SLE:同图2;*P<0.05;**P<0.01;***P<0.001; #P>0.05
2.4 SLE患儿血清降解单糖水平与疾病活动度及免疫学指标的相关性
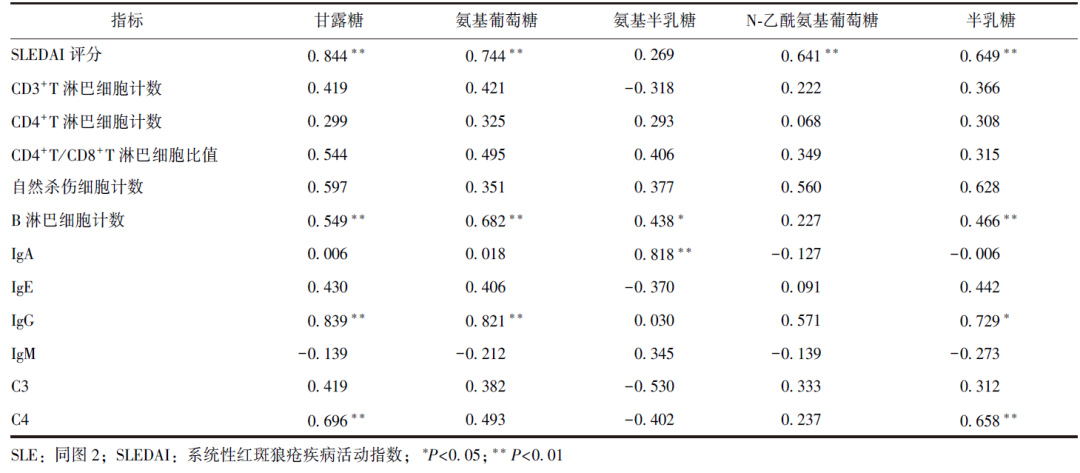
Pearson相关性分析显示,SLE组患儿血清甘露糖、氨基葡萄糖水平与SLEDAI评分、B淋巴细胞计数、IgG水平等均呈正相关;氨基半乳糖与B淋巴细胞计数、IgA水平均呈正相关;N-乙酰氨基葡萄糖与SLEDAI评分呈正相关;半乳糖与SLEDAI评分、B淋巴细胞计数、IgG水平、补体C4水平均呈正相关,见表2。
表2 SLE患儿血清降解单糖水平与疾病活动度及免疫学指标相关性分析结果(r)
3 讨论
本研究基于病例对照研究设计,探究了SLE患儿血清5种降解单糖水平变化特征及其临床意义,结果显示SLE组血清甘露糖、氨基葡萄糖、氨基半乳糖、N-乙酰氨基葡萄糖、半乳糖水平均高于对照组;对SLE患儿进行亚组分析后发现,甘露糖、N-乙酰氨基葡萄糖、半乳糖水平随疾病活动度增加而逐渐升高。
相关性分析表明,血清降解单糖水平与SLEDAI评分及多种免疫指标存在正相关,提示血清降解单糖可能与SLE发病及病情进展具有关联性,为该病的病因学研究提供了数据支撑。
SLE是一种因机体免疫功能自稳机制紊乱而导致、以血清出现多种自身抗体为特征,可累及全身多器官、多系统的自身免疫性疾病。随着SLE治疗药物的不断涌现,特别是近年来以贝利尤单抗为代表的生物制剂的问世,SLE临床治疗效果大为提高,整体而言患者预后得到了明显改善,但由于SLE发病机制十分复杂,仍有部分患者对治疗药物不敏感,以致生活质量进行性下降甚至危及生命,且相较于成人SLE患者,SLE患儿的疾病活动度更高、脏器损害更为广泛且严重[14-15]。有资料显示,SLE患儿10年累积死亡率约为10%[16]。因此,进一步阐明SLE发病机制,特别是探寻免疫稳态失衡的原因仍十分必要。
糖组学是当前生物学领域的新兴学科,主要研究聚糖在生物体内的结构和功能。聚糖为生物体重要的组成成分,类似于核酸、蛋白质,其蕴含非常丰富的生物学信息[17]。聚糖分子的形成不受基因编码的直接调控,而是在糖基转移酶的催化下,糖链与蛋白质或脂质相结合形成糖蛋白或糖脂,该过程即为糖基化[18]。
糖基化修饰几乎参与了机体所有生物学过程,尤其在免疫调节中发挥重要作用[19]。如IgG介导的抗炎作用可通过其Fc片段与B淋巴细胞、T淋巴细胞、NK细胞等免疫细胞表面Fc受体相结合而实现,具体机制与Fc片段的唾液酸化(糖基化的一种类型)抑制了自身抗体所致的免疫反应有关[20-21]。
Cheng等[22]研究发现,相较于正常人群,幼年特发性关节炎患者IgG的Fc片段半乳糖基化与唾液酸化水平均降低,提示Fc区域糖基化对于调节抗体对炎症的影响至关重要。既往研究发现,SLE患者IgG的Fc片段半乳糖基化和唾液酸化异常与血清抗核抗体水平及器官受累呈正相关[7],血清IgG岩藻糖基化水平升高与SLE疾病活动度相关[23]。
Szabo等[24]研究发现,SLE患者效应T细胞表面N-糖基化的改变不利于其与半乳糖凝集素1相结合,进而抑制Th1/Th17凋亡,对SLE患者T细胞分化失调产生直接影响,可能参与了SLE发病的调节。上述研究提示,糖基化与包括SLE在内的自身免疫性疾病的发生发展密切相关。
虽然聚糖结构的复杂性以及糖基化过程较强的随机性导致直接分析SLE患儿的聚糖变化特征难度较大,但聚糖由单糖组成,而单糖的成分却相对单一,主要包括10种单糖,即甘露糖、氨基葡萄糖、氨基半乳糖、N-乙酰氨基葡萄糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖、岩藻糖和唾液酸。
上述单糖中能在血清独立存在的称为游离单糖(如甘露糖、葡萄糖等),聚糖经酸解后检出的单糖称为降解单糖(如甘露糖、氨基葡萄糖、氨基半乳糖、N-乙酰氨基葡萄糖、半乳糖),其中甘露糖和葡萄糖既可以游离单糖的形式存在,又可以降解单糖的形式存在。
由于降解单糖是人为将聚糖分解后所产生的单糖[25],相较于游离单糖,降解单糖水平一定程度上可反映聚糖数量和结构变化。本研究采用盐酸降解血清聚糖后通过HPLC技术对洗脱的降解单糖进行检测,以探究血清降解单糖与SLE的相关性。
本研究团队在前期实验中发现葡萄糖、葡萄糖醛酸、木糖、岩藻糖水平在SLE患儿与健康人群之间无显著差异,而唾液酸血清含量极低,检测难度大,故本研究对甘露糖、氨基葡萄糖、氨基半乳糖、N-乙酰氨基葡萄糖、半乳糖5种降解单糖进行了检测。
结果显示,SLE组此5种降解单糖水平均明显高于对照组;对SLE患儿组内比较后发现,甘露糖、N-乙酰氨基葡萄糖、半乳糖水平随疾病活动度增加而逐渐升高,提示血清降解单糖可能参与了SLE发病及病情进展。SLE患儿体内存在广泛的免疫紊乱,多数免疫相关分子属于糖蛋白,且免疫细胞表面的受体亦多数为糖蛋白结构。降解单糖水平的差异提示SLE患儿体内糖蛋白糖基化水平的改变。
推测免疫相关重要蛋白糖基化异常引起的免疫失衡可能在SLE发生、发展中起重要作用,但具体作用机制尚不清楚,可能在糖基化酶基因多态性遗传背景的基础上,糖基化酶表达水平和功能异常可使蛋白分子糖基化发生内在缺陷,进而导致机体免疫调节功能失衡,促进SLE发病。
相关性分析显示,5种血清降解单糖与多种免疫指标具有正相关性,如甘露糖、氨基葡萄糖、N-乙酰氨基葡萄糖、半乳糖均与SLEDAI评分呈正相关,甘露糖、氨基葡萄糖、氨基半乳糖、半乳糖均与B淋巴细胞计数呈正相关,甘露糖、氨基葡萄糖、半乳糖均与IgG水平呈正相关,提示血清降解单糖一定程度上可反映SLE患儿免疫功能紊乱程度,在病情监测、预后评估中具有潜在的应用价值。
本研究局限性:(1)虽然研究对象均设定了严格的纳入与排除标准,且对照组采用了年龄、性别与SLE患儿相匹配的方式入组,但仍不排除研究结果会受到其他干扰因素的影响;(2)对相关作用机制缺乏深入探讨;(3)受病例对照研究固有局限性的影响,暂无法明确血清降解单糖变化与SLE的因果关系。
综上所述,SLE患儿血清5种降解单糖水平升高且部分降解单糖与疾病活动度及免疫功能紊乱具有相关性,但确切结果仍需大样本前瞻性研究进一步验证。本研究初步揭示了血清降解单糖与SLE的相关性,可为后续SLE病因学研究及相关作用机制分析提供借鉴。
参考文献
[1]李文根,古奕文,张科,等.儿童与成人系统性红斑狼疮临床特点分析[J].中华实用儿科临床杂志,2015,30:672-675.
[2]Flores-Mendoza G, Sanson SP, Rodriguez-Castro S, et al. Mechanisms of Tissue Injury in Lupus Nephritis[J]. Trends Mol Med, 2018,24:364-378.
[3]Morel L. Immunometabolism in systemic lupus erythematosus[J]. Nat Rev Rheumatol, 2017,13:280-290.
[4]Stathopoulou C, Nikoleri D, Bertsias G. Immunometabo-lism: an overview and therapeutic prospects in autoimmune diseases[J]. Immunotherapy, 2019,11:813-829.
[5]Alves I, Vicente MM, Dias AM, et al. The Role of Glycosylation in Inflammatory Diseases[J]. Adv Exp Med Biol, 2021,1325:265-283.
[6]Panda AK, Parida JR, Tripathy R, et al. Mannose binding lectin: a biomarker of systemic lupus erythematosus disease activity[J]. Arthritis Res Ther, 2012,14:R218.
[7]王健, 李晞. 蛋白质糖基化修饰在自身免疫反应中的研究进展[J]. 检验医学与临床, 2021,18:128-131.
[8]Vuckovic F, Kristic J, Gudelj I, et al. Association of systemic lupus erythematosus with decreased immunosuppres-sive potential of the IgG glycome[J]. Arthritis Rheumatol, 2015,67:2978-2989.
[9]Han J, Zhou Z, Zhang R, et al. Fucosylation of anti-dsDNA IgG1 correlates with disease activity of treatment-naive systemic lupus erythematosus patients[J]. EBioMedicine, 2022,77:103883.
[10]王晓龙, 王秀然, 卢天成. 蛋白质糖基化修饰的研究进展[J]. 基因组学与应用生物学, 2017,36:4380-4384.
[11]Mardinoglu A, Stancakova A, Lotta LA, et al. Plasma Mannose Levels Are Associated with Incident Type 2 Diabetes and Cardiovascular Disease[J]. Cell Metab, 2017,26:281-283.
[12]王志亮, 盛楷迪, 林毅, 等. 过敏性紫癜患儿血清降解单糖水平的变化及意义[J]. 中国当代儿科杂志, 2022,24:894-898.
[13]Petri M, Orbai AM, Alarcon GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus[J]. Arthritis Rheum, 2012,64:2677-2686.
[14]田新平,李梦涛,曾小峰.从我国系统性红斑狼疮的诊治现状寻找可能的解决方案:来自《中国系统性红斑狼疮发展报告2020》的启示[J].协和医学杂志,2022,13:169-173.
[15]中华医学会儿科学分会免疫学组, 中华儿科杂志编辑委员会. 中国儿童系统性红斑狼疮诊断与治疗指南[J]. 中华儿科杂志, 2021,59:1009-1024.
[16]Li M, Wang Q, Zhao J, et al. Chinese SLE Treatment and Research group (CSTAR) registry: Ⅱ. Prevalence and risk factors of pulmonary arterial hypertension in Chinese patients with systemic lupus erythematosus[J]. Lupus, 2014,23:1085-1091.
[17]Varki A. Biological roles of glycans[J]. Glycobiology, 2017,27:3-49.
[18]章晓联. 蛋白糖基化与免疫[J]. 中国免疫学杂志, 2004,20:290-293.
[19]Zhou JY, Oswald DM, Oliva KD, et al. The Glycoscience of Immunity[J]. Trends Immunol, 2018,39:523-535.
[20]Kaneko Y, Nimmerjahn F, Ravetch JV. Anti-inflammatory activity of immunoglobulin G resulting from Fc sialylation[J]. Science, 2006,313:670-673.
[21]Fiebiger BM, Maamary J, Pincetic A, et al. Protection in antibody- and T cell-mediated autoimmune diseases by antiinflammatory IgG Fcs requires type Ⅱ FcRs[J]. Proc Natl Acad Sci U S A, 2015,112:E2385-E2394.
[22]Cheng HD, Stockmann H, Adamczyk B, et al. High-throughput characterization of the functional impact of IgG Fc glycan aberrancy in juvenile idiopathic arthritis[J]. Glycobiology, 2017,27:1099-1108.
[23]Sjowall C, Zapf J, von Lohneysen S, et al. Altered glycosylation of complexed native IgG molecules is associated with disease activity of systemic lupus erythematosus[J]. Lupus, 2015,24:569-581.
[24]Szabo E, Hornung A, Monostori E, et al. Altered Cell Surface N-Glycosylation of Resting and Activated T Cells in Systemic Lupus Erythematosus[J]. Int J Mol Sci, 2019,20:4455.
[25]Zhang M, Zhang Y, Ma X, et al. Using a PCR instrument to hydrolyze polysaccharides for monosaccharide composition analyses[J]. Carbohydr Polym, 2020,240:116338.


