JACC-BTS 北京安贞医院杜杰教授团队揭示PALMD改善钙化性主动脉瓣疾病的作用及机制
时间:2023-09-06 10:53:31 热度:37.1℃ 作者:网络
钙化性主动脉瓣疾病(CAVD)是最常见的心脏瓣膜病,其特征是进行性重塑,包括瓣膜纤维化和钙化。CAVD的患病率在老龄化人群中急剧增加,但由于其分子机制知之甚少,因此缺乏药物治疗选择。
瓣膜内皮细胞(VEC)在瓣膜发育和稳态中发挥着关键作用。VEC在血液和瓣膜间质细胞(VIC)之间提供保护屏障。在病理环境中,VEC可经历内皮间质转化 (EndMT),导致内皮屏障完整性破坏,从而使间质细胞变得活跃,容易转变为肌成纤维细胞,这些过程加速瓣膜重塑并导致狭窄和钙化。
最近的GWAS研究表明,在palmdelphin (PALMD)基因附近的SNP位点与PALMD的表达降低及CAVD风险相关。但PALMD与CAVD的因果关系缺乏体内实验的证据支持,并且PALMD调控CAVD的分子机制还需要进一步研究。
2023年8月30日,首都医科大学附属北京安贞医院杜杰教授团队在JACC: Basic to Translational Science在线发表了题为“Palmdelphin Deficiency Evokes NF-κB Signaling in Valvular Endothelial Cells and Aggravates Aortic Valvular Remodeling”的研究论文,揭示了PALMD结合TNIP1介导TNFAIP3依赖性去泛素化并抑制NF-κB激活,从而维持瓣膜内皮细胞稳态。

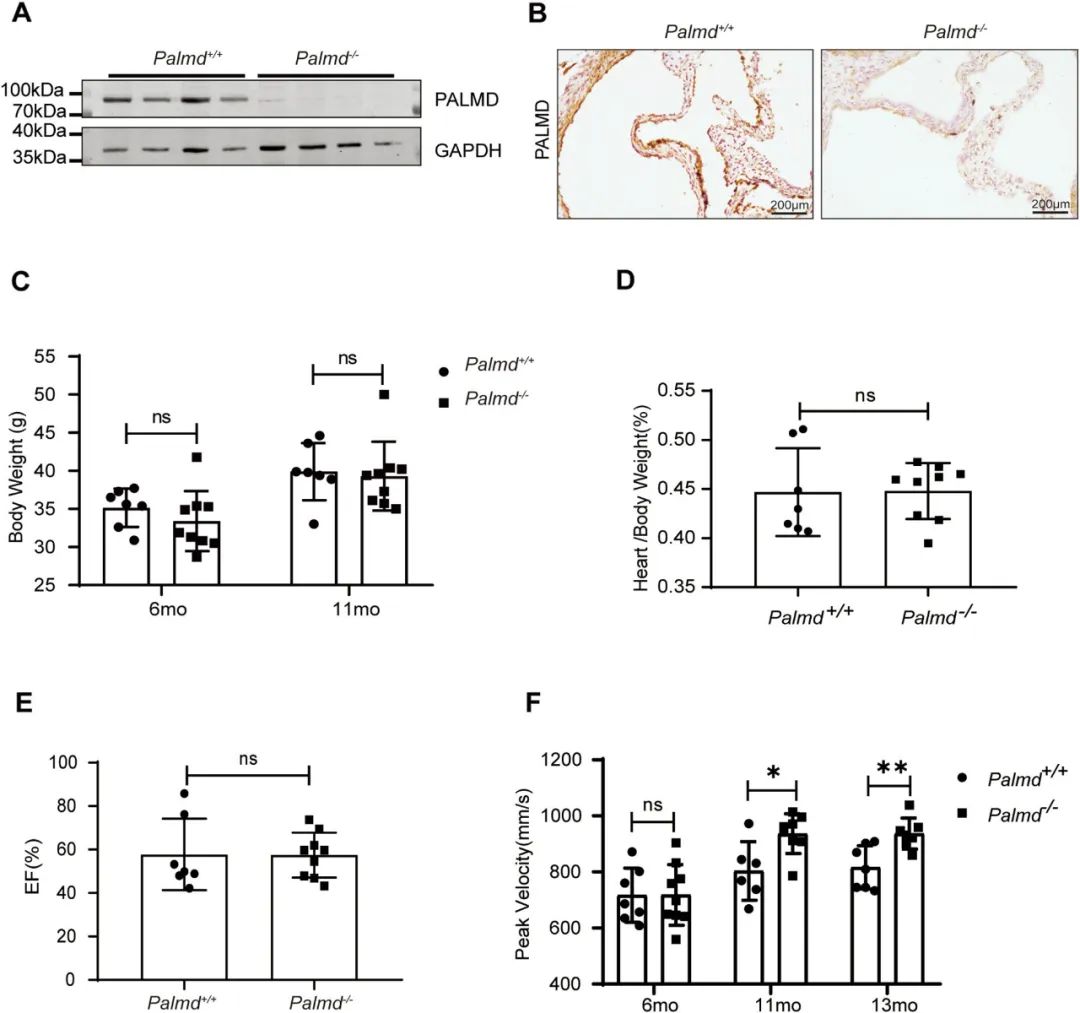
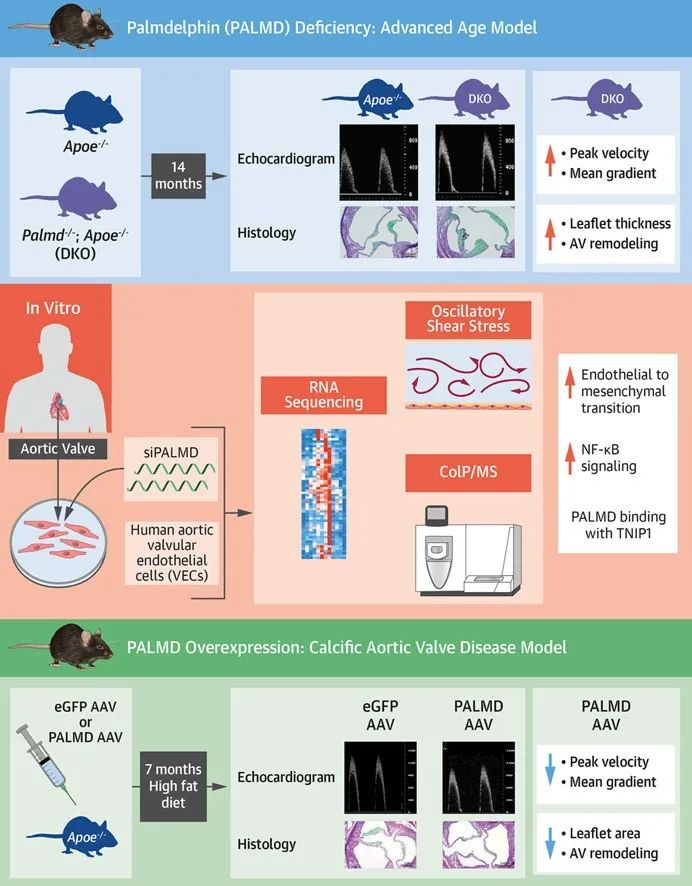
首先,研究者发现,与对照鼠相比,Palmd-/-小鼠以及Apoe和Palmd双敲除 (DKO)小鼠均在高月龄时表现出主动脉瓣峰值速度增加、瓣叶增厚以及蛋白聚糖和胶原纤维增加,这表明PALMD 缺失会加剧高龄小鼠的瓣膜细胞外基质(ECM) 重塑和瓣膜僵硬,导致主动脉瓣功能下降和CAVD进展。
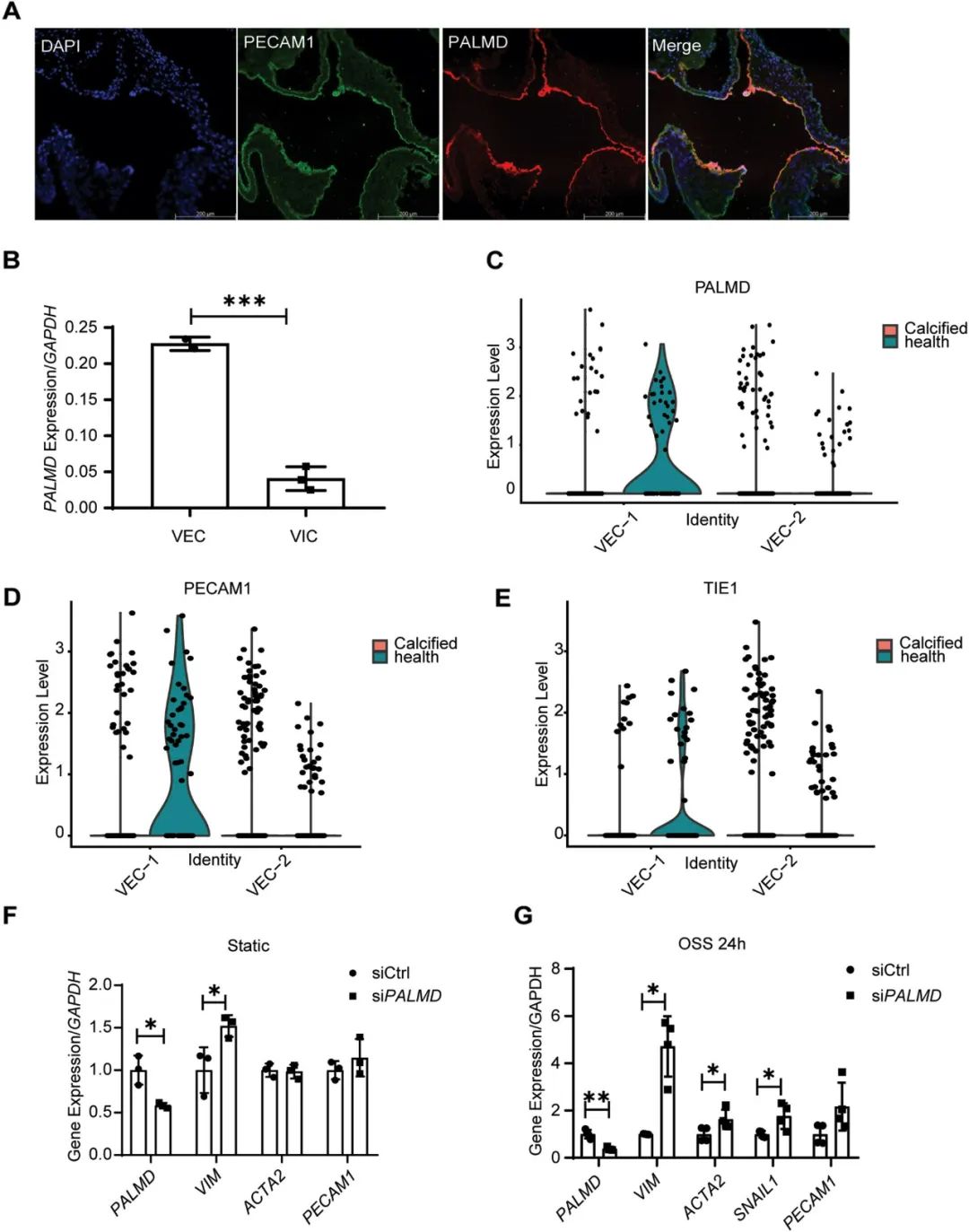
进一步研究表明,PALMD蛋白在小鼠主动脉瓣的VEC中高表达。健康人和CAVD患者scRNA-seq数据提示PALMD在VEC-1簇高表达,而在VEC-2 簇中低表达,后者的细胞群处于EndMT状态,其中内皮特异性标志基因PECAM1和TIE1的表达显著减少,说明PALMD 可能参与内皮细胞特性的维持。通过PALMD 敲低可促进静息状态和暴露于振荡剪切应力(OSS)中的瓣膜内皮细胞VIM、ACTA2和SNAIL1表达,表明PALMD缺失会加剧OSS诱导的EndMT。
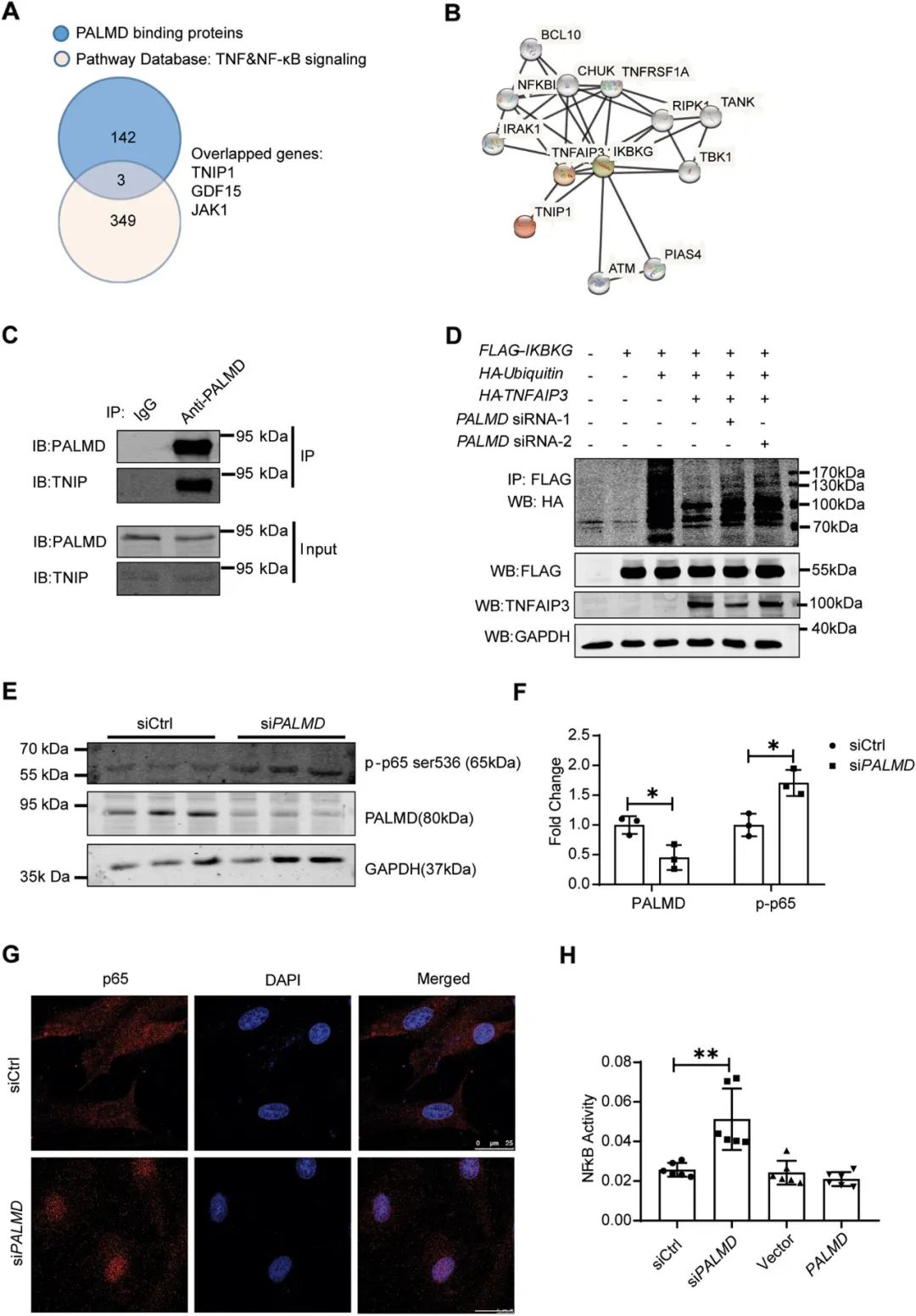
接着,研究者探索了PALMD沉默促进EndMT的机制,通过RNA测序发现TNF和NF-κB信号传导参与其中。既往研究表明,IKBKG泛素化是NF-κB激活的重要步骤,TNFAIP3作为NF-κB通路内源性抑制因子通过去泛素化IKBKG抑制NF-κB活化。TNIP1则与IKBKG和TNFAIP3结合,介导TNFAIP3对IKBKG的去泛素化。该研究通过免疫共沉淀/质谱实验证实了PALMD与TNIP1相互作用,并维持TNFAIP3介导的IKBKG去泛素化和抑制NF-κB转录活性。
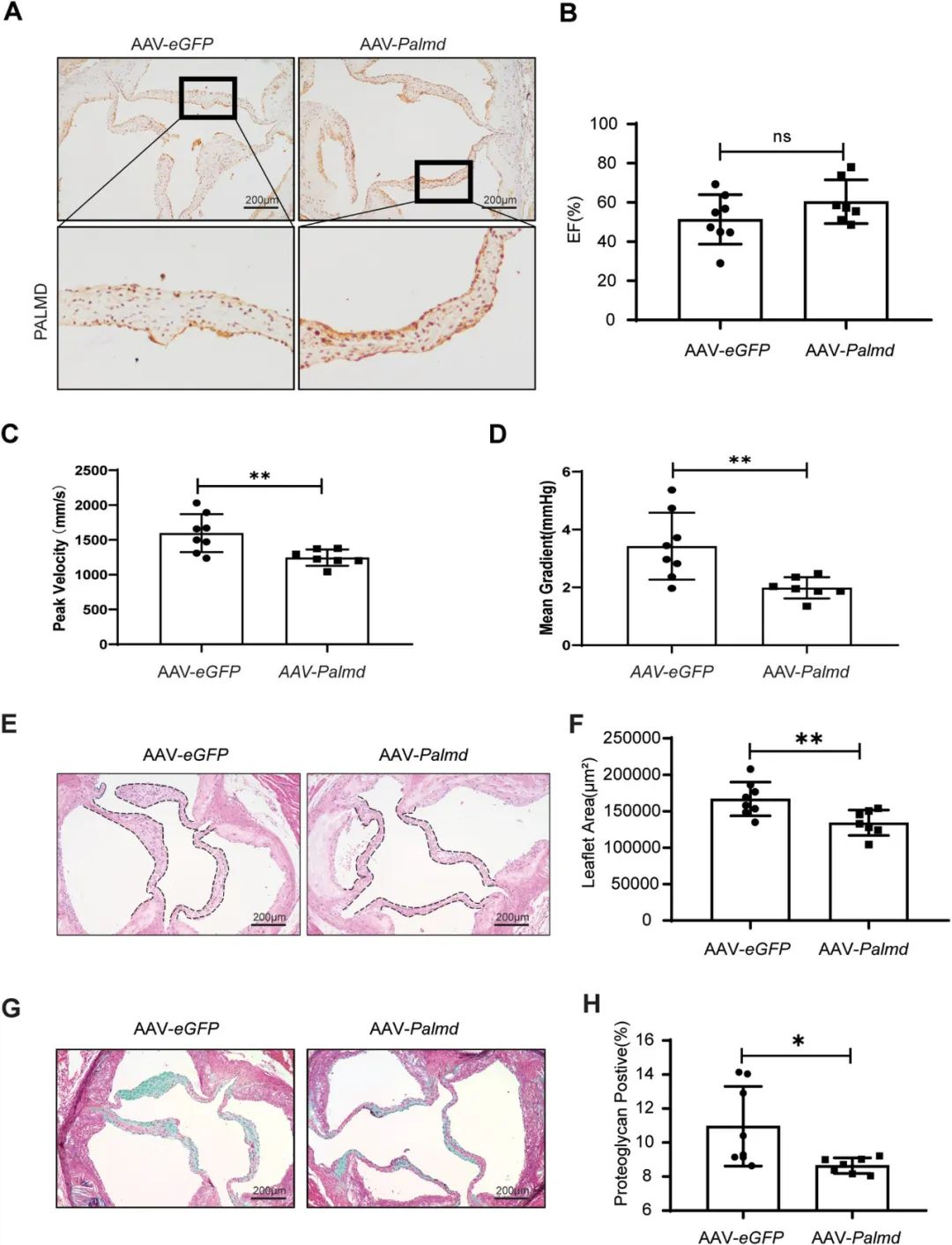
最后,作者在Apoe-/-小鼠的内皮细胞中过表达Palmd基因并给予高脂饮食喂养,证实了过表达Palmd可以降低主动脉瓣峰值速度和平均跨瓣压,并减少主动脉瓣面积和蛋白聚糖沉积。因此,补充内皮细胞的PALMD可以改善主动脉瓣功能并减轻瓣膜纤维化。
综上,本研究发现PALMD通过抑制NF-κB在维持瓣膜内皮稳态中起着至关重要的作用。PALMD缺失活化瓣膜内皮NF-κB信号促进EndMT过程,导致瓣膜病理重塑和功能下降。本研究首次在小鼠体内证实易感基因PALMD缺失导致CAVD的发生,并且揭示其通过NF-κB调控瓣膜内皮细胞稳态的关键作用。这些发现有助于理解CAVD的发病机制,并为CAVD的防治提供潜在的靶点。
本研究由首都医科大学附属北京安贞医院杜杰教授团队完成。韩迎春副教授为本文第一作者,杜杰教授为通讯作者。该研究获得国家自然科学基金、北京自然科学基金等资助。
原文链接:
https://www.jacc.org/doi/10.1016/j.jacbts.2023.06.004


