【协和医学杂志】SPRY4遗传多态性与中国汉族人群青少年特发性脊柱侧凸相关:一项单中心回顾性研究
时间:2023-08-31 13:47:31 热度:37.1℃ 作者:网络
青少年特发性脊柱侧凸(AIS)是一种以脊柱三维畸形为主要特征的骨科疾病,多发生于10~18岁青少年,其约占所有脊柱侧凸的90%,影响1%~3%青少年的身心健康[1-2]。该病具有一定的遗传倾向性,但具体病因未明,且存在明显的Carter效应,女性发生率约为男性的2~10倍,可能与多基因遗传模式相关,男性需更大的遗传负荷才会发病[3]。
SPRY4基因属于可编码富含半胱氨酸和脯氨酸蛋白质家族的成员之一,具有调控生长发育的作用。本团队前期研究发现,AIS患者骨髓间充质干细胞(MSCs)中SPRY4水平显著下调,敲低SPRY4或SPRY4表达缺失可损害MSCs向成骨细胞分化,导致骨骼发育异常,可能为AIS的诱发因素[4]。
此外,本研究团队在AIS患者MSCs中发现54个既往未被识别的差异性表达的微RNA(miRNA),其可通过多种信号通路调控MSCs分化[5]。由于SPRY4基因单核苷酸多态性(SNP)亦可影响MSCs分化,推测其可能通过与miRNA相结合,进而发挥影响MSCs分化、促进AIS发病的效应。
miRNA主要与3′非编码区(3′UTR)结合[6],此区域不仅可在调节 mRNA 定位方面发挥重要作用[7],同时是调控 mRNA 稳定性、正确时空翻译的重要结构[8],有助于揭示人类疾病和进化的因果关系[9]。本研究针对3′UTR区域位点,首次探究了中国汉族人群SPRY4基因多态性与AIS的相关性,以期为AIS病因学研究提供新的证据。
1 材料与方法
1.1 研究对象
本研究为回顾性分析,研究对象为2017年12月—2021年12月北京协和医院AIS患者及健康受试者。
AIS患者纳入标准:(1)依据临床表现及正侧位X线片确诊为AIS且Cobb角>20°;(2)发病年龄为10~18岁;(3)中国北方地区(黄河以北的区域,如河北省、山东省、山西省、北京市和天津市等)汉族人群。
排除标准:(1)合并其他原因导致的脊柱畸形;(2)影像学资料不完整;(3)合并影响骨骼发育的慢性疾病。
健康受试者纳入标准:(1)体检健康,无研究相关疾病;(2)中国北方地区汉族人群;(3)按照年龄、性别与AIS患者进行1:1匹配。排除标准:(1)全脊柱X线片、MRI等影像学资料不完整者;(2)合并影响骨骼发育的慢性疾病。
本研究已通过北京协和医院伦理审查委员会审批(审批号:JS-3403),并豁免患者知情同意。
1.2 研究方法
收集AIS患者的AIS分型及AIS患者与健康受试者年龄/性别信息、SPRY4基因测序结果。AIS主流的手术分型包括King分型、Lenke分型及PUMC分型,其中以PUMC分型的可信度和可重复性最佳,且适合脊柱三维矫形,其将AIS分为Ⅰ型(单弯)、Ⅱ型(双弯)和Ⅲ型(三弯)[10]。本研究根据全脊柱X线片,记录AIS患者的PUMC分型。
SPRY4基因检测方法:(1)样本收集:采集空腹外周静脉血2 mL置于EDTA抗凝管中,-80 ℃保存备用。(2)基因组提取及测序:采用酚-氯仿抽提法提取全基因组DNA,并溶于TE缓冲液。基因组DNA经Nano Drop分光光度计测定纯度和浓度后,采用全基因组测序方法对SPRY4基因rs3797053、rs10040443位点SNP进行分型检测,记录各位点等位基因频率、基因型、遗传模式等,所有测序工作均由深圳华大基因科技有限公司完成。
1.3 样本量估算
本研究为病例对照研究,以C等位基因频率作为主要观测指标进行样本量估算。检索国家生物技术信息中心数据库(https://www.ncbi.nlm.nih.gov/snp/?term=)后发现,AIS患者rs10040443位点等位基因C的频率为8.4%,而健康人群仅为5%,在检验水准a=0.05,把握度为90%,样本比例为1:1的情况下,经计算两组所需最低样本均为97例。
1.4 统计学处理
采用SPSS 25.0软件进行统计学分析。等位基因频率、基因型、PUMC分型等计数资料以频数(百分数)表示,组间比较采用卡方检验或Fisher精确概率法。采用卡方检验进行Hardy Weinberg遗传平衡检验。采用多因素Logistic回归法分析SPRY4基因rs3797053、rs10040443位点SNP与AIS的关联性。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入与排除标准的AIS 患者97例,健康受试者100名。健康受试者中,男性15例,女性85例;平均年龄(14.48±1.13)岁;SPRY4基因rs3797053、rs10040443位点均符合Hardy Weinberg遗传平衡定律(P均>0.05),提示各位点基因分布处于平衡状态,样本具有代表性。AIS 患者中,男性13例,女性84例;平均年龄(14.45±1.11)岁;rs10040443基因型频率分布偏离Hardy Weinberg遗传平衡定律,提示与疾病易感性存在关联。
2.2 SPRY4基因rs3797053、rs10040443位点基因型及等位基因分布与AIS的关联性
AIS患者rs10040443位点等位基因C及CC基因型频率均高于健康受试者(P 均<0.05),rs3797053位点等位基因频率及基因型分布与健康受试者均无显著差异(P 均>0.05),见表1。
表1 AIS患者与健康受试者SPRY4基因rs3797053、rs10040443位点基因型及等位基因分布比较[n(%)]

进一步采用多因素Logistic回归分析校正性别因素后发现,在各种遗传模式下,rs3797053位点多态性与AIS均无明显关联性(表2);
表2 校正性别因素后,SPRY4基因rs3797053位点与AIS的关联性分析[n(%)]
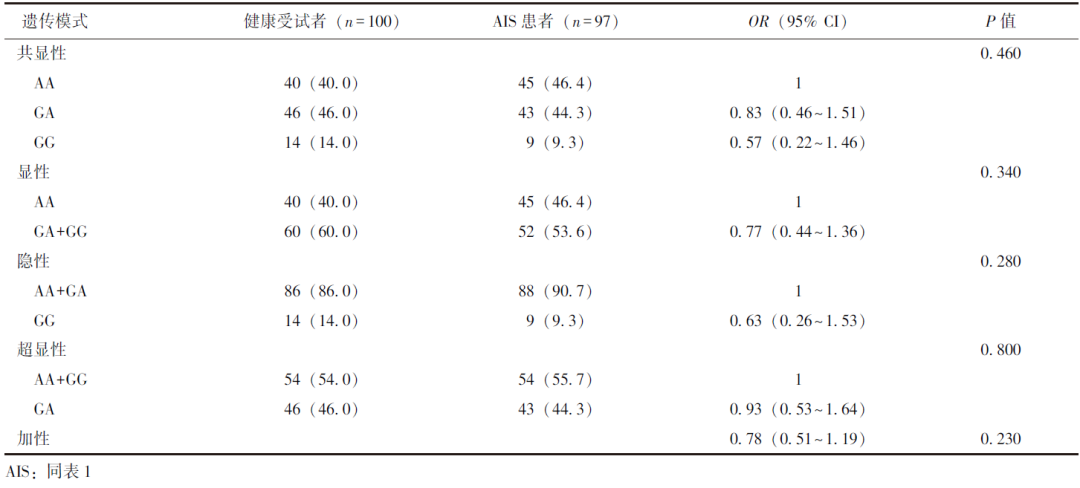
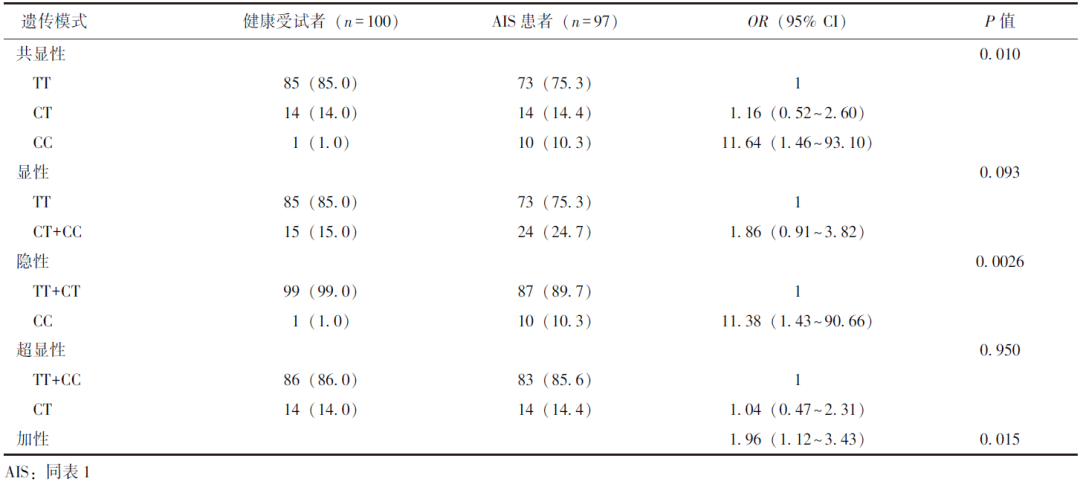
在共显性、隐性及加性遗传模式下,rs10040443位点多态性与AIS存在关联性,其CC基因型可增加AIS发生风险(表3)。
表3 校正性别因素后,SPRY4基因rs10040443位点与AIS的关联性分析[n(%)]
2.3 AIS患者SPRY4基因rs3797053、rs10040443位点基因型与性别及PUMC分型的关联性
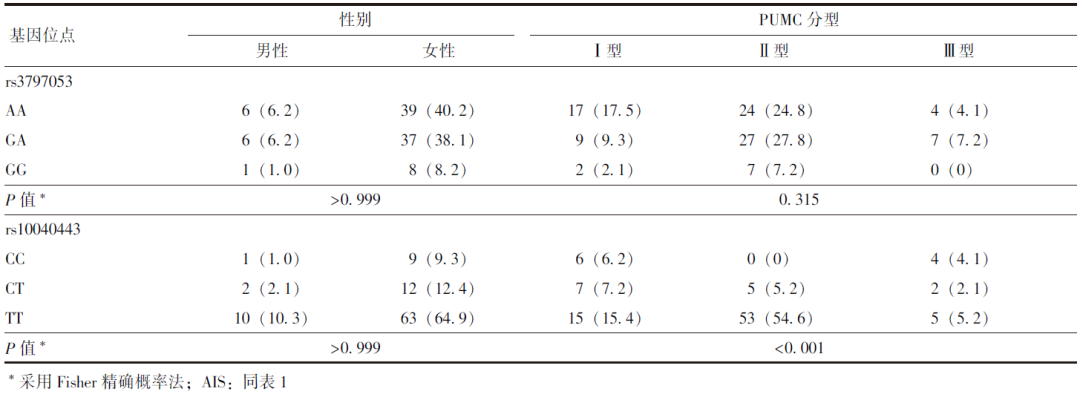
AIS患者中,SPRY4基因rs3797053位点基因型分布与性别、PUMC分型均无明显关联性(P 均>0.05);rs10040443位点基因型分布与性别亦无明显相关(P>0.999),但与PUMC分型具有一定关联性(P<0.001),CT+TT基因型患者中PUMC Ⅱ型的比例显著高于CC基因型患者(66.67% 比0,P<0.001),见表4。
表4 不同性别、PUMC分型AIS患者SPRY4基因rs3797053、rs10040443位点基因型分布比较[n(%)]
3 讨论
本研究基于病例对照设计,首次探究了中国北方汉族人群SPRY4基因多态性与AIS的相关性,结果发现AIS患者SPRY4基因rs10040443位点等位基因C及CC基因型频率均较健康受试者升高;校正性别因素后,rs10040443位点在共显性、隐性及加性遗传模式下均与AIS具有关联性,该位点CC基因型与AIS发生风险增加有关。
在SPRY4基因多态性与性别、AIS临床表型相关性的分析中发现,rs10040443位点基因型与PUMC分型亦存在一定关联性,提示SPRY4基因rs10040443位点可能参与了AIS发病,为该病的病因学研究提供了新思路。
SPRY可通过特异性抑制成纤维细胞生长因子(FGF)受体、表皮生长因子(EGF)受体和血管内皮生长因子(VEGF)受体活性,在人类胚胎干细胞增殖与存活的调控中发挥重要作用。
目前已知的SPRY家族由SPRY1、SPRY2、SPRY3及SPRY4组成[11-13],其中SPRY1 和 SPRY2 编码蛋白是晶状体囊泡分离和角膜分化的必需物质,SPRY3参与丝裂原活化蛋白激酶(MAPK)通路的负性调控[14]。
SPRY4基因位于5q31.3,由5个外显子组成,其编码蛋白为受体转导的MAPK信号通路抑制剂,并可破坏活性单体GTP结合蛋白(GTP-RAS)的形成。
研究显示,SPRY4 是人类胚胎干细胞中表达最高的两个Sprouty 家族成员之一[15-18]。在不同类型细胞中,SPRY4调控生长因子信号的应答效应存在差异[19]。
Li等[20]研究发现,SPRY4在体内与体外对人脂肪源性间充质干细胞(hAMSCs)的脂肪形成均有促进作用。与之不同,沉默C57BL/6小鼠骨髓中SPRY4表达可阻断脂肪堆积,该现象或可解释AIS患者体脂率普遍较低的原因[21]。由于肌肉和脂肪含量增加分别可将脊柱侧凸发生风险降低20%和13%[22],而SPRY4蛋白可调控脂肪形成,故推测其与AIS具有一定相关性。
此外,成骨细胞和软骨细胞分化功能障碍可能是AIS的促进因素,敲低健康人群软骨细胞中SPRY4基因可引起软骨细胞肥大、衰老、活性降低,并促进活性氧和细胞外基质表达,进而导致脊柱两侧软骨生长板生长速度不一致,诱发AIS[23]。
既往文献已证实,3′UTR区域可与miRNA相结合发挥骨骼生长发育调控作用。如Song等[24]研究发现,rs4148941位点(A等位基因)转录物与miR-513a-5p的相互作用可能与腰椎间盘退变具有一定关联性。FGF2的3′UTR区域中存在与中国人群骨矿物质密度相关的位点,且其功能受miR-196a-3p的调节[25]。检索文献未发现SPRY4基因多态性与AIS关联性的相关研究。
本研究以rs3797053与rs10040443位点为切入点,首次在中国汉族人群中探究了SPRY4 基因多态性与AIS的关联性。此两个位点均位于3′UTR区域,且次要等位基因频率均大于5%。单因素分析显示,rs3797053位点等位基因频率及基因型分布在AIS患者与健康受试者之间无显著差异,AIS患者rs10040443位点等位基因C及CC基因型频率高于健康受试者,提示rs10040443位点可能与AIS发病具有相关性;校正混杂因素后此种相关性仍存在,认为rs10040443位点CC基因型可能增加AIS发生风险。
准确的AIS分型是制订临床治疗决策的前提和基础。AIS 主要包括三大分型系统,即King 分型、Lenke分型及PUMC分型,其中PUMC分型更适合指导AIS患者进行三维矫形[26]。本研究发现AIS患者SPRY4基因rs10040443位点CC+TT基因型与PUMC Ⅱ型具有一定关联性,CC+TT基因型的AIS患者更可能表现为PUMC Ⅱ型。由于AIS由多个基因调控且受多个环节、多种因素的影响,这可能从理论层面解释了AIS患者存在不同程度畸形的原因。
本研究局限性:(1)虽然初步认为SPRY4基因rs10040443位点多态性与AIS具有相关性,但目前尚缺乏足够的分子机制研究证据,二者是否具有因果关系尚需进一步验证。(2)AIS患儿在10~18岁期间,其脊柱畸形分型呈现为动态演变的状态,本研究PUMC分型仅为其中一个时间点的静态影像结果,以致研究结果可能存在偏倚。(3)本文研究对象均为中国北方汉族人群,结果外推需谨慎。
综上所述,SPRY4基因rs10040443位点多态性可能与中国北方地区汉族人群AIS具有相关性,该位点CC基因型可能为AIS的危险因素。此外,CT+TT基因型与PUMC Ⅱ型亦具有一定相关性,若AIS患者基因检测结果为CT+TT基因型,则其后期进展为PUMC Ⅱ型的风险增加,该基因位点有望成为预测AIS进展情况的参考指标,并辅助临床进行早期干预。本研究结果有助于明确SPRY4基因多态性与中国汉族人群 AIS 易感性的关系,为该病的病因学研究提供了新思路,并为临床干预提供了依据。
参考文献
[1]Shere C, Clark EM. Systematic review of the association between isolated musculoskeletal hypermobility and adolescent idiopathic scoliosis[J]. Arch Orthop Trauma Surg, 2022. doi: 10.1007/s00402-022-04508-z.
[2]Marya S, Tambe AD, Millner PA, et al. Adolescent idiopathic scoliosis: a review of aetiological theories of a multifactorial disease[J]. Bone Joint J, 2022, 104: 915-921.
[3]Kruse LM, Buchan JG, Gurnett CA, et al. Polygenic threshold model with sex dimorphism in adolescent idiopathic scoliosis: the Carter effect[J]. J Bone Joint Surg Am, 2012, 94: 1485-1491.
[4]Li J, Li N, Chen Y, et al. SPRY4 is responsible for pathogenesis of adolescent idiopathic scoliosis by contributing to osteogenic differentiation and melatonin response of bone marrow-derived mesenchymal stem cells[J]. Cell Death Dis, 2019, 10: 805.
[5]Hui S, Yang Y, Li J, et al. Differential miRNAs profile and bioinformatics analyses in bone marrow mesenchymal stem cells from adolescent idiopathic scoliosis patients[J]. Spine J, 2019, 19: 1584-1596.
[6]Zhang R, Su B. Small but influential: the role of microRNAs on gene regulatory network and 3′UTR evolution[J]. J Genet Genomics, 2009, 36: 1-6.
[7]Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120: 15-20.
[8]Navarro E, Mallén A, Hueso M. Dynamic Variations of 3′UTR Length Reprogram the mRNA Regulatory Landscape[J]. Biomedicines, 2021, 46:48-56.
[9]Griesemer D, Xue JR, Reilly SK, et al. Genome-wide functional screen of 3′UTR variants uncovers causal variants for human disease and evolution[J]. Cell, 2021, 184: 5247-5260.
[10]Liu G, Liu S, Li X, et al. Genetic polymorphisms of PAX1 are functionally associated with different PUMC types of adolescent idiopathic scoliosis in a northern Chinese Han population[J]. Gene, 2019, 688:215-220.
[11]Nguyen-Chi ME, Bryson-Richardson R, Sonntag C, et al. Morphogenesis and cell fate determination within the adaxial cell equivalence group of the zebrafish myotome[J]. PLoS Genet, 2012, 8: e1003014.
[12]Sutherland D, Samakovlis C, Krasnow MA. Branchless encodes a Drosophila FGF homolog that controls tracheal cell migration and the pattern of branching[J]. Cell, 1996, 87: 1091-1101.
[13]Wells KL, Gaete M, Matalova E, et al. Dynamic relationship of the epithelium and mesenchyme during salivary gland initiation: the role of Fgf10[J]. Biol Open, 2014, 3: 677.
[14]Kuracha MR, Burgess D, Siefker E, et al. Spry1 and Spry2 are necessary for lens vesicle separation and corneal differentiation[J]. Invest Ophthalmol Vis Sci, 2011, 52: 6887-6897.
[15]Casci T, Vinós J, Freeman M. Sprouty, an intracellular inhibitor of Ras signaling[J]. Cell, 1999, 96: 655-665.
[16]Plotnik JP, Budka JA, Ferris MW, et al. ETS1 is a genome-wide effector of RAS/ERK signaling in epithelial cells[J]. Nucleic Acids Res, 2014, 42: 11928-11940.
[17]Yang X, Gong Y, Tang Y, et al. Spry1 and Spry4 differentially regulate human aortic smooth muscle cell phenotype via Akt/FoxO/myocardin signaling[J]. PLoS One, 2013, 8: e58746.
[18]Felfly H, Klein OD. Sprouty genes regulate proliferation and survival of human embryonic stem cells[J]. Sci Rep, 2013, 3:2277.
[19]Sasaki A, Taketomi T, Wakioka T, et al. Identification of a dominant negative mutant of Sprouty that potentiates fibroblast growth factor- but not epidermal growth factor-induced ERK activation [J]. J Biol Chem, 2001, 276: 36804-36808.
[20]Li N, Chen Y, Wang H, et al. SPRY4 promotes adipogenic differentiation of human mesenchymal stem cells through the MEK-ERK1/2 signaling pathway[J]. Adipocyte, 2022, 11: 588-600.
[21]Tian L, Xiao H, Li M, et al. A novel Sprouty4-ERK1/2-Wnt/β-catenin regulatory loop in marrow stromal progenitor cells controls osteogenic and adipogenic differentiation[J]. Metabolism, 2020, 105:154-189.
[22]Wang Y, Li M, Chan CO, et al. Biological effect of dysregulated LBX1 on adolescent idiopathic scoliosis through modulating muscle carbohydrate metabolism[J]. Spine J, 2022, 22: 1551-1565.
[23]Yang Y, Yang M, Shi D, et al. Single-cell RNA Seq reveals cellular landscape-specific characteristics and potential etiologies for adolescent idiopathic scoliosis[J]. JOR Spine, 2021, 4: e1184.
[24]Song YQ, Karasugi T, Cheung KM, et al. Lumbar disc degeneration is linked to a carbohydrate sulfotransferase 3 variant[J]. J Clin Invest, 2013, 123: 4909-4917.
[25]Zhu DL, Guo Y, Zhang Y, et al. A functional SNP regulated by miR-196a-3p in the 3′UTR of FGF2 is associated with bone mineral density in the Chinese population[J]. Hum Mutat, 2017, 38: 725-735.
[26]邱勇, 朱泽章, 朱锋, 等. 青少年特发性脊柱侧凸King、Lenke和PUMC(协和)分型的可信度和可重复性比较及意义[J].中华骨科杂志,2007, 10: 748-752.


