厦门大学任磊、周樨团队《AFM》:基于聚(五氢嘧啶)的杂化水凝胶,可高效治疗糖尿病足溃疡!
时间:2023-08-06 15:32:33 热度:37.1℃ 作者:网络
细菌感染和血管生成受损使糖尿病足溃疡(DFU)的治疗极具挑战性。阳离子聚合物由于其优异的抗菌性能有望治疗感染伤口,但由于其结构单元简单,合成方法过时,仍难以满足促血管生成和抗感染的治疗需求。厦门大学任磊、周樨合成了具有强可修饰性的阳离子聚五氢嘧啶(PPHP)库,构建具有协同治疗效果的杂化水凝胶,用于治疗感染的DFU。研究发现,合成的杂化水凝胶可以上调血管生成相关基因(HIF-1、VEGF和bFGFR/bFGF)的表达和细菌细胞膜的靶向破坏,最终在10d内促进感染DFU的愈合(伤口愈合率:92%)。因此,这种水凝胶在开发新策略以显着增强DFU和其他细菌感染的病理诊断的治疗方面具有巨大的希望。该研究以题为“Poly(pentahydropyrimidine)-Based Hybrid Hydrogel with Synergistic Antibacterial and Pro-Angiogenic Ability for the Therapy of Diabetic Foot Ulcers”的论文发表在《Advanced Functional Materials》上。

本文通过构建新型聚五氢嘧啶(PPHP)聚合物库阐明了聚嘧啶的构效关系,制备了具有仿生促血管生成和靶向抗菌作用的杂化水凝胶(Fe\PPHP15)用于治疗感染的DFU。水凝胶可以释放PPHP-PEA-NH2\B(OH)2和Fe2+\Fe3+响应酸性环境(pH<5.5)实现细菌感染的根除和上调血管生成相关基因(HIF-1、VEGF和bFGFR/bFGF)表达,最终在10天内促进了感染DFU的愈合(伤口愈合率≈92%)。
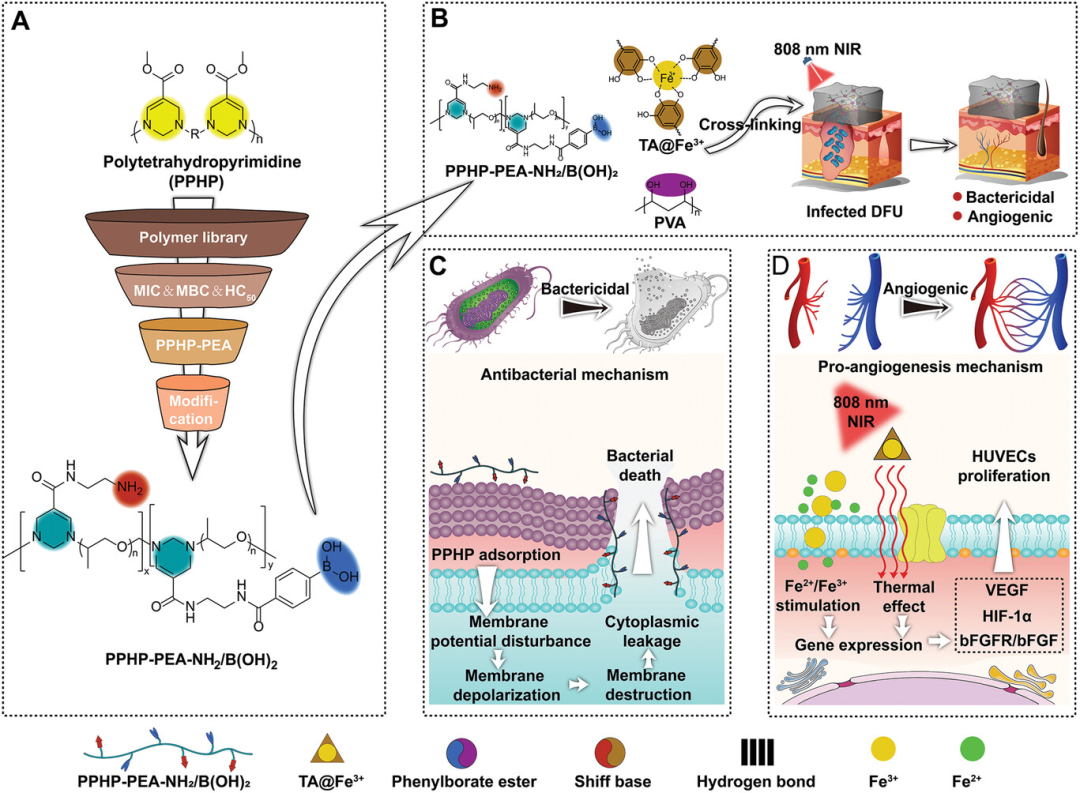
方案1. PPHP及Fe\PPHP水凝胶协同治疗机制
【PPHP库的结构表征】
抗菌能力对于治疗细菌感染的DFU至关重要。为此,合成了PPHP聚合物,并以特定的方式组织它们,以简化抗菌聚合物的筛选。PPHP采用一锅法合成然后用胺和苯硼酸基团(-NH2/B(OH)2),以提高抗菌能力和生物相容性。然后,根据主链基团(NH2-R-NH2)和侧基的修改(-NH2和-B(OH)2),以方便标识抗菌分子的选择。事实上,PPHPP-PEA-NH2和PPHP-PEA-NH2/B(OH)2具有比PPHP-PEA更高的正电荷。改善正电性能可以带来更强的抗菌性能。这种抗菌特性可能归因于PPHP通过静电相互作用吸附到电负性的细菌细胞膜上,从而干扰膜电位。
最后,使用高分辨率TEM切片观察PPHP-PEA-NH2/B(OH)2对细菌结构的破坏。正如预期的那样,观察到明显的细胞膜和壁破裂以及细胞质的显着损失。因此,PPHP聚合物的抗菌性能来源于细菌细胞膜电位的干扰和去极化。在用-NH2和-B(OH)2修饰PPHP侧组后,这种抗菌机制得到了增强,可以更有效地积聚在细菌细胞膜上,从而诱发更严重的膜损伤和细胞质渗漏。
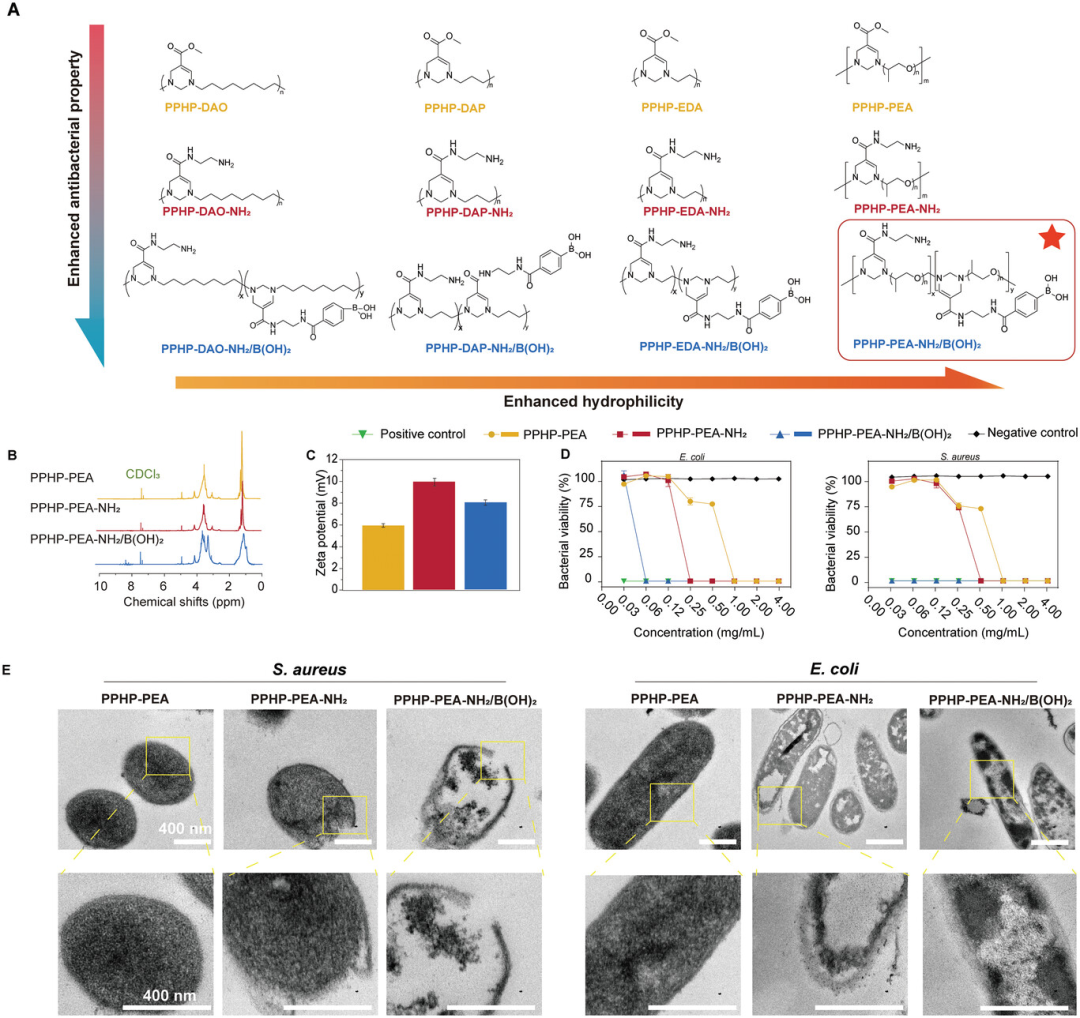
图1. PPHP的结构表征
【Fe\PPHP水凝胶的表征】
将PPHP-PEA-NH2/B(OH)2引入水凝胶并开发新型伤口敷料有助于提高PPHP-PEA-NH2/B(OH)2的治疗效率对抗细菌感染性DFU。因此,一系列具有不同比例PPHP-PEA-NH的水凝胶(Fe\PPHP)2/B(OH)2(以下简称PPHP)。Fe\PPHP水凝胶中存在明显的三维网络结构。单宁酸作为一种多酚化合物,具有良好的还原性能。在两种铁离子存在下(Fe3+)和碱性条件(pH 8.0),单宁酸上的邻苯二酚基团(-OH)被氧化形成醌基团(= O)。氧化后的单宁酸可以与氨基发生席夫碱和迈克尔加成反应,从而实现水凝胶的交联。随着PPHP的加入,胺基和苯硼酸基开始介入交联体系,形成席夫碱键和苯硼酸酯,提高了交联度,减小了孔径。这表明了PPHP作为水凝胶体系中主要交联骨架的成功合成和调控作用。
伤口敷料的机械性能对于DFU的治疗也至关重要,因为较弱的机械性能会使伤口敷料难以应对拉伸,挤压和其他运动。Fe\PPHP15水凝胶比其他水凝胶具有最好的力学性能,这与拉伸强度测试结果一致。出色的自愈性能将使伤口敷料在发生意外损坏时保持其形状和覆盖在伤口上。Fe\PPHP15被切成两半后,仍然表现出快速的自我修复。这表明,水凝胶丰富的动态化学键(希夫碱基键和硼酸苯键)使其能够在破碎时迅速恢复其形状,并随着时间的推移保持敷料的能力。
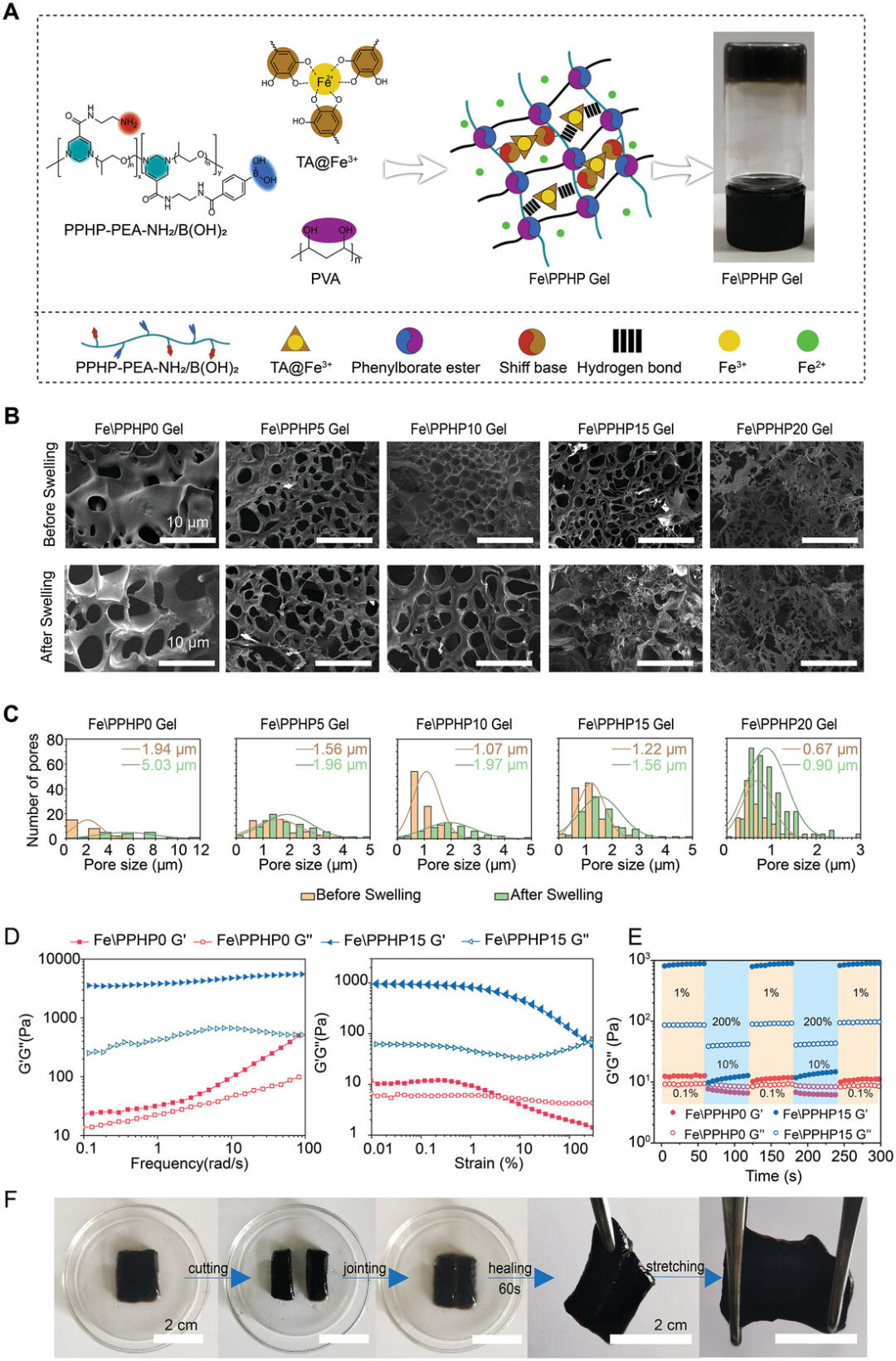
图2. Fe\PPHP水凝胶的表征
【光热性能】
“温泉”仿生效应的基础之一是温和的热量(30-50°C)。Fe\PPHP水凝胶的光热效应由TA@Fe3+介导。因此,TA@Fe3+的含量直接影响Fe\PPHP的光热强度。结果表明,TA/Fe3+可以调控Fe\PPHP水凝胶的光热性能。更重要的是,当TA/Fe3+含量为2.0%,Fe\PPHP15水凝胶具有最合适的光热效应,可用于实现“温泉”仿生刺激治疗DFU。
降解和释放特性是“温泉”模拟促血管生成和协同杀菌作用的关键。由于Fe / PPHP水凝胶的大量席夫碱和苯硼酯键。这种交联体系可以使水凝胶在酸性环境中破碎,释放PPHP和Fe离子,实现酸触发释放。鉴于受感染伤口微环境的酸性组成,这种酸响应控释方法对于伤口敷料非常有趣。
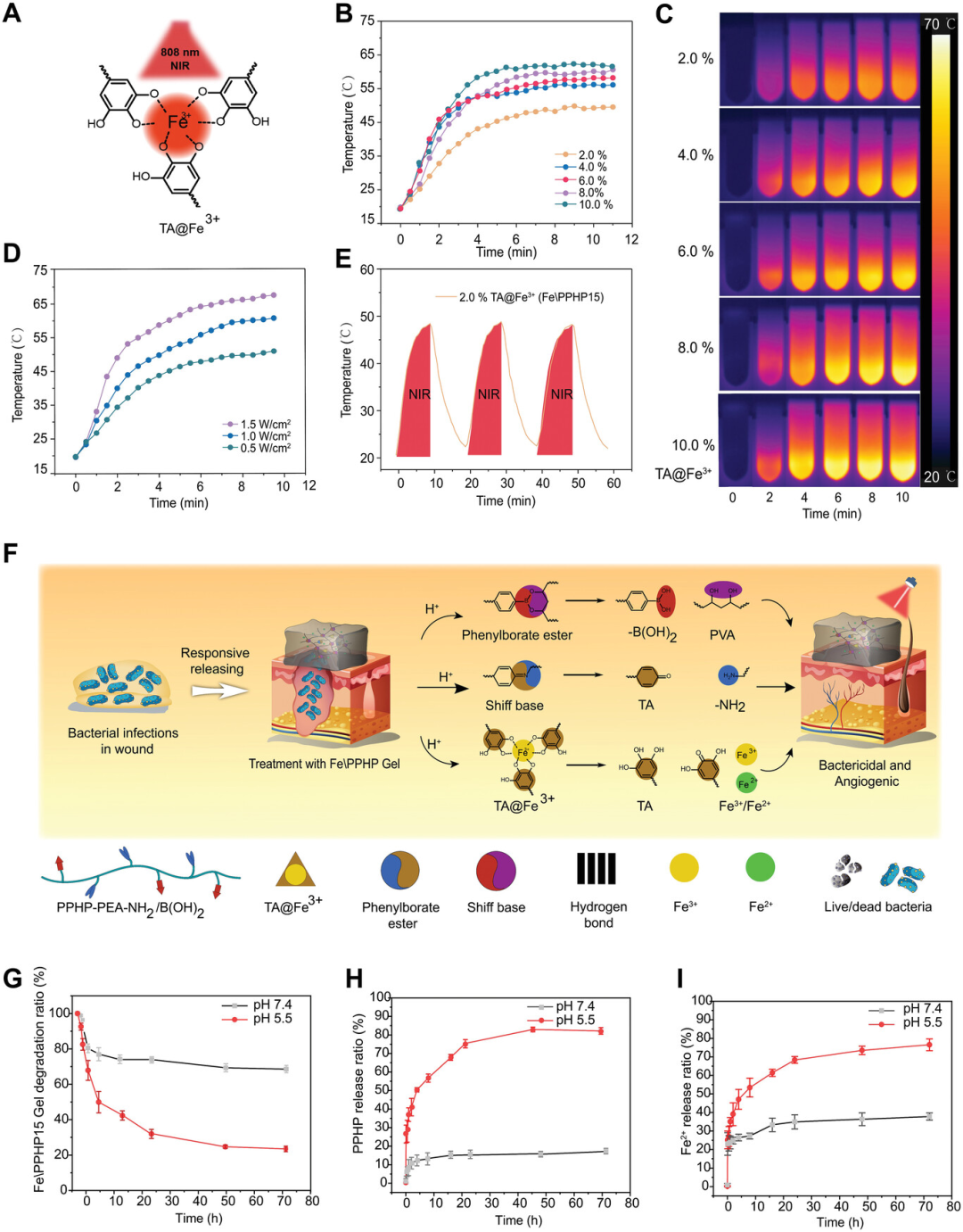
图3. 光热性能
【体外“温泉”促血管生成评估】
高血糖抑制可调节的血管生成相关基因(HIF-1、VEGF 和 bFGFR/bFGF)的表达,这些基因对伤口愈合至关重要,从而直接预防伤口血管生成。血管生成受损阻碍伤口获得必要的营养和氧气,创造一个鼓励细菌定植的环境,并产生大量炎症细胞因子,破坏伤口的细胞外基质。因此,用于治疗DFU的有效伤口敷料应既能诱导血管生成,又应具有优异的抗菌活性。Fe\PPHP15水凝胶已被证明在体外具有良好的降解、离子释放和光热性能,已经满足了实现“温泉”促血管生成作用的先决条件。Fe\PPHP15凝胶在808 nm NIR(0.5 W cm−2)下实际上可以激活不同的血管生成信号通路),以促进VEGF,HIF-1α和bFGF / bFGFR在HUVEC中的表达。
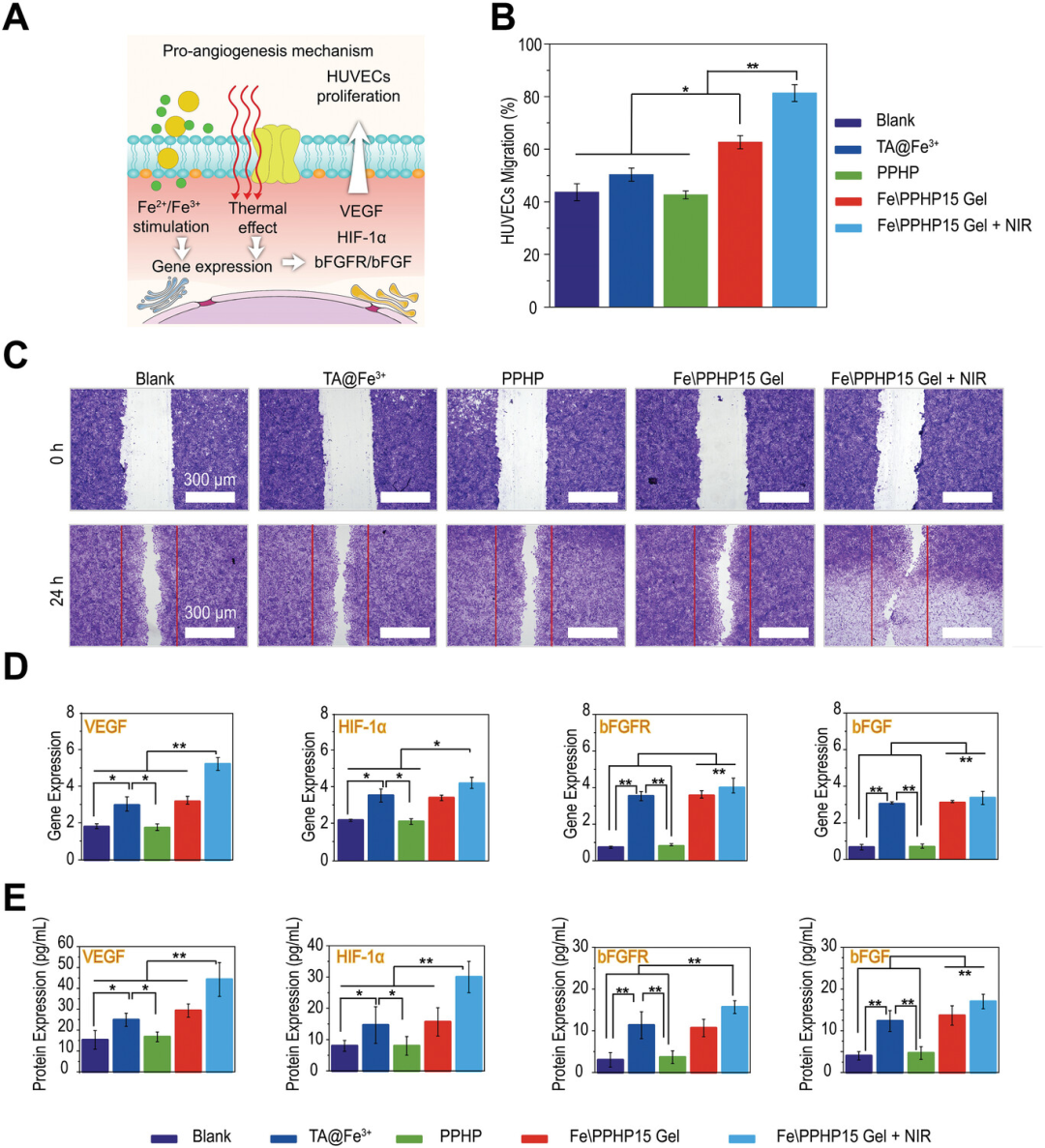
图4. Fe\PPHP15在体外的促血管生成机制
【体外协同抗菌效果评价】
优良的抗菌效果是伤口敷料保证细菌感染DFU修复的重要特性。在热效应下,PPHP可以扩散到细菌表面。此外,PPHP侧链上修饰的硼酸苯基团可以对细胞壁上的肽聚糖形成特异性靶向。这两个因素可以有效地破坏细菌的细胞膜结构,导致细胞质的损失和细菌的死亡。正如预期的那样,Fe\PPHP15 + NIR组对大肠杆菌和金黄色葡萄球菌具有最佳的抗菌能力。与未处理组相比,Fe\PPHP15组细菌局部细胞壁和细胞膜明显消融,伴有一定的细胞质损失。值得注意的是,在Fe\PPHP15 + NIR组中观察到细菌内部的大空白区域,细胞壁和细胞膜受损更严重,归因于PPHP的细菌靶向能力。这些结果表明,水凝胶具有优异的协同抗菌效果,具有成为DFU创面敷料的优良潜力。
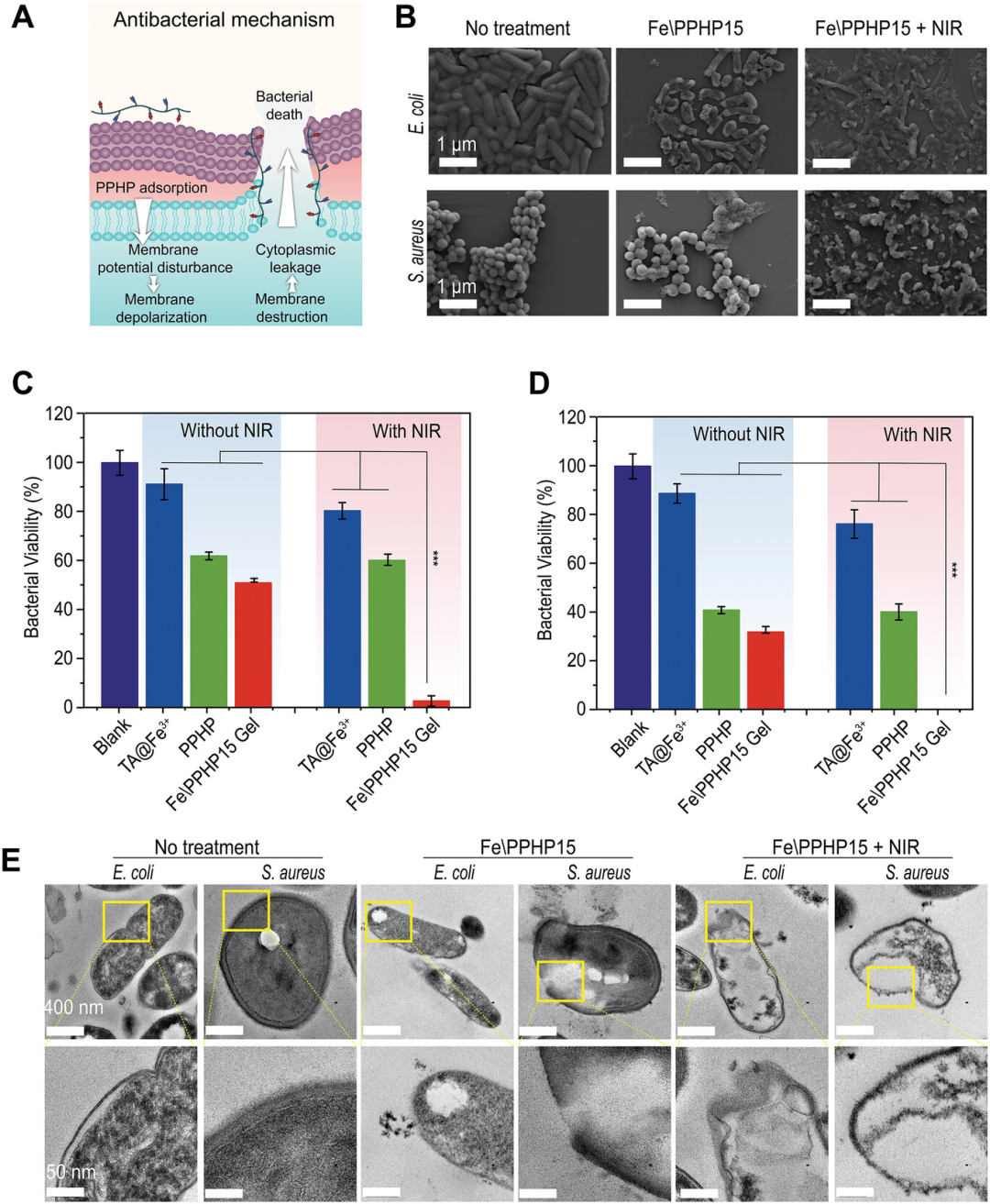
图5. 体外协同抗菌效果评价
【感染DFU体内伤口愈合评估】
优异的体外实验结果更加确信水凝胶可以在DFU上实现有希望的治疗效果。在体内实验中, Fe/PPHP水凝胶的动态交联键,包括希夫碱、苯硼酸酯键和配位键,表现出对伤口微环境中H+裂解的响应。这种相互作用促使水凝胶的3D网络结构逐渐瓦解。这种结构完整性的转变促使水凝胶在体内从凝胶状态转变为溶胶状态。在整个过程中,PPHP和Fe离子逐渐释放,从而促进了完整的处理周期。
高血糖抑制可调节血管生成相关基因(HIF-1、VEGF 和 bFGFR/bFGF)的表达,导致空白组中的毛细血管数量远低于TA@Fe3+由于Fe离子的促血管生成能力。然而,在Fe\PPHP15组和Fe\PPHP15+NIR组中观察到毛细血管数量显着减少。这归因于在氧气需求减少的重塑阶段的血管退化。同样,在伤口重塑阶段,从表皮组织到角质层的转化导致表皮和肉芽组织减少,毛囊数量增加。这些结果表明,具有协同治疗效果的Fe\PPHP15水凝胶在治疗感染性糖尿病足溃疡方面具有惊人的潜力。
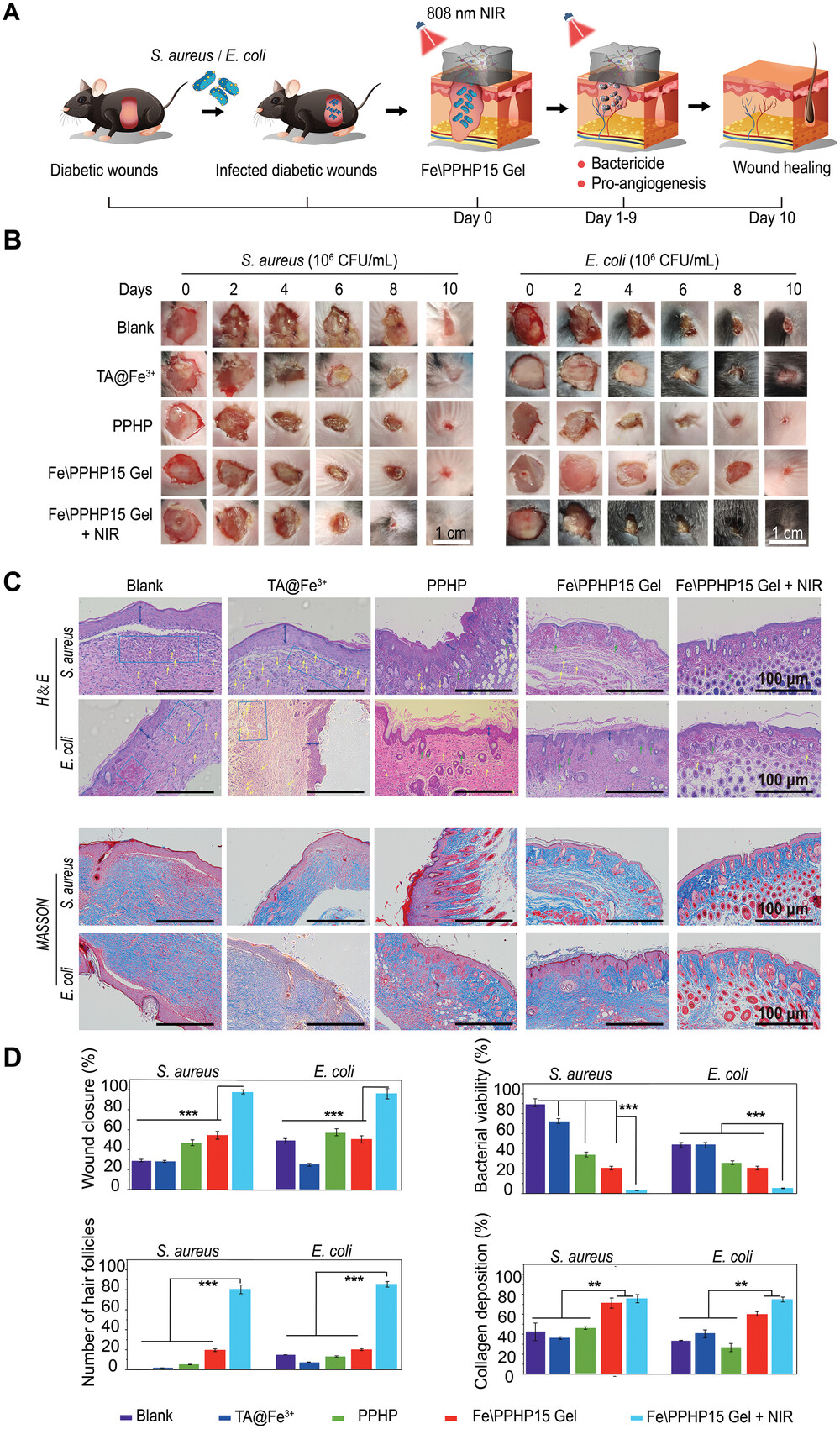
图6. 体内感染糖尿病伤口的治疗示意图
【小结】
该研究筛选了一个聚(五氢嘧啶)库,以获得一个标志聚合物PPHP-PEA-NH2/B(OH)2具有靶向破坏细菌细胞膜的能力。此外,PPHP-PEA-NH2/B(OH)2用于构建具有协同治疗效果的杂化水凝胶Fe/PPHP15,用于治疗感染的DFU。该杂交水凝胶可上调血管生成相关基因(HIF-1、VEGF和bFGFR/bFGF)表达,靶向破坏细菌细胞膜,促进感染DFU在10愈合(伤口愈合率≈92。本工作为感染性糖尿病足溃疡的临床范例提供了有效的治疗策略。
原文链接:
https://doi.org/10.1002/adfm.202303147


