JAMA Oncol:基于31基因的AI模型实现对结直肠癌-肝转移的精准分型
时间:2023-08-04 17:29:07 热度:37.1℃ 作者:网络
一旦癌症扩散到身体的其它部位(即转移),其治疗将更具挑战性。结直肠癌(CRC)的一个主要转移部位是肝脏,大约25%的CRC患者最终会发生肝转移,这部分患者往往生存率较差。接受手术切除有限肝转移(即寡转移)患者的5年无病生存率为20%至25%,总生存率(OS)为30%至40%。寡转移性CRC表现出广泛的临床行为,迫切需要找到预后生物标志物来改善风险分层并促进个性化围手术期CRC全身治疗的选择。
近日,来自美国芝加哥大学医学院的研究团队及合作者在JAMA Oncology发表了题为“Integrated Clinical-Molecular Classification of Colorectal Liver Metastases: A Biomarker Analysis of the Phase 3 New EPOC Randomized Clinical Trial”的文章。研究团队首次对一个新型的31基因神经网络分类器进行了临床验证,该分类器可以准确预测CRC肝转移分子亚型。该分析证实了综合临床-分子风险分层具有高度的预后预测作用,并证实低风险综合亚组在手术切除后实现了良好的总生存率。这种新的分子分类有望作为CRC肝转移个性化治疗的潜在预测生物标志物。

文章发表在JAMA Oncology
该研究共纳入240名患者,包括训练队列和验证队列。训练队列包括接受治疗的93名患者(图1)。CRC患者因出现有限肝转移而接受肝切除;98%的患者接受了围手术期氟尿嘧啶和铂类化疗。独立的验证队列包括147名参加多中心3期New EPOC随机临床试验的CRC患者(图1),这些患者接受了CRC肝转移的分子分析。可手术CRC肝转移的患者接受了肝切除术,并伴有围手术期化疗。如果患者不适合化疗或有肝外远处转移,则被排除在外。因此,两个队列相似,可以代表因局限性结直肠癌肝转移而接受围手术期全身治疗的患者。
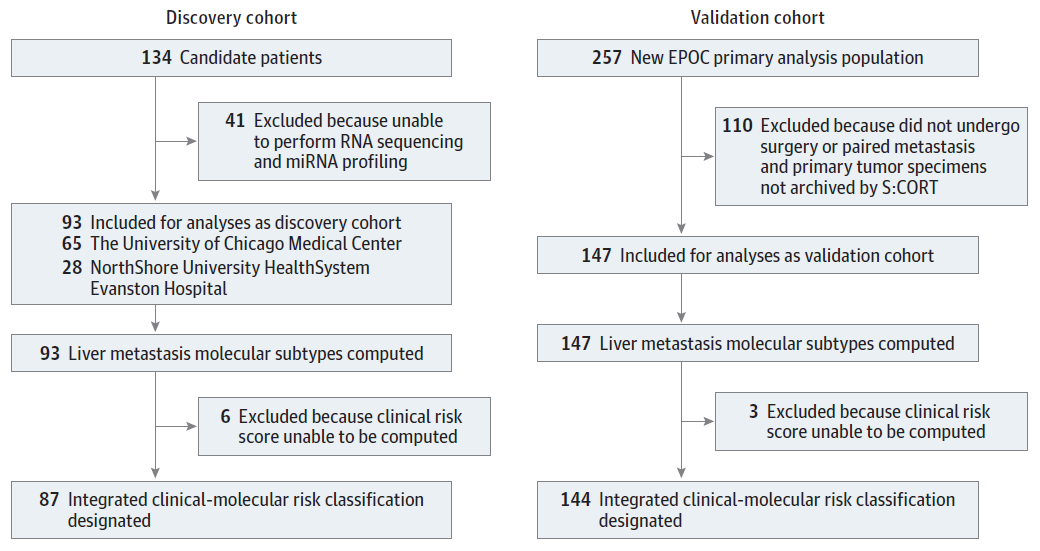
图1. 流程图展示了纳入分析的发现队列和验证队列患者,包括回顾性发现队列和3期New EPOC随机临床试验验证队列。(S:CORT表示结直肠癌联盟的分层)
在发现队列中,研究团队对切除的转移瘤进行RNA测序和微小RNA (miRNA)分析,在验证队列中用微阵列进行mRNA和miRNA分析。基于mRNA和miRNA的表达谱,研究团队训练了一个31基因特征(24个mRNA和7miRNA)的神经网络分类器来预测发现队列中的分子亚型。结果显示,该分类器以96%的准确度预测了CRC的分子亚型(典型、免疫或基质亚型)。
此前,芝加哥大学研究团队发现了CRC肝转移三种不同的分子模式,根据这三种模式,转移瘤被分为典型、免疫或基质亚型。将分子亚型与临床因素相结合时,得到了三个综合风险组,即低风险、中等风险和高风险组。
肝转移的分子亚型用于主要统计分析。为了研究新开发的31基因分类器是否仅适用于CRC肝转移,研究团队还分析了匹配原发肿瘤的亚型,确定了转移瘤和原发肿瘤的共有分子亚型,将其预后表现与研究中的肝转移亚型进行比较。
研究人员分析了验证队列中每个分子亚型的生物表型。在验证队列中,有73例(50%)、28例(19%)和46例(31%)患者被分类为典型、免疫和基质转移。与之前的发现一致,典型亚型的DNA修复途径、细胞周期调节/增殖(包括E2F、G2M和有丝分裂纺锤体途径)和MYC信号传导相对应的富集分数均有所增加。基质亚型表现出上皮-间质转化、血管生成、炎症反应和KRAS信号传导的富集。此外,免疫亚型在KRAS信号、血管生成、细胞增殖和转化生长因子β信号通路方面表现出较低的富集。
在验证队列中,研究人员进行了免疫反卷积分析,按分子亚型评估了特定免疫细胞的丰度(图2B)。结果显示,典型亚型中的大多数免疫细胞减少,免疫亚型则表现出B细胞、NK细胞、CD8 T细胞和细胞毒性淋巴细胞的富集。相比之下,基质亚型的B淋巴细胞和NK细胞耗尽,CD8 T细胞和细胞毒性淋巴细胞背景下成纤维细胞、单核细胞和骨髓树突细胞富集。
虽然免疫亚型和基质亚型之间CD8 T和细胞毒性淋巴细胞的存在相似,但发现队列的组织学评估表明,肿瘤微环境中T细胞的空间分布是不同的。免疫转移瘤表现出密集的带状CD8 T淋巴细胞瘤周和瘤内浸润,基质转移瘤表现出相当高的纤维化,导致瘤周限制性T淋巴细胞浸润,这与基质亚型中成纤维细胞的增加一致。以上发现证实了与每种亚型相关的独特潜在生物表型。
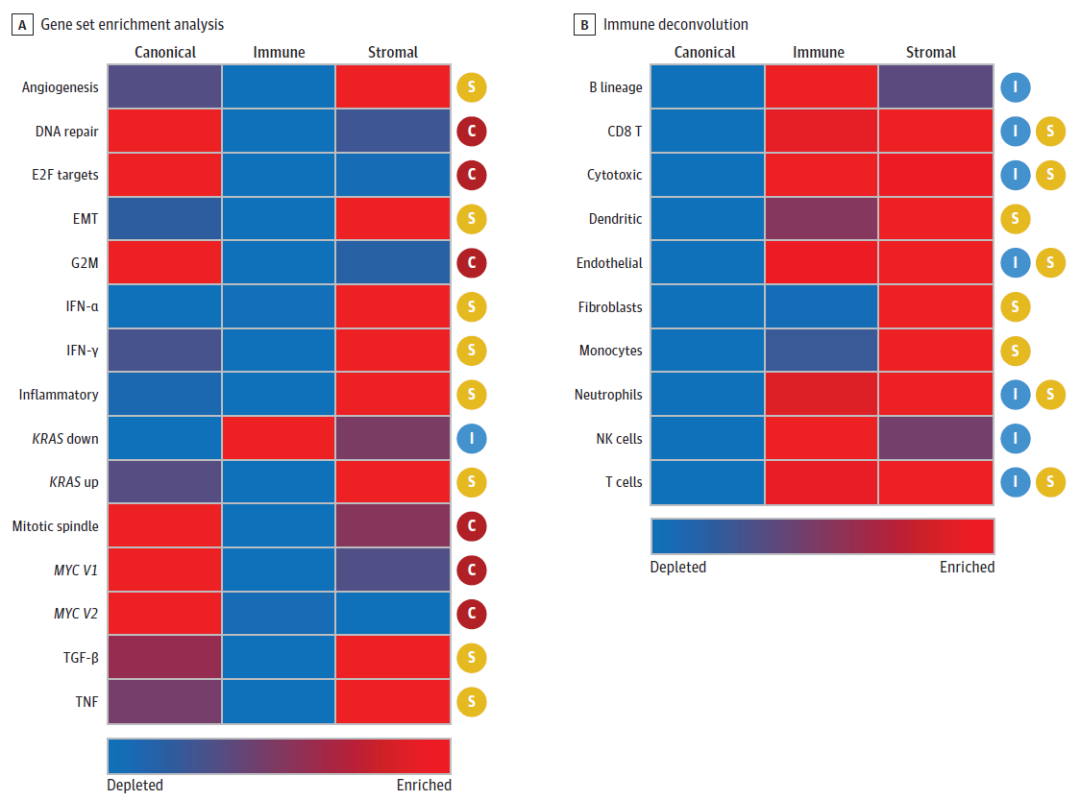
图2. 验证队列中的基因集富集分析和免疫解卷积。
为了验证CRC肝转移的分子亚型和综合临床分子风险分层作为预后生物标志物的效果,在验证队列中,研究人员对无进展生存期(PFS)和OS进行了分析,免疫亚型表现出优于典型亚型和基质亚型的PFS和OS(图3A)。
免疫亚型、典型亚型和基质亚型的5年PFS分别为43%、14%和26%。各亚型PFS的差异具有统计学意义。就总生存率而言,免疫亚型、典型亚型和基质亚型的5年OS分别为63%、43%和49%(图3B)。比较显示,免疫亚型与典型/基质亚型之间的OS具有统计学显著差异(图3B)。
将分子亚型加入到临床风险评分中,PFS的预测从55%提高到62%,OS的预测从59%提高到63%。低风险综合组的5年PFS为44%,OS为78%,分别优于高风险组的16%和43%。
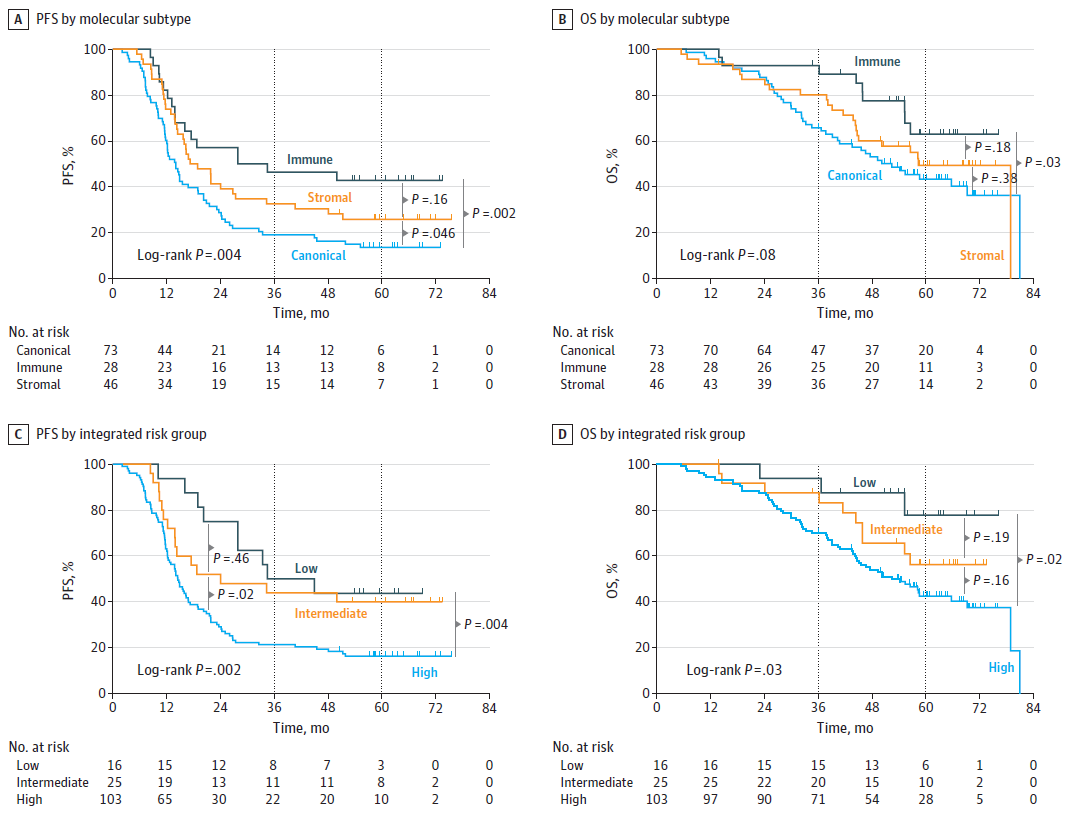
图3. 按分子亚型划分的PFS和OS以及验证队列中的综合风险分层。
综上所述,研究人员开发了一种新的CRC肝转移分类方法,并在多中心3期New EPOC随机临床试验中验证了其预后意义,证实将分子亚型加入综合的临床分子风险分组,对CRC肝转移患者的生存和预后具有高度的预测性。
文章通讯作者、芝加哥大学医学院放射和细胞肿瘤学副教授Sean P. Pitroda博士表示:“我们现在有了第一个经验证的寡转移生物标记物,可以预测CRC患者转移到肝脏的结果。新的研究发现为转移分期和分类提供了一个新框架,这可以通过优化整合局部和系统干预措施来改善患者的个性化治疗。”
他补充道:“虽然我们这些研究是针对CRC转移,但类似的方法也可以应用于其他类型的癌症。我们相信,这将颠覆目前治疗转移性疾病的策略,并为将来设计临床试验和改善患者预后开辟新的机会。”
参考资料:
1.Katipally RR, Martinez CA, Pugh SA, et al. Integrated Clinical-Molecular Classification of Colorectal Liver Metastases: A Biomarker Analysis of the Phase 3 New EPOC Randomized Clinical Trial. JAMA Oncol. Published online July 20, 2023. doi:10.1001/jamaoncol.2023.2535
https://jamanetwork.com/journals/jamaoncology/article-abstract/2807472
2.https://medicalxpress.com/news/2023-07-approach-metastases-patients-colorectal-cancer.html


