Nat Nanotech:靶向肝外组织,器官特异性LNP开启mRNA疗法新时代
时间:2023-01-03 21:01:45 热度:37.1℃ 作者:网络
脂质纳米颗粒(LNP)可用于携带和递送治疗性核酸,如mRNA、siRNA,以及用于基因编辑的CRISPR组分。近几年,LNP递送的mRNA新冠疫苗大获成功。
而在mRNA新冠疫苗之前,研究人员就已经对LNP进行了很长时间的研究,以寻求治疗癌症和遗传疾病的方法,但LNP在静脉注射几乎只定位于肝脏,这限制了LNP在基因治疗中的广泛应用。
如何让LNP靶向肝外组织成为一大研究热点。2020年4月,德克萨斯大学西南医学中心 Daniel Siegwart 教授团队发表论文,提出了一种名为SORT的选择性器官靶向脂质纳米颗粒,将LNP的靶向范围扩展到了肝脏以外器官,解决了LNP肝外靶向难题。

该论文以:Selective organ targeting (SORT) nanoparticles for tissue-specific mRNA delivery and CRISPR–Cas gene editing 为题,发表于Nature Nanotechnology 期刊,程强(现为北京大学未来技术学院研究员)、魏妥(现为中科院动物所研究员)为该论文共同第一作者。
LNP通常包括四种组分,分别是可电离脂质、胆固醇、辅助磷脂和聚乙二醇化脂质,这些组分与mRNA在酸性缓冲液中形成纳米颗粒,共同封装和保护脆弱的mRNA。此外,它们在内涵体的酸性环境中带正电荷,这促进了它们与内涵体膜的融合,将其释放到细胞质中。
在这篇 Nature Nanotechnology 论文中,程强等人在LNP中添加了第五组分——SORT脂质,以改变LNP在体内的器官靶向特性,实现了mRNA对肝脏以外器官的靶向递送。更重要的是,这种SORT-LNP可推广到多种肝外器官组织,实现对肺、肾脏乃至上皮细胞和免疫细胞等的mRNA递送。
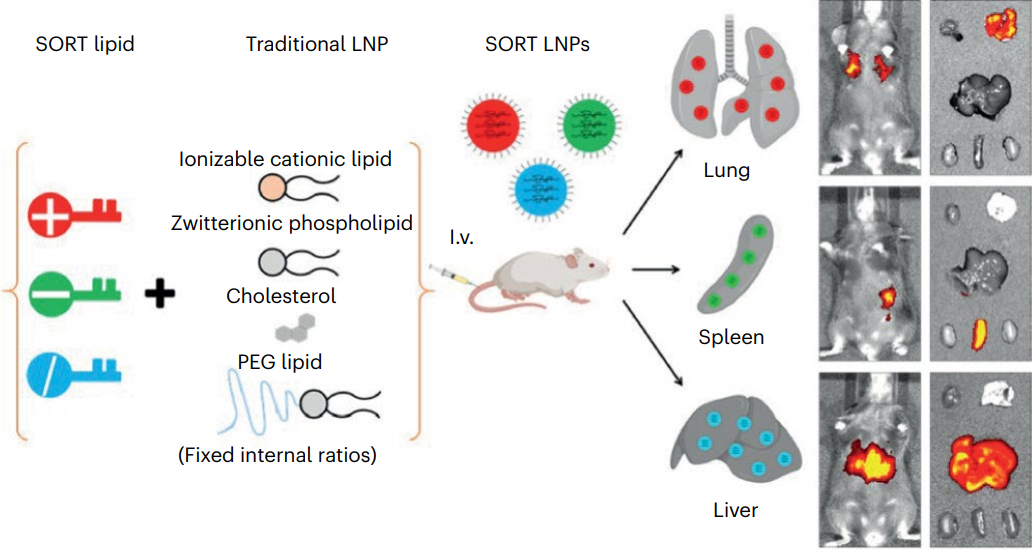
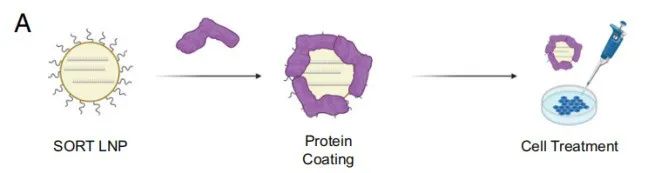
2021年12月,Daniel Siegwart 教授、程强博士等在《美国国家科学院院刊》(PNAS)上发表论文,进一步解析了SORT系统能够实现器官特异性靶向递送的机制。LNP表面PEG脂质的解吸暴露了LNP中的SORT分子。接下来,不同的血清蛋白识别暴露的SORT分子,并吸附在LNP表面。最后,表面吸附蛋白与靶器官中细胞表达的同源受体相互作用,以促进mRNA递送。
值得注意的是,在 Nature Nanotechnology 论文中,程强等人绕过细胞培养实验直接进行了动物实验,这偏离了纳米颗粒在生物医学应用中的传统教条。但事实证明,这一大胆举动是必要的,因为细胞培养不能完全实现活体动物模型的复杂性,例如,在体外培养的细胞中没有血浆成分,也就没有其中的血清蛋白,而血清蛋白吸附在SORT-LNP周围是其实现器官特异性靶向的关键。
SORT系统的另一个关键特性是,原则上它可以将用于治疗的遗传物质递送到目标器官内的特定细胞,也就是实现细胞特异性靶向。例如,一剂靶向肺部的SORT-LNP,能够靶向肺部约40%的上皮细胞和65%的内皮细胞。这意味着能够在与治疗特定疾病相关的特定细胞类型中进行基因编辑。
Daniel Siegwart 教授他的团队目前正在探索如何将SORT-LNP递送到其他几个器官和组织,例如骨髓、淋巴结、肾脏和胰腺等。与此同时,他们也在推动SORT-LNP的临床应用。基于SORT-LNP系统的初创公司 ReCode Therapeutics 已经完成了逾2亿美元的融资,目前正在推进中枢神经系统、肝脏和肿瘤领域的研究。

据悉,基于SORT-LNP的两个mRNA疗法正在进行临床前评估,分别是治疗原发性纤毛运动障碍(PCD)和囊性纤维化(CF)。其中治疗原发性纤毛运动障碍(PCD)的项目(通过SORT-LNP递送DNAl1的mRNA)将在2023年开始临床试验,治疗囊性纤维化(CF)的项目(通过SORT-LNP递送CFTR的mRNA)将在2023年年中提交临床试验申请。
ReCode公司的研发管线
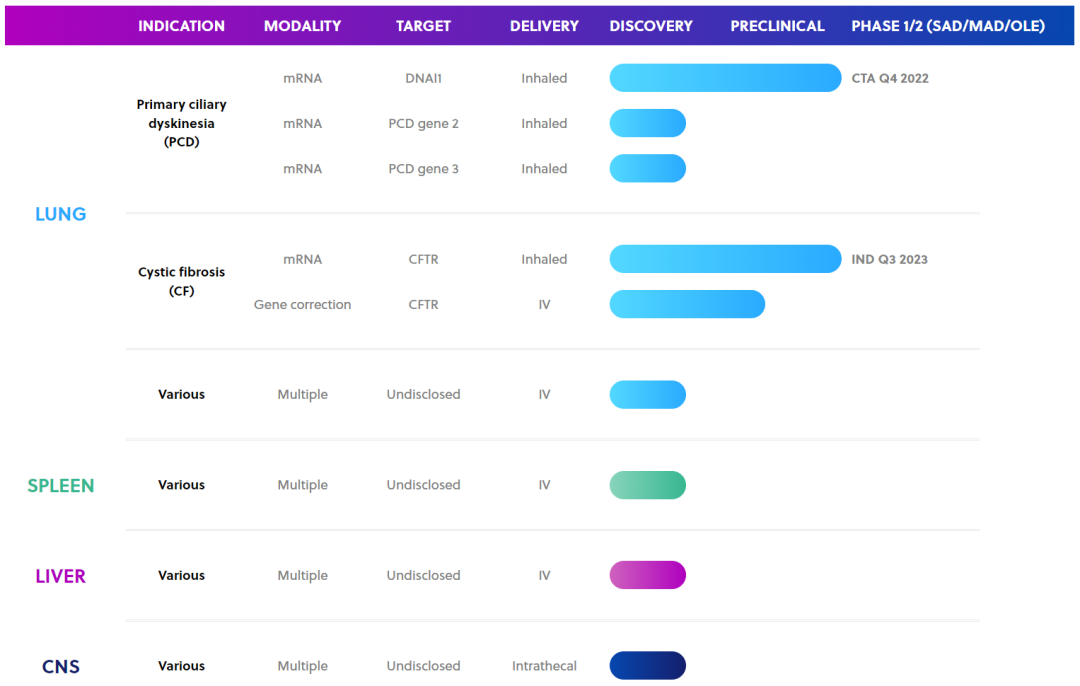
此外,ReCode还表示,SORT-LNP还可以在调整后靶向脾脏,包括其中的T细胞和B细胞,这为体内原位CAR-T细胞疗法的可能性打开了大门。
参考资料:
https://www.nature.com/articles/s41565-020-0669-6
https://www.pnas.org/content/118/52/e2109256118
https://www.nature.com/articles/s41565-022-01292-0
https://recodetx.com/pipeline/


