Cancer Discov:陈列平等合作总结基于肿瘤坏死因子受体家族CD137的癌症免疫治疗进展
时间:2023-01-03 15:03:31 热度:37.1℃ 作者:网络
25年前,Ignacio Melero课题组报道了激动剂抗CD137单克隆抗体根除移植小鼠肿瘤,因为它增强了CD8+ T细胞抗肿瘤免疫。小鼠模型表明,抗CD137激动剂抗体与各种其他疗法协同作用。在临床中,激动剂抗体urelumab显示出抗黑色素瘤和非霍奇金淋巴瘤的单药活性,但在一小部分患者中引起严重的肝脏炎症。CD137的信号域包含在已批准的嵌合抗原受体中,具有持久性和有效性。针对肿瘤的新一波CD137激动剂,主要基于双特异性结构,正处于早期试验阶段,并显示出良好的安全性和临床活性。
2022年12月28日,西班牙应用医学研究中心Ignacio Melero及陈列平等团队合作在Cancer Discovery 杂志在线发表题为“CD137 (4-1BB)-Based Cancer Immunotherapy on Its 25th Anniversary”的综述文章,以纪念CD137 (4-1BB)的癌症免疫治疗25周年。CD137 (4-1BB)是T细胞和自然杀伤淋巴细胞的共刺激受体,25年前发现其活性可用于癌症免疫治疗策略。在最初的尝试遇到了不可接受的毒性之后,新的一波结构对CD137的激动作用正在患者中开发,提供了临床和药效学活性的迹象,并具有可耐受的安全性。

Byoung Kwon团队从遗传学上寻找由激活的但不是静止的T淋巴细胞表达的分子。编码跨膜蛋白的cDNA被命名为4-1BB,并克隆小鼠和人类同源物允许产生单克隆抗体(mAb),最终导致该蛋白的发现,并将其命名为CD137,成为肿瘤坏死因子受体(tumor necrosis factor receptor, TNFR)基因家族的新成员,称为TNFRSF9。这些抗体在功能上能够增强增殖和细胞因子的产生,同时减轻T淋巴细胞培养中的细胞死亡。
Robert Mittler团队证明,使用激动剂抗CD137单抗在体内人工共刺激CD8+ T细胞能够通过CD4 T细胞依赖机制增强CD8+ T细胞反应,同时减弱体液反应。其他研究报道了输注anti-CD137激动剂单克隆抗体能够根除许多已建立的可移植小鼠肿瘤,包括来自Ag104和P815细胞系的肿瘤。在每种情况下,抗肿瘤效果都需要小鼠体内存在CD8+ T细胞,而对自然杀伤(NK)和CD4 T细胞的需求是肿瘤模型依赖的。
与此同时,Immunex公司的科学家能够克隆CD137的TNF家族天然配体,称为CD137L (4-1BBL, TNFSF9),它也作为三聚体分子对T淋巴细胞产生共刺激作用。Ignacio Melero团队在小鼠模型中发现,表达CD137L的小鼠肿瘤细胞转染物增强了CD8对自身和对未转染的相伴物的抗肿瘤免疫反应,如果同伴共刺激配体CD80共转染以刺激CD28,这种免疫反应会增强。如果将包含跨膜结构域的抗CD137单抗单链可变片段(scFv)转染到可移植肿瘤细胞系,而不是CD137L片段,则上述结果会得到改善。重要的是,这种作用可以通过瘤内注射编码这种工程表面scFv抗体的腺病毒或4-1BBL来对抗已建立的肿瘤。
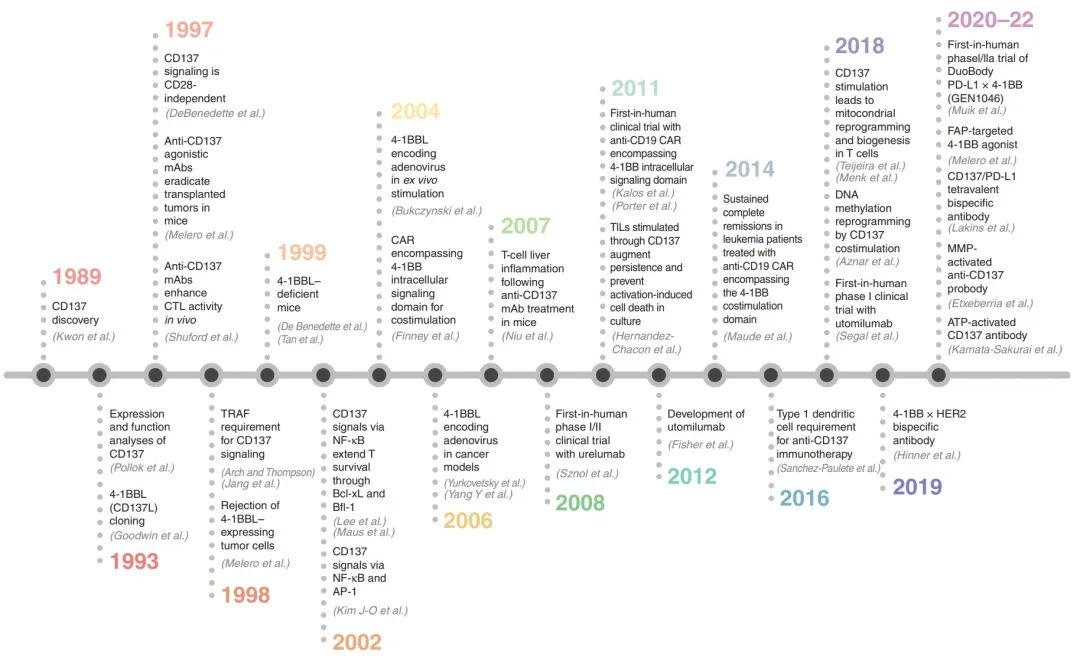
图1. CD137 (4-1BB)癌症免疫治疗的主要发现和发展时间表(图源自Cancer Discovery )
这些实验是先前描述的与腺病毒转移的抗病毒CD8+ T细胞反应的4-1BBL共刺激的应用。这些发现与CTLA-4拮抗剂抗体阻断能够根除一种特定的可移植结肠癌的报道不约而同。在这方面, CD137单抗的治疗应用开辟了激动剂免疫调节单抗的领域。
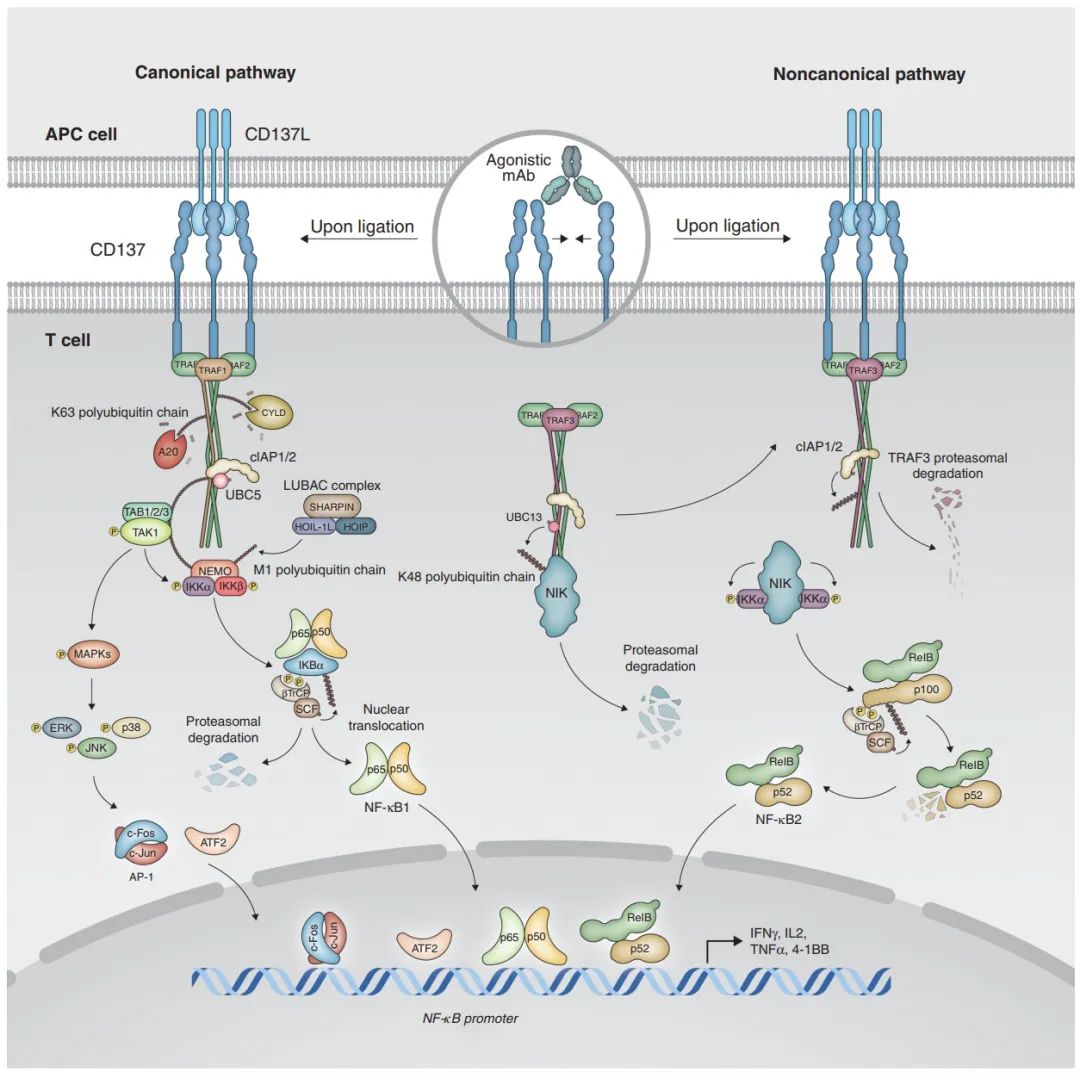
图2. CD137分子生理学示意图(图源自Cancer Discovery )
总的来说,基于CD137的方法在成功应用于CAR - T细胞之外,对癌症免疫治疗有很大的希望,希望在患者中达到一致的疗效。临床科学和药物开发往往是不可预测的,但目前学术界和工业界在CD137为基础的免疫治疗方面的努力,以及新一波CD137激动剂化合物的初步报告,预示着光明的未来,这将是25年持续转化研究努力的成果。
原文链接:
https://doi.org/10.1158/2159-8290.CD-22-1029


