12月内分泌代谢领域高分文献集锦(5篇)
时间:2023-01-03 15:01:13 热度:37.1℃ 作者:网络
1、BMJ:1990-2019年早发2型糖尿病流行病学特征的荟萃分析
早发2型糖尿病(T2DM)通常定义为发病年龄<40岁的2型糖尿病。与一般T2DM患者相比,早发T2DM患者发生高血糖和代谢紊乱的病程更长,更早进展至糖尿病并发症期,因此也是T2DM的重点管理对象。
本月The BMJ发布了一项荟萃分析,旨在探讨1990-2019年间早发T2DM的患病趋势及影响因素。

研究基于2019年全球疾病负担研究,纳入1990-2019年间204个地区中15-39岁的个体。研究的主要结局为T2DM的年龄标准化发病率、年龄标准化伤残调整寿命年(DALY)和年龄标准化死亡率,以及DALY的归因风险因素占比。
分析显示,1990-2019年期间,全球15-39岁人群中T2DM的年龄标准化发病率显著增加(P<0.001),由1990年的117.22例/100 000人增加至2019年的183.36例/100 000人。T2DM的年龄标准化DALY率由1990年的106.34例/100 000人增加至2019年的149.61/例100 000人。年龄标准化死亡率轻度增加,由1990年的0.74例/100 000人增加至2019年的0.77例/100 000人(图1)。根据社会人口指数分组发现,2019年中低和中等社会人口指数国家具有最高的年龄标准化发病率以及年龄标准化DALY率,而低社会人口指数国家具有最低的年龄标准化发病率,但年龄标准化死亡率最高。年龄<30岁的人群中,女性较男性的死亡率和DALY率更高,但在年龄>30岁的人群中呈相反趋势(低社会人口指数国家除外)。早发T2DM相关DALY的主要归因风险因素一致表现为高BMI指数,其他因素因地区而异。
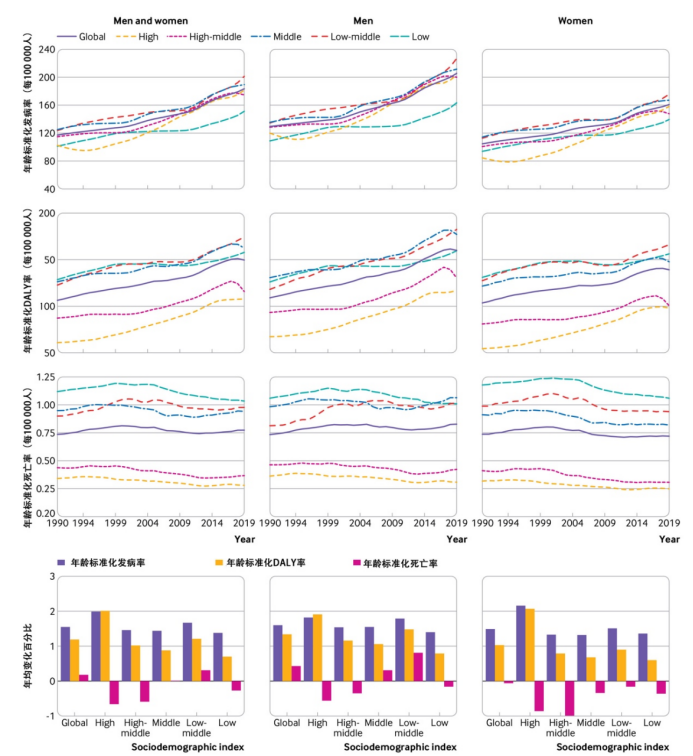
图1.早发T2DM的年龄标准化发病率、年龄标准化DALY率和年龄标准化死亡率
该研究表明,全球早发T2DM的发病率持续上升,中低和中等社会人口指数国家的增长幅度更为明显。基于归因风险分析,体重管理仍是预防早发T2DM的关键,并且应根据各国的人口特征制定不同的预防措施。
全文资源:https://www.bmj.com/content/379/bmj-2022-072385.
2
JAMA子刊:补充维生素D对他汀相关肌肉副作用无明显预防效果
他汀类药物可通过抑制内源性胆固醇的生物合成,防治代谢性心脑血管疾病。他汀相关肌肉症状(SAMS)是指因他汀类药物的肌肉毒性引起的肌肉相关不适(如疼痛、无力和痉挛等),也是导致患者用药依从性下降的主要原因。观察性研究显示,服用维生素D(VitD)者出现他汀类药物不耐的风险较低,但尚无随机对照研究对此进行验证。
本月JAMA Cardiology发布了一项VITAL试验的亚组研究,旨在探讨补充VitD是否有助于预防SAMS的发生并改善他汀类药物的用药依从性。

研究纳入VITAL试验中50岁以上的男性和55岁以上的女性,排除癌症和心血管疾病患者,随机分配接受VitD(2000 IU/日)或安慰剂治疗。纳入随机化后开始服用他汀类药物的对象,主要研究结局为持续数天的肌肉疼痛或不适,次要结局为因SAMS停止他汀类药物使用。
共1033例患者接受VitD治疗,1050例患者接受安慰剂治疗,平均年龄为66.8岁,49%为女性。经过平均4.8年随访,VitD组患者中SAMS的发生率为31%(317/1050),安慰剂组患者中SAMS的发生率为31%(325/1050),校正后风险因素(OR)为0.97(95%CI 0.80-1.18,P=0.78)。维生素D组和安慰剂组的停药率均为13%, OR为1.04(95%CI 0.80-1.35,P=0.78)。分组前血清 25-OHD水平对上述结果无显著影响:治疗前25-OHD水平<20 ng/mL的患者中,VitD组和安慰剂组的SAMS发生率分别为为33%(28/85)和35%(33/95);治疗前25-OHD水平<30 ng/mL的患者中,VitD组和安慰剂组SAMS的发生率分别为27%(88/330)和30%(96/323)。
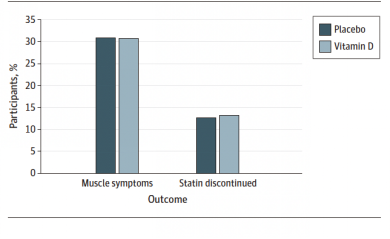
图1. 维生素D组和安慰剂组对象发生肌肉症状和他汀类药物停药的比例
该研究表明,无论治疗前是否存在VitD缺乏,补充VitD均未降低SAMS的发生率,并且不能改善他汀类药物的用药依从性。至此,仍缺乏RCT证据支持VitD对SAMS的预防作用,目前对于这一副作用的处理方法仍以明确肌痛发生原因和调整药量为主。
全文资源:https://jamanetwork.com/journals/jamacardiology/article-abstract/2798958.
3
NEJM:通过小干扰RNA药物降低心血管疾病患者的脂蛋白(a)水平
多项流行病学研究显示,脂蛋白(a)是动脉粥样硬化性心血管疾病(ASCVD)的重要危险因素,但目前临床中仍缺乏可有效降低机体脂蛋白(a)水平的降脂药物。olpasiran是一种siRNA类药物,OCEAN(a)-DOSE I期试验表明该药物具有显著的降脂蛋白(a)效果。
本月N Engl J Med发布了OCEAN(a)-DOSE II期试验的结果,旨在进一步探讨olpasiran的降脂作用以及适用剂量。

研究纳入281例确诊ASCVD或脂蛋白>150 nmol/L的患者,以1:1:1:1:1随机分配接受四种剂量的olpasiran(10mg/75mg/225mg每12周或225mg每24周 )或安慰剂治疗。研究的主要结局为自基线至36周脂蛋白(a)的变化百分比
患者的平均年龄为61.9±9.5岁,32%为女性。在基线时,脂蛋白(a) 的中位浓度为260.3 nmol/L,中位LDL-C为67.5 mg/dL;88%的患者接受他汀治疗,52%接受依折麦布治疗,23%接受PCSK9治疗。在36周时,安慰剂组脂蛋白(a)的浓度增加3.6%,而olpasiran组脂蛋白(a)浓度显著降低,并呈剂量依赖性。校正后10 mg/12周、75 mg/12周、225 mg/12周和225 mg/24周组患者的脂蛋白(a)浓度分别较基线降低70.5%、97.4%、101.1%和100.5%(图1)。不同组间不良事件和严重不良事件的总发生率无显著差异。
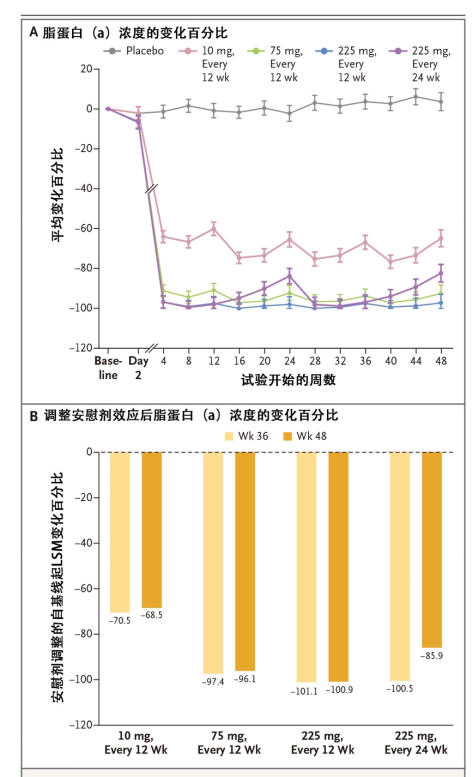
图1.安慰剂效应调整前(A)后(B)各干预组脂蛋白(a)随时间的变化
该研究表明,olpasiran可显著降低ASCVD患者中脂蛋白(a)的浓度,并且具有剂量依赖效应,为后续临床试验的开展提供了有力支持。不过,仍需进一步确定该药物的心血管获益和具体治疗目标。
全文资源:https://www.nejm.org/doi/full/10.1056/NEJMoa2211023
4
JAMA子刊:肥胖和脂肪分布与不同类型卒中的关联
2019年全球脑卒中患者高达1220万,已成为全球第二大死亡原因。超重和肥胖通常与糖尿病、血脂异常和高血压等代谢性疾病同时存在,被公认为各类心脑血管疾病的重要危险因素。然而,鲜有研究探讨肥胖或腹部脂肪过多与不同类型脑卒中的独立关联。
本月JAMA Network Open发布了一项大型前瞻性队列研究,旨在探讨BMI和腰围与缺血性卒中、颅内出血和蛛网膜下腔出血的关联。

研究基于英国UK Biobank前瞻性队列研究,纳入2006-2010年间入组时无既往脑卒中病史的对象,并通过电子医疗记录进行随访。研究的主要结局为缺血性卒中、颅内出血和蛛网膜下腔出血。
研究组对490 071名对象(平均年龄56.5岁)进行了12年随访,期间共发生7117例缺血性卒中、1391例颅内出血和834例蛛网膜下腔出血。调整腰围后,BMI与缺血性卒中风险无显著相关性(BMI每增加5个单位,HR=1.04,95%CI 0.97-1.11),但与颅内出血(HR=0.85,95%CI 0.97-1.11)和蛛网膜下腔出血(HR=0.82, 95%CI 0.69-0.96)呈负相关。在调整BMI后,腰围与缺血性卒中(腰围每增加10 cm HR=1.19,95% CI 1.13-1.25)和颅内出血(HR=1.17,95%CI 1.05-1.30)风险呈正相关,但与蛛网膜下腔出血风险无关(HR=1.07,95%CI 0.93-1.22)(图1)。

图1. BMI和腰围与缺血性卒中(A)、颅内出血(B)和蛛网膜下腔出血(C)的独立关联。
该研究表明,BMI和腰围均与脑卒中风险独立相关,并且对不同类型的脑卒中影响不同。此外,BMI和腰围参数与脑卒中风险的相反关联提示,肥胖症和腹型肥胖可能通过不同的机制影响个体的心血管风险因素。
全文资源:https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2799554.
5
Lancet内分泌子刊:儿童癌症幸存者发生骨密度降低和骨折的风险因素
得益于近年来多学科联合诊疗手段的快速发展,儿童癌症患者的生存率已大大提高,并且死亡率持续下降。然而,肿瘤及其治疗可能会引起儿童骨密度(BMD)偏低,并进一步增加其成年后发生骨代谢异常、骨痛和骨折等不良骨骼事件的风险。因此,探讨儿童癌症幸存者中影响骨密度指标的危险因素至关重要。
本月Lancet Diabetes Endocrinol 发布了一项横断面研究,旨在探讨儿童癌症幸存者中骨密度降低和骨折的风险因素。

研究基于荷兰DCCSS LATER队列,纳入18-45岁、19岁前被诊断为肿瘤的儿童癌症存活者(定义为确诊后存活时间5年以上的个体)。通过骨密度扫描评估BMD,基于医疗记录确定肿瘤诊断5年及以后是否发生骨折。通过逻辑回归分析低BMD(Z-评分≤-1)或极低BMD(Z-评分≤-2)与骨折、椎体骨折和其他生活因素的关联。
共纳入2016-2020年期间 2003名来自DCCSS LATER队列的对象,平均年龄为33.1岁,48.2%为女性。36.1%(559/1548)的对象全身任何部位均为低BMD,9.6%(149/1548)的对象全身任何部位均为极低BMD。男性首次骨折的标准化发病率比为3.53(95% CI 3.06-4.06),女性首次骨折的标准化发病率比为5.35(95% CI 4.46-6.52)。13.3%(33/249)的对象发生了椎体骨折。男性性别、体重过低、高剂量卡铂治疗、任何剂量的颅内放射治疗、性腺低下、甲亢、活动较少和严重的维生素D缺乏与全身任何部位低BMD有关。此外,男性性别、体重过低、颅内放射治疗、生长激素缺乏和重的维生素D缺乏与全身任何部位极低BMD有关(表1-2)。男性、吸烟和极低腰椎BMD与任意位置骨折有关,而随访时年龄较大、既往接受过铂类药物治疗、生长激素缺乏和活动较少与椎体骨折风险增加有关。

表1.发生极低BMD的人口学和治疗相关风险因素

表2. 发生极低BMD的内分泌和生活方式相关风险因素
该研究表明,儿童肿瘤幸存者发生骨折的风险高于一般人群,主要的危险因素包括低腰椎BMD、多种内分泌疾病和维生素缺乏。以上分析强调了对儿童患者进行综合健康管理的重要性,并为确定未来应对哪些儿童肿瘤幸存者进行动态BMD监测提供依据。
全文资源:https://www.thelancet.com/journals/landia/article/PIIS2213-8587(22)00286-8/fulltext.
文:付金蓉 中国医科大学附属第一医院
责编:苏志强
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


