Science子刊:曹雪涛/姜明红/朱平合作揭示组氨酸去乙酰化酶促进IFN3介导的抗病毒免疫反应机制
时间:2022-12-23 18:00:29 热度:37.1℃ 作者:网络
表观遗传调控通过多种机制在先天免疫反应中起着至关重要的作用。乙酰化是目前研究最多的表观遗传调控机制之一,是一种重要的翻译后修饰,需要对各种生物过程进行适当的调控。
HDAC10作为组蛋白去乙酰化酶(histone deacetylases, HDACs) IIb家族成员,在各种生物过程中发挥作用,如介导同源重组,自噬介导的细胞存活和细胞周期,所有这些都依赖于它的去乙酰酶活性。HDAC10还独立于其去乙酰化酶活性调节转录和细胞增殖。此外,HDAC10作为一种有效的抑制因子,可以抑制病毒复制和HIV-1的感染性。然而,HDAC10在抗病毒先天免疫反应中的作用尚不清楚。
2022年12月20日,中国医学科学院北京协和医学院曹雪涛及姜明红与广东省人民医院朱平合作在Science Signaling 杂志在线发表题为“Degradation of HDAC10 by autophagy promotes IRF3-mediated antiviral innate immune responses”的研究论文,该研究发现HDAC10是IRF3介导的编码I型IRF基因表达的抑制剂。病毒感染后,HDAC10在宿主细胞中通过自噬降解,缓解了IRF3磷酸化的抑制,导致I型IFN的产生和抗病毒免疫反应的增强。总之,这项研究结果为IRF3信号的调控提供了见解,并提示HDAC10可能是控制感染性疾病和I型IRF相关炎症性自身免疫性疾病的靶点。

干扰素(type I interferon,IFN)调节因子3 (interferon regulatory factor 3,IRF3)是参与先天免疫反应调节的最重要的转录因子之一。在静息状态下,IRF3以自抑制构型定位于细胞质。在病毒感染或核酸暴露的反应中,IRF3被模式识别受体激活,过度磷酸化,二聚体,并易位到细胞核,诱导编码I型IFN的基因表达,这是一种功能性细胞因子,在感染、炎症和自身免疫性疾病(如系统性红斑狼疮(systemic lupus erythematosus,SLE))中发挥重要作用。虽然IRF3的激活在病毒感染过程中已被广泛描述,但完整和精确的IRF3调控需要进一步阐明。
模式识别受体本身及其调节因子的产生、降解或易位对于精确控制宿主免疫反应至关重要。自噬是一种基本的真核生物降解途径,在病毒感染过程中具有多种免疫功能。一方面,自噬作为先天抗病毒反应的重要组成部分,通过指导病毒颗粒或病毒复制所需的宿主因子的降解。另一方面,自噬通过降解先天受体或先天免疫信号通路的关键调控因子来阻止持续的免疫反应,从而参与炎症的消退。然而,病毒也会劫持自噬系统以逃避宿主免疫系统的监视和杀伤,这表明宿主-病毒相互作用的复杂性。
通过功能筛选,该研究确定HDAC10是干扰素调节因子3 (IRF3)介导的I型干扰素(IFN)反应的抑制剂。与健康供者的外周血单核细胞相比,小鼠巨噬细胞中HDAC10丰度在先天性免疫刺激下降低,系统性红斑狼疮(SLE)患者的外周血单核细胞(peripheral blood mononuclear cells,PBMCs)中HDAC10丰度降低。
不仅如此,小鼠胚胎成纤维细胞和小鼠中HDAC10的缺乏促进了编码I型IFN的基因和IFN刺激基因(IFN-stimulated genes,ISGs)的表达,从而增强了体外和体内的抗病毒反应。HDAC10以脱乙酰酶不依赖的方式与未感染细胞的IRF3结合,通过TANK结合激酶1 (TANK-binding kinase 1,TBK1)抑制IRF3 Ser396位点的磷酸化。病毒感染后,HDAC10通过与LC3-II的相互作用靶向自噬介导降解。因此,IRF3磷酸化增加,导致I型IFN产生和抗病毒反应增强。
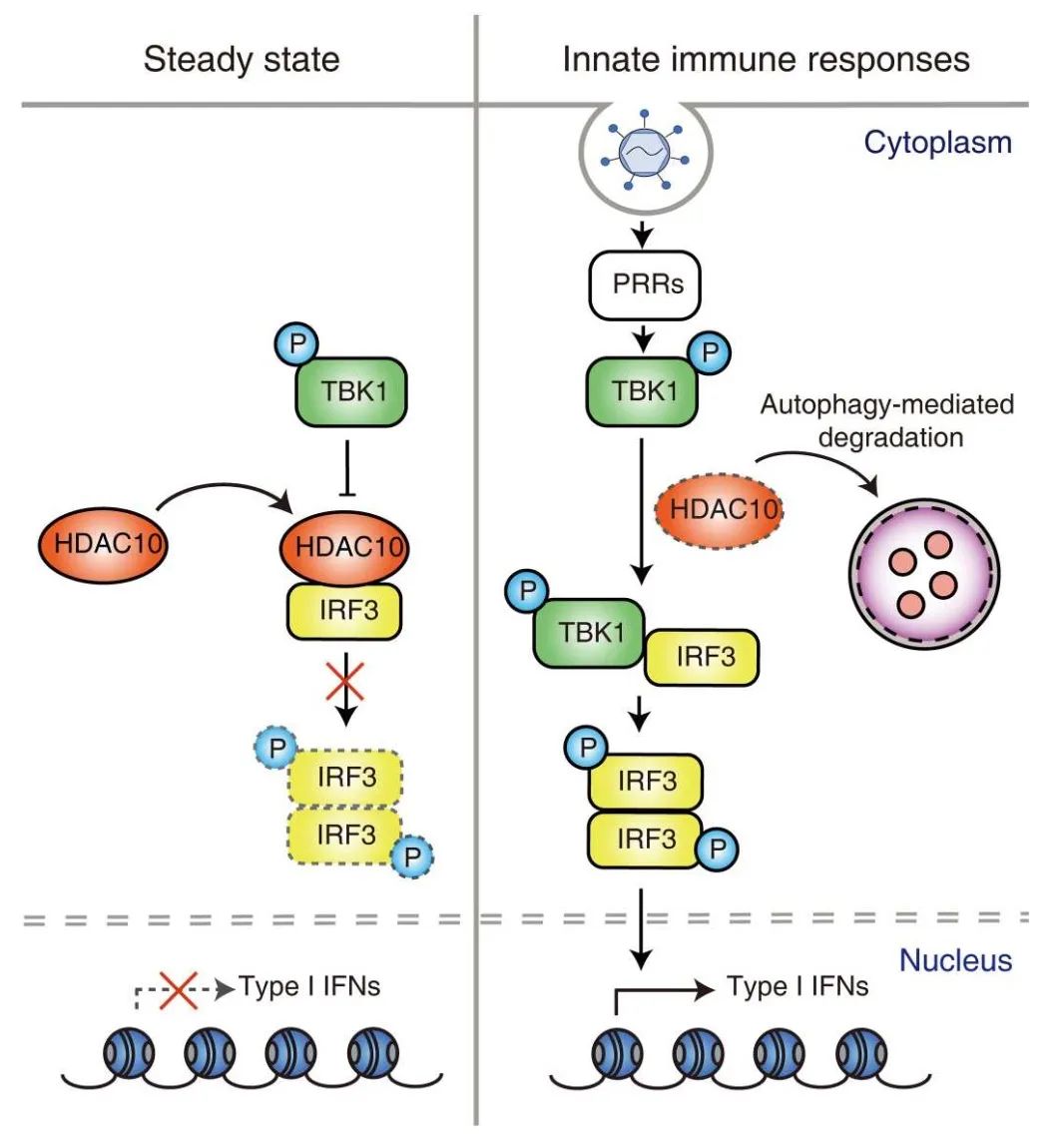
HDAC10抑制IRF3介导的抗病毒先天免疫反应的机制模型(图源自Science Signaling )
总之,这项发现揭示了一种以前未被描述的宿主防御病毒的机制,并为宿主-病毒相互作用提供了见解,为改善宿主对病原体感染的防御反应和治疗自身免疫性疾病确定了一个潜在的靶点。

