Nature子刊:郑科/倪挺/崔益强利用单细胞测序分析揭示RNA结合蛋白DDX43调控精子变形中染色质重塑的动态过程
时间:2023-05-04 22:37:44 热度:37.1℃ 作者:网络
染色质重塑是精子变形中的关键生物学事件,该过程以精子细胞特有的鱼精蛋白逐渐替换常规组蛋白为主要特征。染色质重塑对于确保父系基因组信息的遗传稳定性与完整性至关重要,因而受到雄性生殖和表观遗传学领域的广泛关注。尽管针对染色质重塑过程如何受靶向特异性调控的作用机制以及在单细胞水平描述生精细胞发育动态过程等科学问题已各自取得了多个重要进展,但这些动态过程是否及如何在转录后水平上受到某个关键基因的协同调控仍不清楚。
全转录组测序(RNA-seq)主要反映整个细胞群体基因表达水平的平均值,所以并不适用于准确剖析各亚型生精细胞连续发育状态的动态调控过程。值得注意的是,单细胞RNA测序(scRNA-seq)技术及生信分析方法已得到迅猛发展,从而使我们能从单细胞尺度追踪不同转录组状态生精细胞间的分化轨迹,并回答其如何受到精细的调控。
2023年4月29日,南京医科大学生殖医学国家重点实验室郑科、崔益强与复旦大学生命科学学院倪挺三个团队密切合作在Nature Communications 在线发表了题为“Single-cell RNA-seq uncovers dynamic processes orchestrated by RNA-binding protein DDX43 in chromatin remodeling during spermiogenesis”的研究长文,该研究以基因编辑小鼠为模型,发现RNA结合蛋白DDX43为精子发生所必需,其基因敲除或突变均引起了精子变形中染色质重塑发生缺陷。通过联合单细胞测序(scRNA-seq)和增强型交联免疫沉淀联合高通量测序(eCLIP-seq)等多种研究手段,在单细胞尺度上详细解析了DDX43在精子变形时期对染色质重塑和转录组变化的调控功能及分子机制。

研究人员首先筛选到一个睾丸优势表达的RNA解旋酶DDX43,利用CRISPR-Cas9构建基因敲除及酶活点突变小鼠,发现缺少正常DDX43蛋白会导致雄性不育和精子变形缺陷,主要表现为精子细胞中组蛋白替换、H4高度乙酰化、DNA瞬时断裂修复等一系列染色质重塑事件发生缺陷。然而在野生型与突变型小鼠睾丸的RNA-seq分析中并未发现明显的基因差异表达,推测精子变形时生殖细胞状态变化的高度动态性以及细胞内RNA解旋酶对RNA网络调控的瞬时变化性,可能使RNA-seq更不易揭示DDX43于特定细胞亚型中的、精确时序依赖性的转录后调控机制。因而,研究人员进一步选取Ddx43各基因型成年小鼠睾丸进行scRNA-seq。
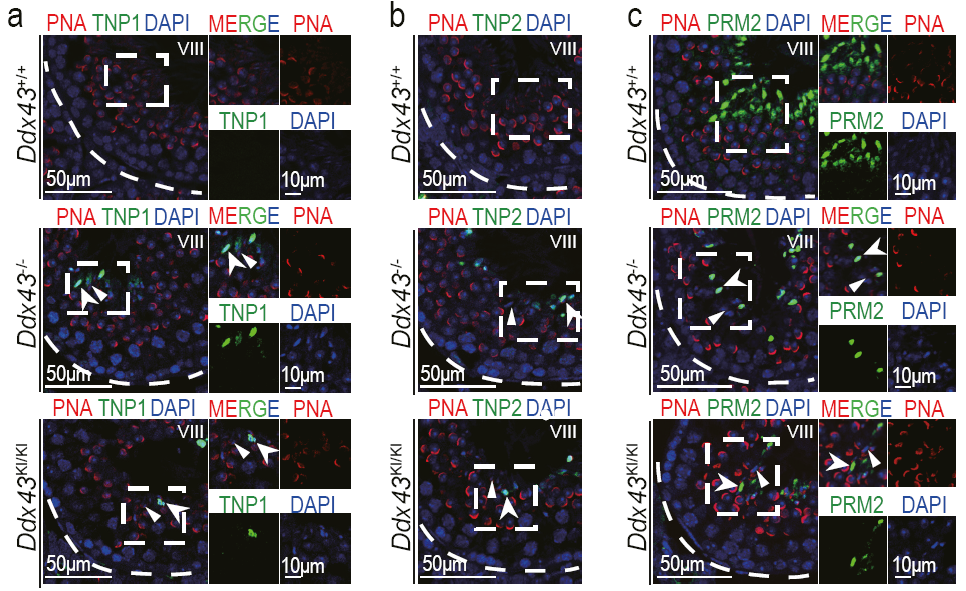
图1. DDX43缺失后导致染色质组蛋白替换成鱼精蛋白的过程发生异常 (引自原文Figure 3部分图像)
研究人员利用倪挺课题组之前开发的用于单细胞转录组解析的ICAnet方法,将Ddx43基因编辑小鼠的单细胞数据映射到参考图谱上进行不同基因型小鼠之间表达谱的差异分析。结合网络分化熵(network entropy)模型发现,突变鼠在各种分化类型生殖细胞中的分化熵要显著低于同时期的野生型小鼠。基于转录本剪接的RNA速率(RNA velocity)模型预测的生殖细胞分化方向表明:Ddx43基因编辑鼠呈现从圆形精子向长形精子发育轨迹异常。这与通过睾丸切片进行组化染色所观察到的表型缺陷相对应。
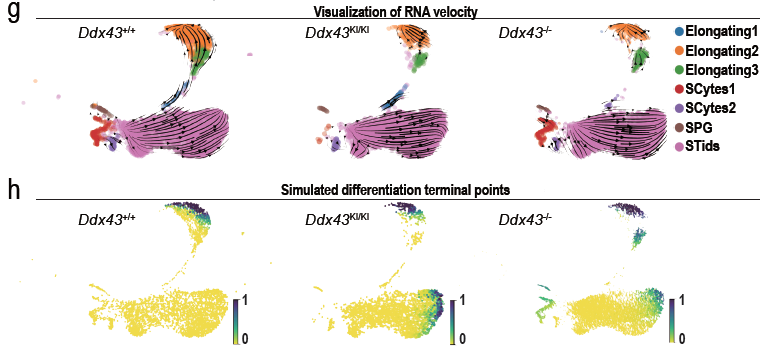
图2. scRNA-seq RNA速率分析显示DDX43缺失导致细胞分化轨迹异常(引自原文Figure 4部分图像)
这促使研究人员将目光锁定到圆形精子时期,并将其进一步细分为四个细胞亚群。尽管scRNA-seq可以帮助我们锁定是哪些细胞的基因表达出现了差异,但仍难以确定受DDX43蛋白直接调控的转录本。为此,研究人员又运用郑科课题组之前优化的eCLIP方法在睾丸中捕获DDX43直接结合的靶RNA,并构建了eCLIP-seq文库。通过eCLIP-seq和scRNA-seq联合分析,进一步将早期圆形精子细胞锁定为DDX43作用的关键期。对该时期的差异表达基因进行基因加权共表达网络分析,构建了四个基因共表达模块。进一步利用AUCell方法分析这些模块中生殖细胞的表达情况,发现缺少正常DDX43蛋白后会引起其中一个模块中圆形精子发育初期的转录本表达下调,且该模块基因的聚类分析表明其主要参与调控染色质重塑等通路。

图3. DDX43 靶RNA的CLIP同位素显影及eCLIP-seq建库(引自原文Figure 5部分图像)
研究人员进而基于随机游走算法,结合eCLIP-seq得到的靶基因集,分析这些靶基因到这四个基因共表达模块的拓扑距离,最终发现一个名为Elfn2的基因与四个模块整体距离最近。该基因亦是染色质重塑相关模块的枢纽基因(hub gene),及所有候选基因集在伪时序上初期表达最高的基因,因而推测其可能是DDX43调控精子变形的驱动基因(driver gene)。
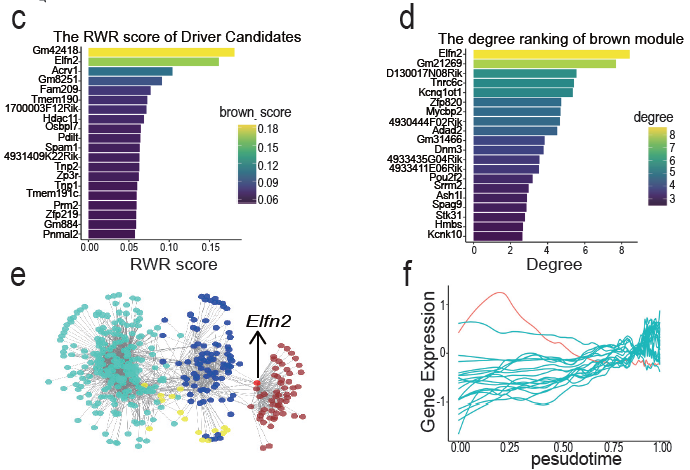
图4. 基因共表达模块分析发现DDX43靶向结合的关键基因Elfn2(引自原文Figure 6部分图像)
最后,研究人员发现该基因的 5′ UTR上存在类似DDX43结合靶RNA上相对富集的 G-rich 基序,并通过双荧光报告、RIP-qPCR和EMSA等实验证实了DDX43蛋白主要通过Elfn2 5′ UTR调控ELFN2蛋白表达,且Elfn2 5′ UTR上的两个G四联体(G4)基序可能是其被DDX43蛋白靶向的主要位点。最后通过睾丸内注射反义寡核苷酸(ASO)成功实现了ELFN2蛋白的内源性敲降,并观察到ELFN2蛋白敲降后与Ddx43基因突变呈现类似的表型缺陷。

图5. 活体睾丸内源ELFN2蛋白敲降后呈现与Ddx43基因突变小鼠类似的分子缺陷(引自原文Figure 7部分图像)
综上,该研究发现了一个在精子变形染色质重塑中发挥重要作用的新基因,也为在单细胞水平上研究RNA结合蛋白如何协同调控细胞动态发育和转录组动态变化提供了新的研究范式。
南京医科大学生殖医学国家重点实验室博士谈欢欢(现工作于重庆医科大学附属第一医院生殖中心)和复旦大学生命科学院硕士汪伟旭(现亥姆霍兹计算生物所Prof. Fabian Theis实验室博士生)为该论文的主要贡献作者,郑科教授、倪挺教授、崔益强副研究员为该论文的共同通讯作者。
文章链接:
https://www.nature.com/articles/s41467-023-38199-w


