阿尔茨海默症病理中星形胶质细胞和小胶质细胞的不同转录组分析
时间:2022-12-11 23:40:48 热度:37.1℃ 作者:网络
 导读
导读
阿尔茨海默病(AD)淀粉样斑块周围可见激活的星形胶质细胞和小胶质细胞,与AD风险相关的基因在这两种细胞中表达较多,特别是在小胶质细胞中。然而,星形胶质细胞和小胶质细胞促进疾病发生、进展和反应的机制目前仍不清楚。小鼠转基因模型已经提出了可能驱动淀粉样蛋白或pTau病变中心过程的途径,但还没有很好地捕捉到晚发型散发性AD中神经胶质反应的多样性。近日,《Acta Neuropathologica》杂志上发表了一项的题为“Perse human astrocyte and microglial transcriptional responses to Alzheimer‘s pathology”的研究。为了更好地界定星形胶质细胞和小胶质细胞在AD中的作用,作者使用snRNA测序全面表征了死后经神经病理学确诊的AD患者脑组织中分离出来的星形胶质细胞和小胶质细胞核中选择性富集的转录组,发现了胶质细胞基因表达的显著差异且AD危险基因在胶质细胞中与淀粉样蛋白或pTau的表达相关。在这两种细胞类型和病理中,除常见基因集在两种病理中都丰富,星形胶质细胞还显示丰富的蛋白调节、炎症和金属离子稳态途径,而小胶质细胞则是吞噬、炎症和蛋白稳定的途径,IL1 相关通路富集与pTau特异性相关。此外,作者还在星形胶质细胞和小胶质细胞中发现了与稳态功能或疾病病理相关转录特征的可区分的亚簇,基因共表达分析显示,星形胶质细胞(CLU)和小胶质细胞(GPNMB)中AD的可溶性生物标志物具有潜在的功能关联,强调了星形胶质细胞和小胶质细胞对病理蛋白清除和炎症反应以及AD中的胶质细胞转录多样性。
 1. 星形胶质细胞和小胶质细胞转录组测序
1. 星形胶质细胞和小胶质细胞转录组测序
从人脑中分离的细胞核RNASeq定义的小胶质细胞和星形胶质细胞的比例比较低。作者为了全面分析具有AD病理的星形胶质细胞和小胶质细胞的双转录表达,使用FACS选择性去除神经元和少突胶质细胞核来富集这些胶质细胞(图1)。为此,作者将来自6个没有认知障碍的低levelAD病理大脑和6个高level AD病理大脑的两个皮质区域内嗅皮质(EC)和躯体感觉皮质(SSC)中分离。整合后在疾病、脑区和供体性别上大致匹配。每个受试者和大脑区域的配对切片中富集和不富集的细胞核中表达的最容易变异的前10%基因是相关的,表明从每个样本中富集到的样本表达转录组在富集过程中没有偏倚。对于星形胶质细胞核,来自同一个体的可变基因之间的相关性在0.99到1.00之间,富集和未富集的小胶质细胞核之间也有很强的相关性。星形胶质细胞和小胶质细胞的核聚集比例在受试者之间有所不同,但从男性和女性供体中分离出的两种细胞类型的细胞核比例相同。AD的相对星形胶质细胞增生有一个较小的趋势。星形胶质细胞核的平均唯一分子识别(UMI)计数为8775,平均3166个不同基因,小胶质细胞核的平均UMI计数为4808,平均2132个基因。在52,706个星形胶质细胞的细胞核中,作者发现大约90%的星形胶质细胞的转录本表达来自人类大脑的星形胶质细胞(500个基因)。星形胶质细胞共表达网络中有16/65个AD风险基因。27,592个小胶质细胞核中96%含有最近描述的小胶质细胞“核心”共有转录组(249个基因)。小胶质细胞也高度富集了先前与AD遗传风险相关的基因(27/65)。
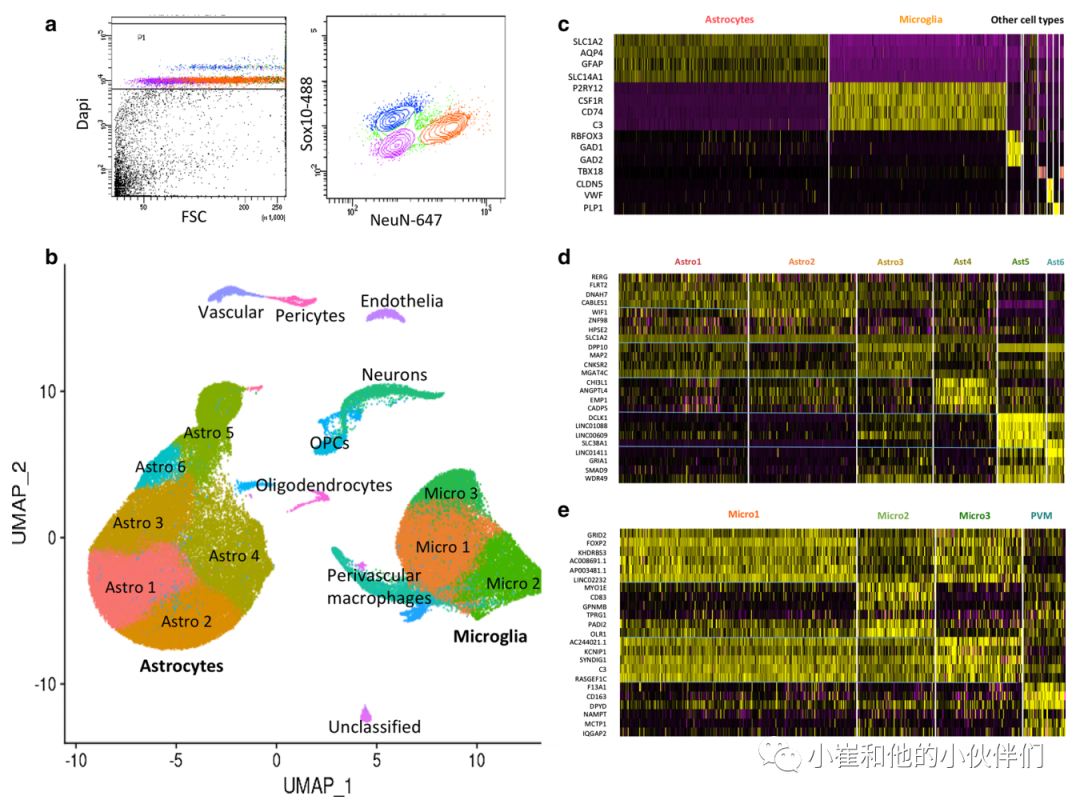 图1.单核RNASeq分析人低、高AD病理大脑的小胶质细胞和星形胶质细胞
图1.单核RNASeq分析人低、高AD病理大脑的小胶质细胞和星形胶质细胞
2.在AD患者的星形胶质细胞中金属离子稳态、蛋白稳态和炎症相关基因的表达增加
与细胞外淀粉样斑块或神经元内神经纤维缠结相关的基因表达是通过对每个大脑对侧半球的同源区域脑切片淀粉样蛋白或pTau密度的回归分析发现(图2)。表达的显著正相关基因中有一半与淀粉样蛋白和pTau病理相关,但相对于pTau(106个基因),几乎有3倍以上的转录本与淀粉样蛋白(313个基因)的表达唯一相关(图2)。作者发现,伴有淀粉样蛋白和pTau表达的星形胶质细胞功能显著富集“细胞对锌离子的反应”、“细胞对铜离子的反应”、“对铜离子的反应”以及“对金属离子的反应”通路(图3);编码参与金属离子稳态蛋白的基因(MT1G、MT1F、MT1E、MT2A、MT3和FTL)在与星形胶质细胞病理呈高度正相关的最高转录本中。参与“伴侣介导的蛋白复合物组装”和“对未折叠蛋白的反应”通路的转录本,如CRYAB、HSPB1、HSPH1和HSP90AA1,也呈正向差异表达。AD风险基因CLU的表达增加与星形胶质细胞中的pTau病理相关。AD风险基因IQCK的表达与淀粉样蛋白和pTau均呈正相关。参与炎症过程的途径也显著富集(“NLRP3炎症小体”和“NFkB信号激活传导”)。相比之下,“核心”或稳态星形胶质细胞的转录本,如谷氨酸转运体SLC1A3和SLC1A2或IL-33(促进CSF1R配体的小胶质细胞突触重构的转录本)被下调。AD风险相关的MEF2C转录因子以及MAFG、JUND、CEBPB、MAF和LHX2均上调,提示这些转录因子在AD病理应答调控过程中发挥作用。总而言之,作者通过基因富集明确了先前snRNASeq研究中报道的与AD病理学呈阳性差异表达的转录本也在具有人类AD病理学的细胞核中显著富集。
图2. β-淀粉样蛋白和 Tau 病理学下星形胶质细胞和小胶质细胞中的差异基因表达
3.具有AD病理的小胶质细胞中自噬、吞噬和蛋白稳态相关基因的表达
与淀粉样蛋白和pTau密度高度正相关的小胶质细胞转录本包括与AD风险相关的基因(APOE,MS4A6A和PILRA,图2),以及其他神经退行性疾病风险相关的基因(LRRK2、SNCA和GPNMB与帕金森病相关,GRN与神经元蜡样脂褐质沉积症和额颞叶痴呆相关)。相对于pTau(27个基因),4倍以上的转录本与淀粉样蛋白(109个基因)表达唯一相关,而60%的显著正相关基因表达与淀粉样蛋白和pTau病理相关(图2)。差异表达的转录本在“选择性自噬”以及“小胶质细胞病原体吞噬”途径中功能富集(图4);ASAH1、ATG7、STARD13和MYO1E是最强正相关的基因。血管周围巨噬细胞(PVM)也表现出“选择性自噬”的功能富集,以及一些参与蛋白稳定和肌动蛋白/微管蛋白折叠的CCT/TriC分子伴侣复合物通路。淀粉样蛋白或pTau病理下转录因子MAFG、MITF和JUND的上调表明它们参与了这些小胶质细胞和PVM对病理反应的转录调控。作者确认了在先前发表的snRNASeq研究中小胶质细胞阳性差异表达的转录本在具有人类AD病理的细胞核中同样显著富集。toll样受体(TLR2和TLR10)、HK2(己糖激酶2)、JAK2(Janus激酶2)和ITGAM(CD11b)在这些细胞中数量较少,这些转录本与淀粉样蛋白或pTau病理呈显著负相关。进一步作者发现星形胶质细胞和小胶质细胞在其表达与淀粉样蛋白和pTau病理特别相关的基因中表现出差异。星形胶质细胞表现出更多的线粒体氧化磷酸化和潜在的神经保护Nrf2激活通路的表达,这些途径与淀粉样蛋白相关,而细胞连接和分解代谢途径的上调与pTau病理相关,与促炎症性NLRP3炎症小体和金属离子反应通路的共同上调相关。相比之下,小胶质细胞显示碳水化合物代谢过程的表达增加,对未折叠蛋白的反应、MAPK 级联反应和 TYROBP 因果网络是淀粉样蛋白β表达更高的途径之一,对与 pTau 相关的 IL1 相关途径上调的反应较少。
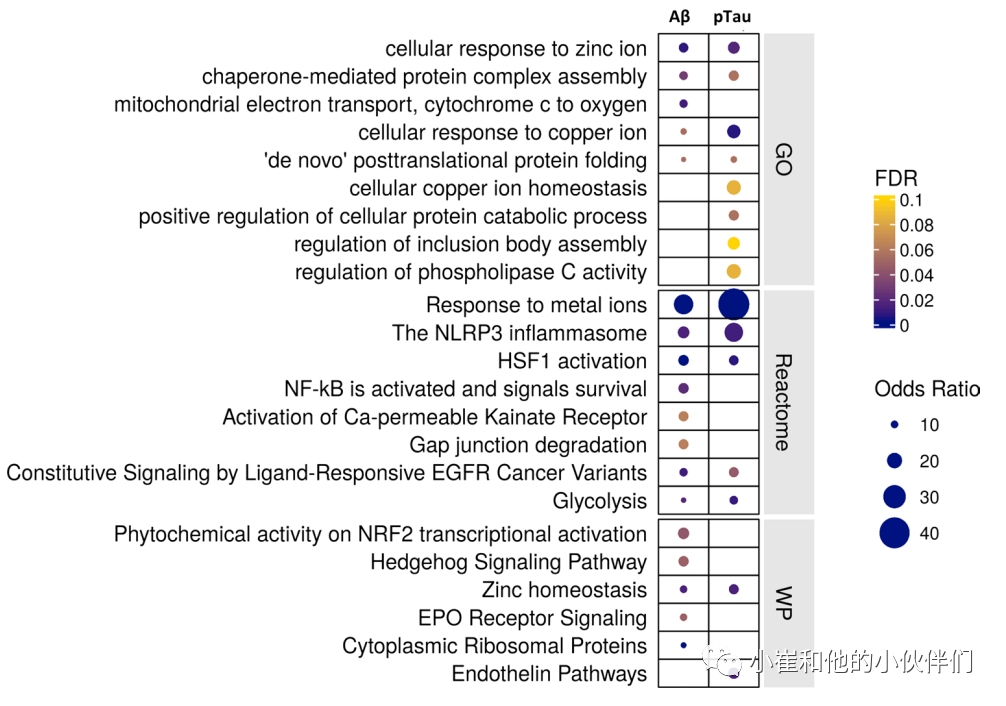
图3. 淀粉样蛋白和pTau病理下星形胶质细胞中差异基因表达的功能富集
4.星形胶质细胞与小胶质细胞间配体-受体相互作用的探索
作者将 CellChat 与生成的星形胶质细胞和小胶质细胞转录组一起联合应用,以探索推断的配体-受体相互作用与更大的β淀粉样蛋白或 tau 病理学之间的相关性。淀粉样蛋白和pTau病理都与整合蛋白与层粘连蛋白和纤维蛋白相互作用的基因表达增加有关,APP(星形胶质细胞)-CD74(小胶质细胞)配体对可以抑制淀粉样蛋白的产生,并推断CD99(星形胶质细胞) -PILRA(小胶质细胞)相互作用可能抑制炎症反应。相比之下,通过小胶质细胞ENTPD1核苷酶产物与星形细胞ADORA2B相互作用的腺苷信号在病理进展中不那么显著(ENTPD1基因与淀粉样蛋白和pTau病理呈负相关)。此外,淀粉样蛋白病理单独与涉及神经发生和学习的CXCL12(小胶质细胞)-CXCR7(星形胶质细胞)相互作用的更高概率相关,与BMP4(小胶质细胞)-BMP1RA(星形胶质细胞)配体受体配对有关,与小胶质细胞配体及其星形胶质细胞受体表达WNT的神经保护Wnt信号相关。这种相互作用只存在于AD样本中;这在对照组中是不显著的。小胶质细胞整合素与星形细胞糖蛋白GP1B和ICAM1相互作用的可能性降低,因为整合素基因的相对表达与淀粉样蛋白呈负相关。最后,更大的组织pTau密度与小胶质细胞上C3和C4A补体与C3AR1相互作用增加的概率显著相关;仅在AD样本中发现了这种相互作用(在对照组中不显著)。
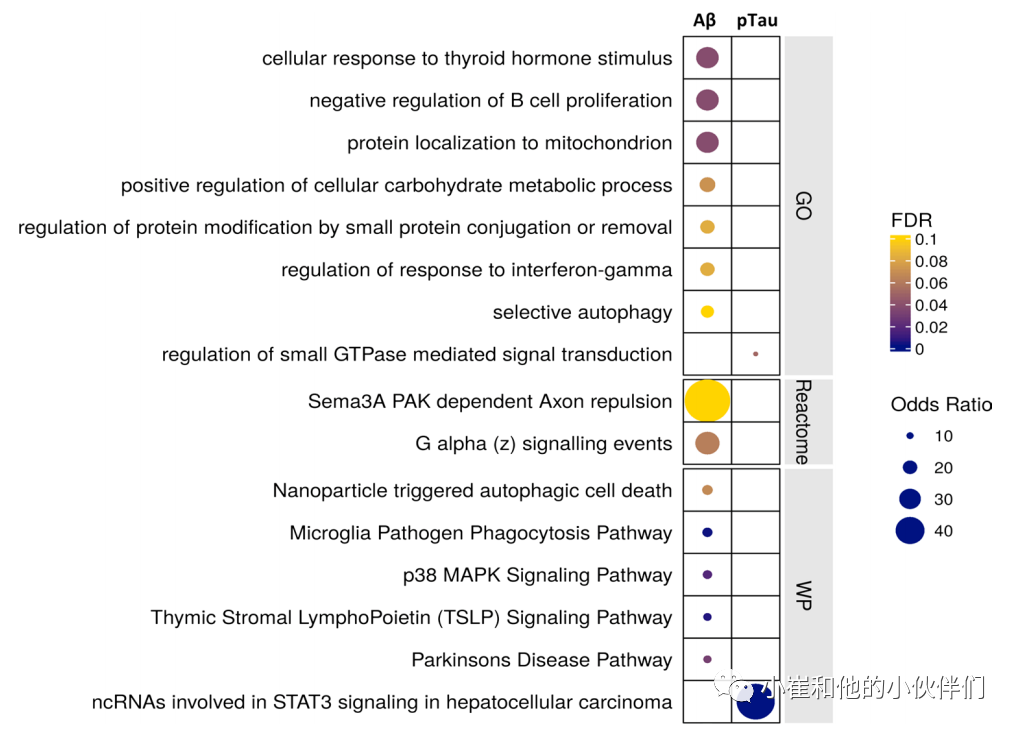
图4. 淀粉样蛋白和pTau病理下小胶质细胞中差异基因表达的功能富集
5.基因共表达模块表明AD的GWAS易感基因具有神经胶质细胞
特有的功能作用
内嗅皮质和躯体感觉皮质具有相似的共同表达特征
共表达网络分析用于表征星形胶质细胞和小胶质细胞中的基因表达模块(MEGENA),提示了潜在的功能关系。作者发现EC和SSC的基因共表达特征一致;在两个区域的细胞核中表达更大淀粉样蛋白或pTau蛋白的MEGENA模块之间存在强相关性(对于星形胶质细胞,pTau r=0.96,淀粉样蛋白r=0.86;对于小胶质细胞,pTau r=0.86,淀粉样蛋白r=0.87)。利用EC和SSC细胞核的SCENIC来推断与pTau或淀粉样蛋白增加相关的调控表达模式也是相似的。从EC和SSC的细胞核推断的差异活性之间有很强的相关性(星形胶质细胞,pTau r=0.89,淀粉样蛋白r=0.76;对于小胶质细胞,pTau r=0.85,淀粉样蛋白r=0.71),这些结果表明类似的细胞反应与两个脑区的淀粉样蛋白和pTau病理特征有关。
CLU 参与 AD 的星形胶质细胞金属离子稳态和蛋白稳态途径的证据
AD GWAS基因CLU和IQCK在星形胶质细胞模块中共表达(模块9),这与淀粉样蛋白和pTau密度呈最强的正相关。CLU和GJA1(缝隙连接蛋白Alpha1;连接蛋白-43)都是该模块中的枢纽基因,该模块中含有参与金属离子稳态(例如,“金属硫蛋白与金属结合”和“对金属离子的反应”)和“蛋白稳态”(“HSF1激活”、“对未折叠蛋白的反应”和“伴侣介导的蛋白质复合物组装”)的功能富集基因。它们也是相关儿童模块30中的枢纽基因,该模块包括“神经酰胺运输”和“缝隙连接组装”通路中的基因。CLU与使用SCENIC识别的星形胶质细胞调控因子(转录因子MAF、MAFG、JUND和CEBPB)相关,这些因子与pTau和淀粉样蛋白的相关性最强。包含clu的模块和相关的调控因子也在先前研究报道的AD核中富集。
APOE在小胶质细胞中连接吞噬、补体和炎症激活途径的细胞特异性作用的证据
APOE是AD的最大的遗传危险因素,在具有pTau和淀粉样蛋白病理的小胶质细胞中表达上调。APOE是小胶质细胞中的枢纽基因,与TREM2和炎症激活反应基因(如C1QB、C1QC、CD74、CTSB)共同表达,该模块包括“内吞体/液泡途径”、“小胶质细胞病原体吞噬”和“抗原处理交叉呈递”(模块19)。被推断为负责小胶质细胞APOE表达的调控因子包括转录因子MXD4、MITF、PBX3和JUND。APOE在星形胶质细胞中的表达与淀粉样蛋白或pTau病理没有显著相关,共表达关系表明APOE在星形胶质细胞中作为枢纽基因在 “皮肤硫酸盐生物合成”、“细胞外基质组织”和“铁死亡”功能丰富的模块中(模块13)。
小胶质细胞和血管周围巨噬细胞GPNMB在与脂质稳态相关的模块中随AD病理变化而上调
GPNMB在AD患者的血浆和脑脊液中升高,并已被认为是疾病的生物标志物。作者发现,GPNMB在具有淀粉样蛋白和pTau病理的小胶质细胞和具有pTau病理的血管周围巨噬细胞中表达上调。与此相一致的是,作者发现GPNMB与MAFG、JUND、MAFB、CEBPD和CEBPA转录因子调控相关,这些因子与淀粉样蛋白和pTau有很强的相关性 (图5a)。GPNMB也是小胶质细胞共表达模块11和34中的枢纽基因,与淀粉样蛋白和pTau的表达密切相关。除GPNMB外,模块11的hub基因还包括ASAH1、ATG7、STARD13、IQGAP2、CPVL、TANC2和MITF,这些基因在一种或两种AD病理中均有阳性差异表达 (图5a)。作者发现模块11在AD(相对于对照)样本中富集,这些样本来自之前的人类snRNASeq研究。涉及模块11中差异表达的基因通路表明在胆固醇稳态中的功能作用(“调节胆固醇储存”)。作者发现较小的模块34在之前研究中的AD样本中富集。在GPNMB枢纽基因模块34中富集的功能通路与磷脂和脂蛋白稳态(“磷脂efux”、“磷脂稳态”和“脂蛋白代谢”)相关。与血管周围巨噬细胞中GPNMB的预期表达一致,GPNMB的免疫组化显示血管周围以及实质小胶质细胞亚群的明显染色 (图5b)。在这里研究的皮质组织中,AD(相对于对照)中GPNMB阳性细胞平均增加了1.8倍 (图5c)。样本切片中的GPNMB染色密度与组织pTau(R=0.39)以及与对侧半球同一区域被snRNASeq转移的模块11和34(R=0.507和0.576)的表达呈正相关。
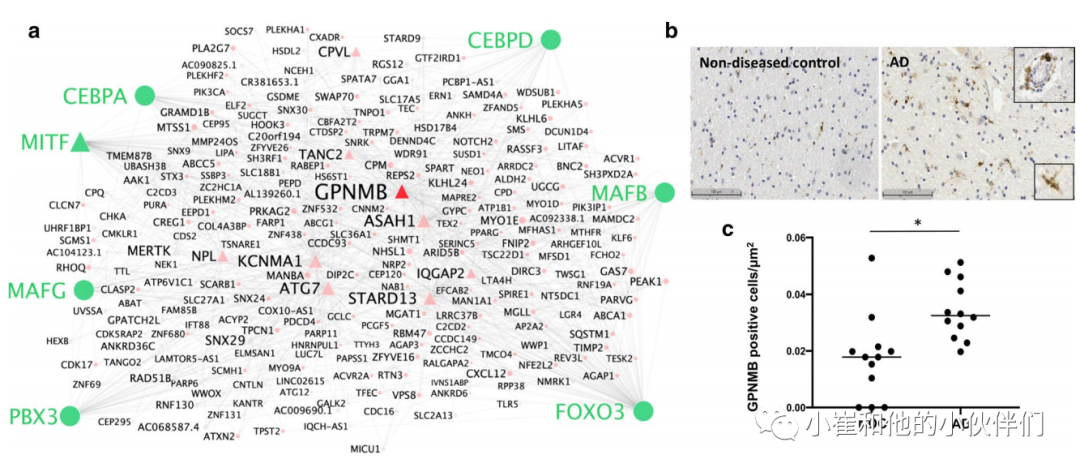
图5. GPNMB是上调与AD病理相关的小胶质细胞基因共表达模块中的枢纽基因
6.人星形胶质细胞和小胶质细胞亚群中与AD病理相关的转录异质性
作者snRNASeq数据的减少识别了6个可区分的簇,它们表达了星形胶质细胞的核心基因集。每个簇表达了不同的基因组,表明了星形胶质细胞的亚型(图1)。Astro1和Astro2表达了更高水平的参与核心星形胶质细胞功能的基因,如SLC1A2(GLT1)和谷氨酰胺合成酶(GLUL),而Astro2丰富了“神经递质摄取”、“谷氨酸能突触”和“氨基酸输入”等途径。相比之下,Astro4和Astro5的特征是与细胞外基质形成和功能有关基因的相对表达,并在包括“碳水化合物结合”和“细胞-基质黏附”等途径中富集。Astro4与Astro5的区别在于Astro4的VEGFA相对较高表达,而Astro5在免疫应答途径中富集,如toll样受体级联和激活星形胶质细胞标记物GFAP。Astro6中的转录本富集了金属硫蛋白基因。Astro5和Astro6对pTau最高上调的调控能力最强(转录因子JUND、MAF和CEBPB)。作者发现 Astro5 和 Astro6 亚组中细胞核数量增加的趋势一致,且在Astro6 亚组中局部β淀粉样蛋白和 pTau 病理均增加。这与Astro1核数量增加的一致趋势有关,pTau表达在EC中有类似的趋势,淀粉样蛋白表达更大。在小鼠模型中转移的疾病相关星形胶质细胞的表达特征在除Astro3外的所有星形胶质细胞簇中4.6%都有疾病相关星形胶质细胞基因表达上调,9.2%的pTau基因表达上调。尽管先前在啮齿动物模型中与损伤反应性或稳态星形胶质细胞相关的 A1(12/15基因表达) 或 A2 (13/13基因表达)基因组分别在星形胶质细胞簇中表现出来,但 A1 和 A2 基因组在总星形胶质细胞核或任何簇中都没有显著富集。这与几项未能复制不同的“A1”和“A2”星形胶质细胞群的啮齿动物和人类研究达成一致。选择由CD163、MRC1(CD206)和MSR1等标记区分血管周围巨噬细胞的聚类参数,作者识别还鉴定了三个表达不同小胶质细胞标记基因的核簇(指定为Micro1、2和3)(图1)。Micro1是最丰富的记录人类核心稳态基因,Micro2显示相对功能浓缩“TYROBP因果网络”和 “铁死亡”途径和Micro3表达较低水平的稳态和激活基因,但有更高的C3和LPAR6表达。Micro2显示MAFG、CEBPA、JUND、CEBPD和MITF蛋白调控的最强特异性,且与淀粉样蛋白和pTau高度相关。在啮齿动物淀粉样蛋白模型中鉴定的斑块诱导 (PIG)、疾病相关 (DAM)、激活反应 (ARM) 和干扰素反应小胶质细胞 (IRM) 基因组在所有簇中均有表达,其中 DAM、ARM、IRM 基因组在 Micro2 中。血管周围巨噬细胞在这些与小胶质细胞激活相关的基因组以及与人类小胶质细胞衰老相关的基因组中也相对丰富。在Micro2和血管周围巨噬细胞亚簇中发现了细胞核数量增加的趋势与更大的β淀粉样蛋白和 pTau 表达有关。
小结
文章通过研究死后AD患者的大脑内嗅皮层和躯体感觉皮层的星形胶质细胞和小胶质细胞的snRNASeq数据,探讨了两者的转录组特征与AD病理的相似性和差异性。文章在扩展了先前报道的AD相关胶质细胞分子病理学工作的同时,还强调了星形胶质细胞和小胶质细胞对AD病理反应的多样性。相对于之前在临床前模型中定义的亚型,文中突出了人类疾病中小胶质细胞和星形胶质细胞的不同特征和更大的功能多样性,这种功能多样性反映了人类星形胶质细胞和小胶质细胞的可区分亚型,表明了其在淀粉样蛋白及pTau清除和神经功能障碍方面的可能调节作用及治疗AD的多个潜在靶点。


