Neuron:镇守边疆,保卫大脑!单核吞噬细胞在大脑中的生理和病理作用
时间:2022-11-30 12:01:56 热度:37.1℃ 作者:网络
中枢神经系统(CNS)含有大量细胞类型,包括神经元、星形胶质细胞、少突胶质细胞、血管内皮及壁细胞和免疫细胞。大多数免疫细胞是单核吞噬细胞(mononuclear phagocytes)系统成员,包括巨噬细胞、单核细胞(monocytes)和传统树突状细胞(cDCs)。
大脑中组织驻留巨噬细胞(TRMs)包括小胶质细胞和边界相关巨噬细胞(BAMs),前者分布于脑实质,可支持神经发生、发育和功能,后者位于CNS边界区域,主要发挥屏障功能和免疫调节作用。外周单核吞噬细胞在大脑边界巡逻,为稳态CNS提供持续的免疫监视来监测感染、恶性肿瘤或组织损伤的迹象,但大量外周免疫细胞浸润CNS也是典型的致病过程。

2022年11月瑞士苏黎世大学实验免疫学研究所的Burkhard Becher?在Neuron期刊上发表的文章全面介绍了CNS单核吞噬细胞系统,并重点概述了其在疾病中的作用(图1)。
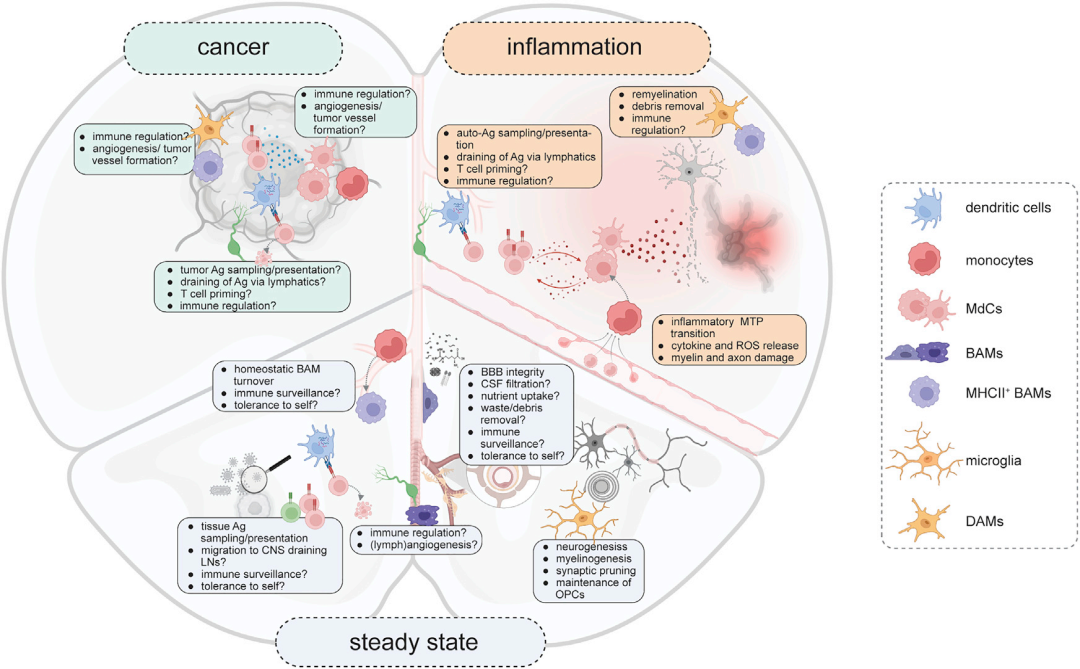
图1. 中枢神经系统单核吞噬细胞的功能
1
稳态CNS中的单核吞噬细胞
除小胶质细胞外,其他单核吞噬细胞几乎全部局限在CNS边界区域。CNS边界区域由脑膜、脉络丛(CP)和血管周围空间组成,被血脑屏障(BBB)与实质隔绝。CNS免疫细胞的相对丰度和多样性可以反映边界区域屏障通透性的差异,随离实质的距离增加而增加(图2),这样的区室化保护神经组织免受免疫病理影响,也赋予CNS相对“免疫特权”。
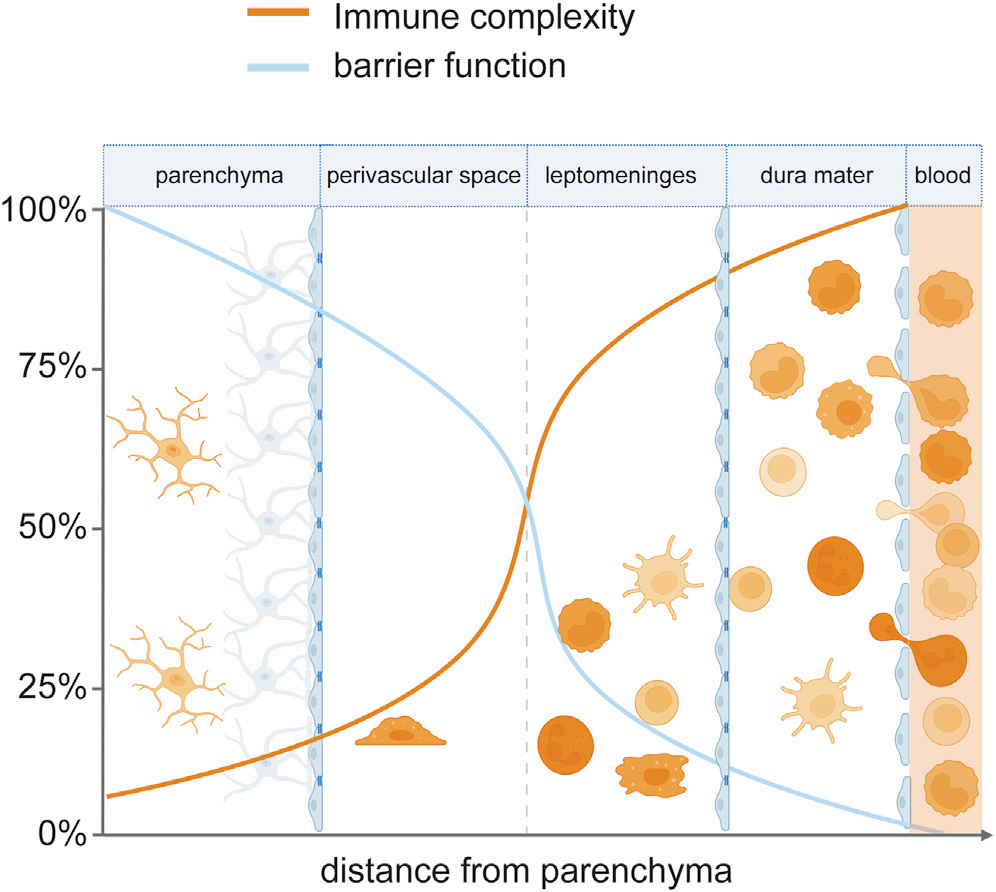
图2. 免疫细胞的复杂性与CNS的屏障通透性呈正相关
CNS驻留的吞噬细胞—维持大脑功能
小胶质细胞起源于胚胎期卵黄囊,在胚胎发育早期进入并定植于CNS实质,成年CNS中小胶质细胞群体的维持依赖于自我更新。小胶质细胞具有明显的时空异质性,其状态取决于局部微环境,并根据生态位内特定需求进行微调。小胶质细胞在CNS功能中扮演关键角色,在发育大脑中引导神经环路形成、参与突触形成及修剪,在成年大脑中维持神经发生、髓鞘发生的和调节血管功能、脑血流量,甚至直接控制交感神经输出。
BAMs是CNS中数量仅次于小胶质细胞的白细胞,起源和小胶质细胞相同。BAMs亚群可根据其在硬脑膜、CP、软脑膜和血管周围的位置进行区分。血管周围、软脑膜BAMs通过自我更新维持数量,而硬膜、CP BAMs则部分依赖外周单核细胞输入。MHCIIhi BAMs富集于硬脑膜,相对于MHCIIlow BAMs具有更高的更新率,可被颅骨骨髓来源的髓样细胞取代。不同边界区域的BAMs功能具有特异性,例如,CP BAMs调节铁摄取/稳态、CSF稳态、Th2反应、先天免疫反应和糖胺聚糖代谢;血管周围和软脑膜BAMs在血管生成、血管维持或营养吸收中发挥作用;硬脑膜BAMs与抗原(Ag)特异性免疫调节功能有关。
浸润CNS的吞噬细胞—控制CNS边界的免疫监视
稳态CNS中,绝大多数非驻留的CNS单核吞噬细胞被限定在CNS边界且只短暂停留。这些吞噬细胞(即单核细胞和cDC)的主要功能是参与免疫监视,保护大脑免受病原体入侵和阻止异常细胞生长。
健康CNS中cDCs数量稀少,负责呈递脑脊液来源的Ag给T细胞。脑cDCs主要来源于颅骨骨髓,分为富集于CP的cDC1和富集于脑膜的cDC2。与其他MHCII+细胞不同,cDCs可通过呈递髓磷脂Ag介导致脑炎性T细胞进入脑实质。
和cDCs一样,经典Ly6Chi和非经典Ly6Clow单核细胞很少存在于健康大脑中。经典单核细胞主要位于硬脑膜中,参与MHCIIhi BAMs的更新,其上表达有病原体识别受体(PRRs),可能是感染或恶性肿瘤的第一个哨兵。非经典单核细胞主要位于脑血管,其寿命较经典单核细胞更长,参与CNS血管系统的监视及免疫调节。
2
疾病中的CNS单核吞噬细胞
脑恶性肿瘤
CNS的相对免疫特权可能驱动脑恶性肿瘤发展,并阻碍抗肿瘤免疫反应。CNS实质的“免疫静止”状态可能促进免疫抑制性脑肿瘤微环境(TME)形成。脑TME由淋巴细胞和髓样细胞组成,对外周T细胞启动或原位免疫具有抑制作用,阻碍抗肿瘤免疫治疗。单核吞噬细胞通常占肿瘤质量的30%,肿瘤相关巨噬细胞(TAMs,包括小胶质细胞和BAMs)、单核细胞和cDCs对肿瘤进展的影响尚不清楚。对脑TME的综合免疫分型显示,TAMs的部分特征具有癌症类型和阶段特异性。
TAM群体具有双重来源,即胚胎来源的小胶质细胞、BAMs 和单核细胞衍生的侵袭性TAMs,增加了抗肿瘤治疗的复杂性。作为TRMs,驻留TAMs同样具有组织保护特性,被认为可促进免疫抑制和肿瘤逃避。TAMs的功能剖析显示小胶质细胞具有促血管生成和T细胞抑制能力。在肿瘤发展中,驻留TAMs的过度保护作用可能适得其反。例如,小鼠胶质瘤中小胶质细胞组织修复相关信号上调,且与生存率降低有关。
侵袭性TAMs促进肿瘤生长,其增加与不良预后有关。复发性胶质瘤中,侵袭性TAMs主导肿瘤微环境,其致瘤机制包括释放血管生成因子、生长因子、蛋白酶和抗炎因子。
DCs在CNS恶性肿瘤中控制T细胞反应,相比于其他APCs,在激活T细胞上更具优势,是抗肿瘤疫苗治疗的潜在靶点。目前,DC疫苗在胶质母细胞瘤的III期临床试验中已取得了一定结果。
自身免疫性神经炎症
免疫抑制特性保护大脑免受过度免疫性疾病(如自身免疫性神经炎症)的影响。激活的吞噬细胞可能通过清除组织碎片和释放神经营养因子产生有益影响,但当暴露于源自脑膜炎症的促炎细胞因子时,也可能转化为细胞毒性表型。
多发性硬化症(MS)是最常见的慢性炎症性CNS脱髓鞘疾病。吞噬细胞的表型已被证明随MS不同的病变阶段而变化,此外,相同的吞噬细胞亚群也可能在不同阶段发挥不同作用。运用fate mapping技术结合单细胞分析,研究者可在炎症过程中区分血源性和胚胎源性吞噬细胞,并鉴定出不同亚群的特异性特征。
驻留巨噬细胞保护CNS免受炎症诱导的组织损伤。“反应性”小胶质细胞已在多种CNS疾病中被观察到,小胶质细胞的激活表型可能是炎症时限制组织损伤的功能性适应结果。小胶质细胞对宿主微生物群的变化非常敏感,肠道-脑轴和肺-脑轴增加了健康和疾病中神经免疫反应的复杂性。由于无法特异性靶向BAMs,目前人们对其在神经炎症中的作用认识有限,现有研究表明其可能促进致脑炎性免疫反应。
与驻留巨噬细胞相反,侵袭性MdCs驱动神经炎症,介导组织损伤。单核吞噬细胞的激活是实验性自身免疫性脑脊髓炎(EAE)临床症状出现的先决条件。循环单核细胞被招募到CNS并分化为MdCs,且数量迅速超过TRMs。MdCs的分化严格依赖于IFN-γ,其致病作用依赖于GM-CSF。MdCs不通过与T细胞直接作用参与致病过程,但可通过释放炎症细胞因子进一步驱动自身免疫T细胞反应。
DCs通过直接调节致脑炎性T细胞反应改善或恶化疾病。CNS DCs可以向CNS边界的浸润细胞呈递Ag,也可以迁移到次级淋巴器官启动自身反应性T细胞或诱导耐受(图3)。
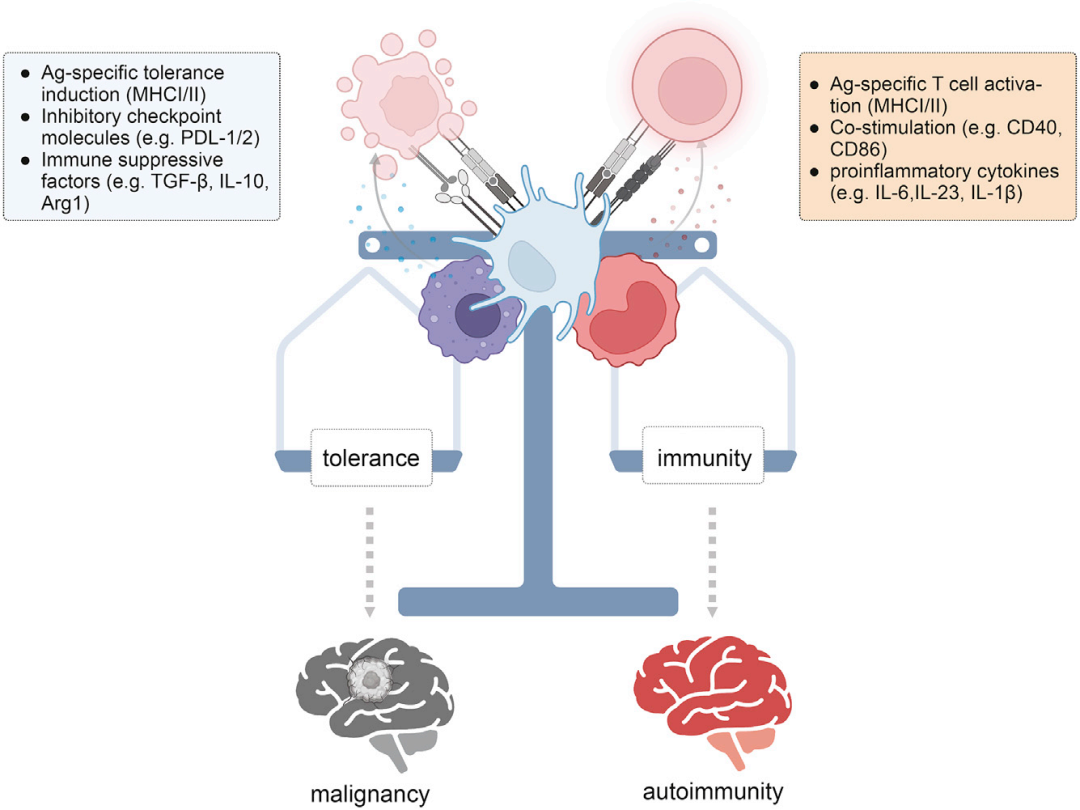
图3: CNS吞噬细胞的免疫原性和耐受性特征
总结
在肿瘤或炎症病变中,很难从表型上区分炎症小胶质细胞和肿瘤病变相关小胶质细胞,以及从外周招募并分化为MdCs的单核细胞,这些变化在疾病背景下的功能意义仍需进一步阐明。具有高特异性和外显性的可诱导性遗传工具可靶向CNS驻留和浸润性吞噬细胞群体,推进这些问题的解决,并解析CNS吞噬细胞在发育、健康和疾病中的特异性功能。
目前,在肿瘤和神经炎症疾病中,临床靶向及治疗效果仍不理想。通过检查点抑制的脑肿瘤免疫治疗也没有取得有意义的临床成果。吞噬细胞可能是推进临床干预CNS病理的新治疗靶点。
原始出处:
Sarah Mundt, et al. The CNS mononuclear phagocyte system in health and disease. neuron,2022.


