国家纳米科学中心陈春英教授Sci.Adv.:周围神经直接介导银纳米材料从肠道向中枢神经系统的跨神经元易位
时间:2023-07-14 17:12:06 热度:37.1℃ 作者:网络
血液循环被认为是口服纳米颗粒进入中枢神经系统(CNS)的唯一途径,而非血液途径介导的纳米颗粒在器官之间的易位尚不清楚。在这里,国家纳米科学中心陈春英教授课题组发现在小鼠和恒河猴中,周围神经纤维可以作为银纳米材料(Ag NMs)从肠道转移到中枢神经系统的直接管道。灌胃后,Ag NMs以颗粒状态在小鼠的大脑和脊髓中显著富集,但不能有效地进入血液。通过迷走神经切断术和选择性脊神经后根切断术,揭示了迷走神经和脊髓神经分别介导了Ag NMs从肠道到大脑和脊髓的转神经元易位。单细胞大规模细胞术分析显示,肠上皮细胞和肠上皮神经细胞吸收了大量的Ag NMs,并在随后转移到连接的周围神经中。
本研究结果表明,纳米颗粒沿着由周围神经介导的肠道-中枢神经系统轴发生转移。相关研究内容以“Peripheral nerves directly mediate the transneuronal translocation of silver nanomaterials from the gut to central nervous system”为题于2023年7月7日发表在《Science Advances》期刊。

【口服Ag NMs进入小鼠和恒河猴的中枢神经系统】
通过口服灌胃将小鼠暴露于Ag NPs和Ag纳米线(Ag NWs)中28天,并检测了NPs在不同器官中的分布(图1A)。电感耦合等离子体质谱(ICP-MS)分析显示,中枢神经系统特别是脊髓,是Ag NPs和Ag NWs的主要靶器官(图1B)。相比之下,静脉给药小鼠中Ag NMs的生物分布模式完全不同(图1C)。接下来通过激光消融电感耦合等离子体质谱(LA-ICP-MS)观察了Ag NPs和Ag NWs的原位分布,表明Ag NPs和Ag NWs主要进入尾状壳核(纹状体)、海马、脑室(第三和第四)和第三小脑小叶(图1D)。
在脊髓方面,Ag NPs主要聚集在腰椎灰质,大量的Ag NPs和Ag NWs定位于整个脊髓的灰质,表明Ag NPs和Ag NWs倾向于聚集在小鼠脊髓的神经元细胞体而不是脊髓轴突(图1E)。在脑沟和脑回中发现了大量的Ag NPs和AgNWs(图1F)以及脊髓灰质(图1G),它们由神经元细胞体组成。这些结果表明,在小鼠和恒河猴的口服暴露后,Ag NPs和Ag NWs倾向于进入中枢神经系统,特别是神经元体细胞。扫描电子显微镜(SEM)分析显示了Ag NPs和Ag NWs在大脑和脊髓中的原始颗粒状态(图1H)。银元素和碳元素的重叠表明了Ag NPs和Ag NWs表面上的蛋白质结合。
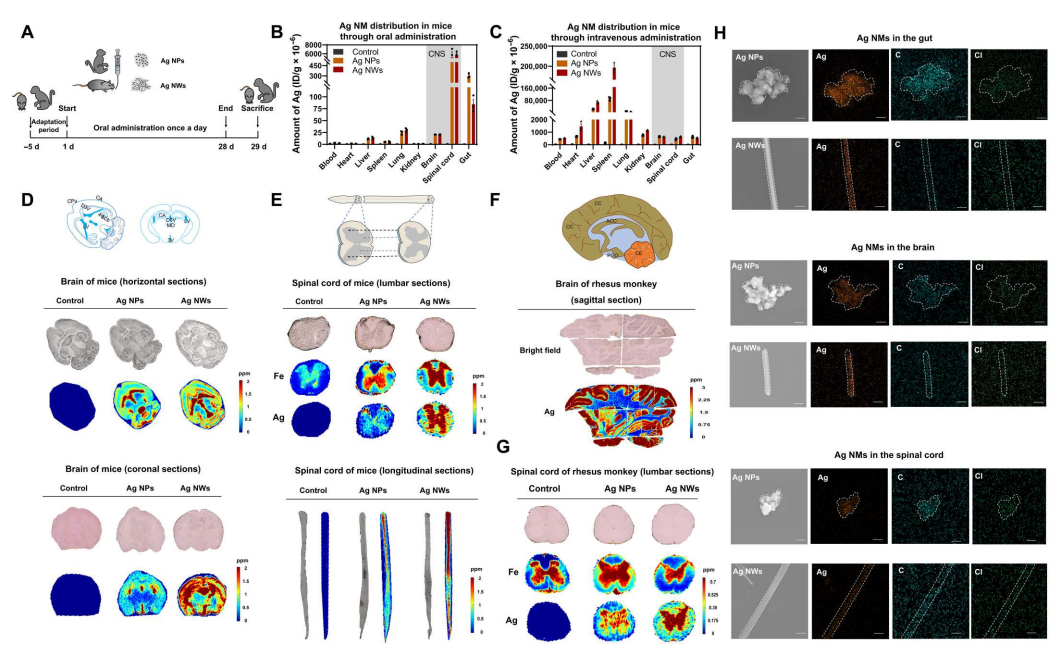
图1 小鼠和恒河猴口服灌胃后中枢神经系统中Ag NMs的生物分布
【迷走神经介导Ag NPs从肠道到大脑的跨神经元运输】
通过经典的Evans蓝(EB)染色试验,灌胃Ag NPs和Ag NWs处理并不影响小鼠血脑屏障的完整性(图2A),这表明Ag NPs和Ag NWs可能不会通过血脑屏障进入大脑。此外,在不同时间(第0~28天),小鼠血液中Ag NPs和Ag NWs的浓度维持在基本水平(图2B),表明NPs不能有效地从肠道进入血液循环。Ag NPs和Ag NWs在大脑中存在累积效应(图2C),这意味着一定存在其他负责NP运输到大脑的途径。迷走神经起源于大脑的延髓,并与食道一起直接与胃肠道相连(图2D)。如图2E所示,与迷走神经完整的组相比,迷走神经治疗小鼠大脑中Ag含量降低了75%,这表明迷走神经截断明显阻止了Ag NPs的肠脑传递,迷走神经是NP从肠道向大脑的直接和中枢通路。Ag NP明显从胃近端扩散至迷走神经节(图2F),揭示了迷走神经能够吞噬Ag NPs,并沿着神经纤维将其运送到大脑。通过热板实验确定,TRPV1显著降低了迷走神经TRPV1的表达,提高了小鼠的疼痛阈值(图2G),表明小鼠模型的成功建立。口服Ag NPs28天后,与对照相比,经RTX治疗的小鼠的Ag NPs急剧下降(图2H),表明TRPV1+神经元是沿迷走神经从肠道到大脑所必需的,从而提示了一种不同于目前已知的转移途径的机制。通过ICP-MS和透射电镜(TEM)((图2I、J)发现,在灌胃Ag NPs或Ag NWs28天后,恒河猴的迷走神经中有Ag NPs和Ag NWs分布。这些结果表明,元素类型、大小、表面修饰等内在特性可以影响Ag NMs在小鼠体内的运输和分布。
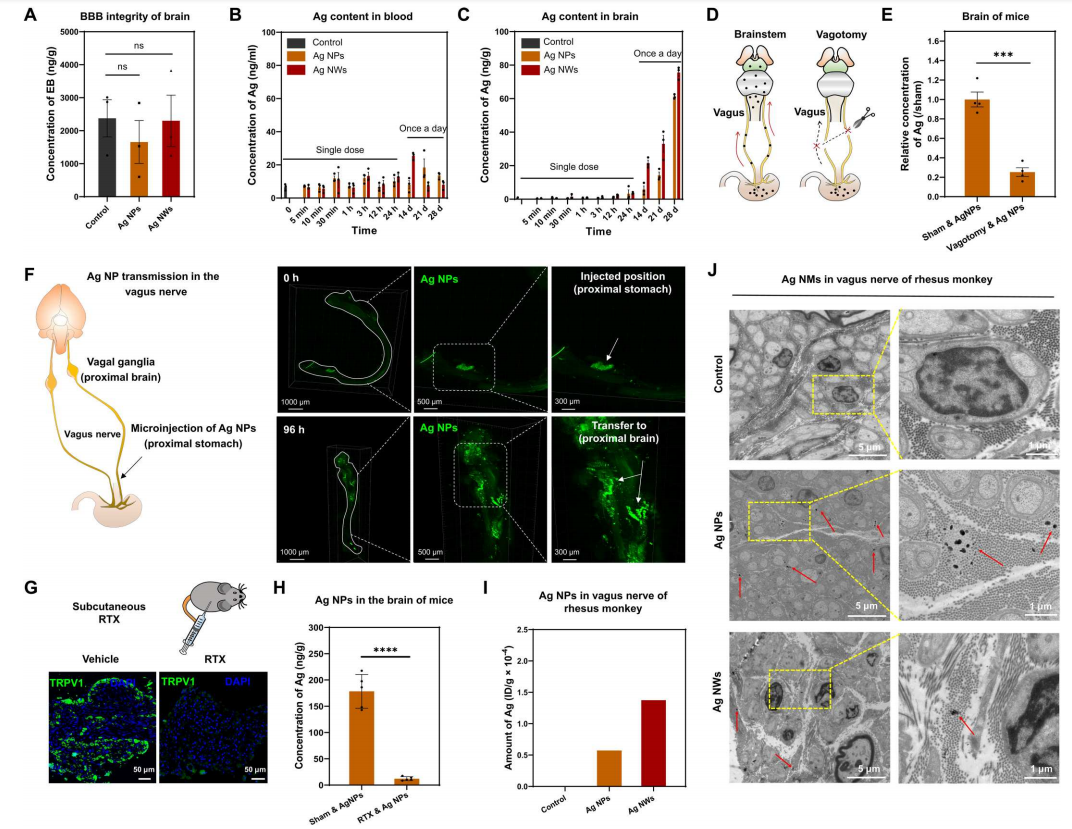
图2 Ag NMs通过迷走神经从肠道运输到大脑
【脊髓神经介导Ag NPs从肠道到脊髓的跨神经元运输】
Ag NPs和Ag NWs在脊髓中积累(图3A),再次表明NPs在肠道向脊髓的传递存在替代途径。通过比较Ag NMs进入脊髓的效率,可以明显看出,口服灌胃的Ag NMs进入脊髓的速率往往高于静脉给药的速率(图3B)。在DRG和脊神经中存在相对较高水平的Ag NMs(图3C)。这些发现再次表明,其他尚未确定的途径直接将NPs从肠道转移到脊髓。为了验证这一途径,通过选择性脊神经后根切断术(SPR)手术切除了小鼠的脊髓神经(L3~L5),然后口服Ag NPs,持续28天(图3D)。脊髓神经损伤后,与假手术组相比,SPR小鼠脊髓中Ag NPs下降了90%(图3E),说明脊髓神经是介导NP从肠道向脊髓转移的关键通路。标记的Ag NPs在治疗后早期被DRG细胞体迅速内吞(图3F)。ICP-MS分析证实了在恒河猴不同区域的脊神经中存在Ag NPs和Ag NWs,包括颈脊神经、胸脊神经和腰脊神经(图3G),其水平高于内脏,如肝、肺和脾(图3H)。这些结果进一步证实了脊髓神经介导的Ag NPs从肠道到脊髓的跨神经元运输是啮齿类动物和灵长类动物共同的途径。
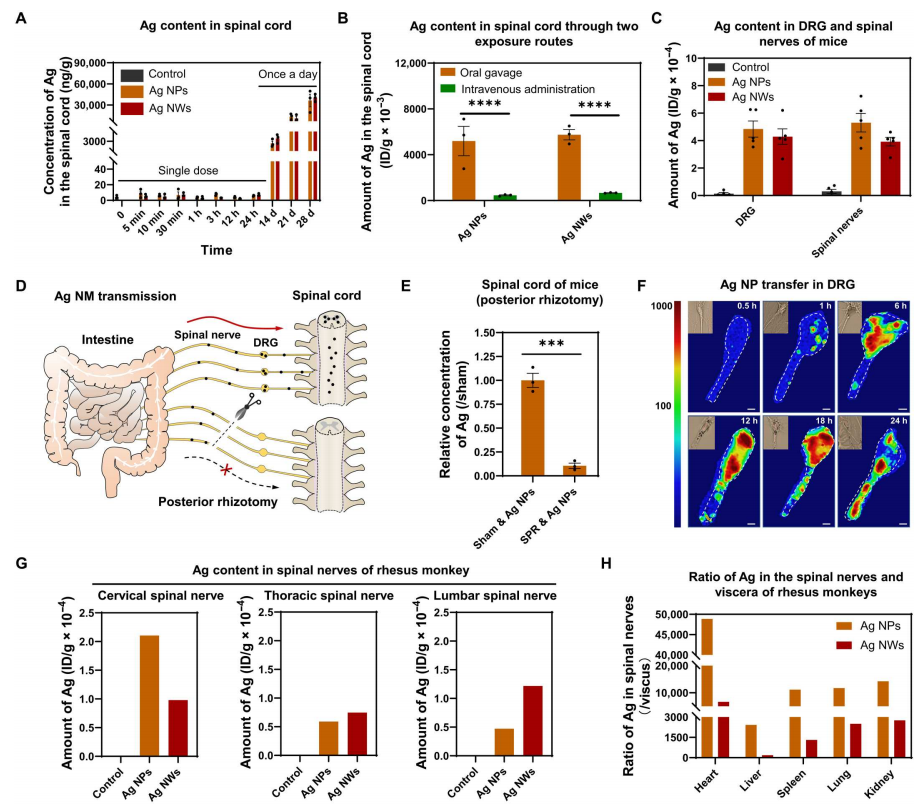
图3 Ag NMs通过脊髓神经从肠道运输到脊髓
【Ag NPs从肠壁转移到神经元】
在6小时后通过ICP-MS分析进行测定,用Ag NPs处理肠上皮细胞(Caco-2细胞系),发现Ag NPs-冠复合物有更大的积累(图4A),这表明胃和肠道中的生物分子都显著促进了上皮细胞对NPs的摄取。20个最丰富的冠状蛋白如图4B所示。纯化Hsc70蛋白冠显著增强了2小时和6小时对Ag NPs的摄取(图4C),从而表明蛋白冠对肠道上皮细胞对Ag NP摄取的关键作用。接下来使用共培养系统检测了NP从肠道上皮细胞转移到初级外周神经元(DRG细胞)的行为(图4D)。Cy-TOF分析显示,肠道中2.45%的细胞能够吸收Ag NPs(图4E)。然后使用图聚类对这些细胞进行划分,并通过t-分布的随机邻域嵌入来映射包含Ag NPs的细胞子集(图4F)。在不同类型的细胞中,免疫细胞群和肠上皮细胞群,包括白细胞、中性粒细胞、单核细胞、杯状细胞和肠内分泌细胞,均表现出较弱的Ag NP摄取(图4G)。相比之下,粘膜下/肌肠丛的肠神经细胞和肠细胞是积累Ag NPs的两个主要细胞群,肠神经细胞比肠细胞吸收更多的Ag NPs(图4H)。因此,肠神经细胞可以通过从肠细胞转移到连接的周围神经来接收Ag NPs(图4I)。
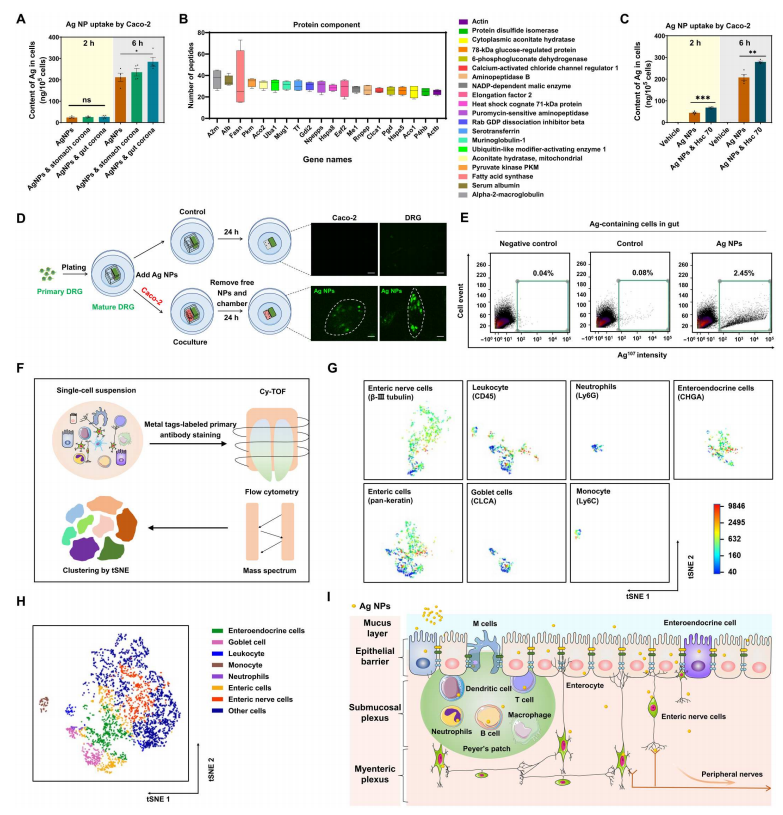
图4 Ag NPs从肠壁转移到神经元
【总结】
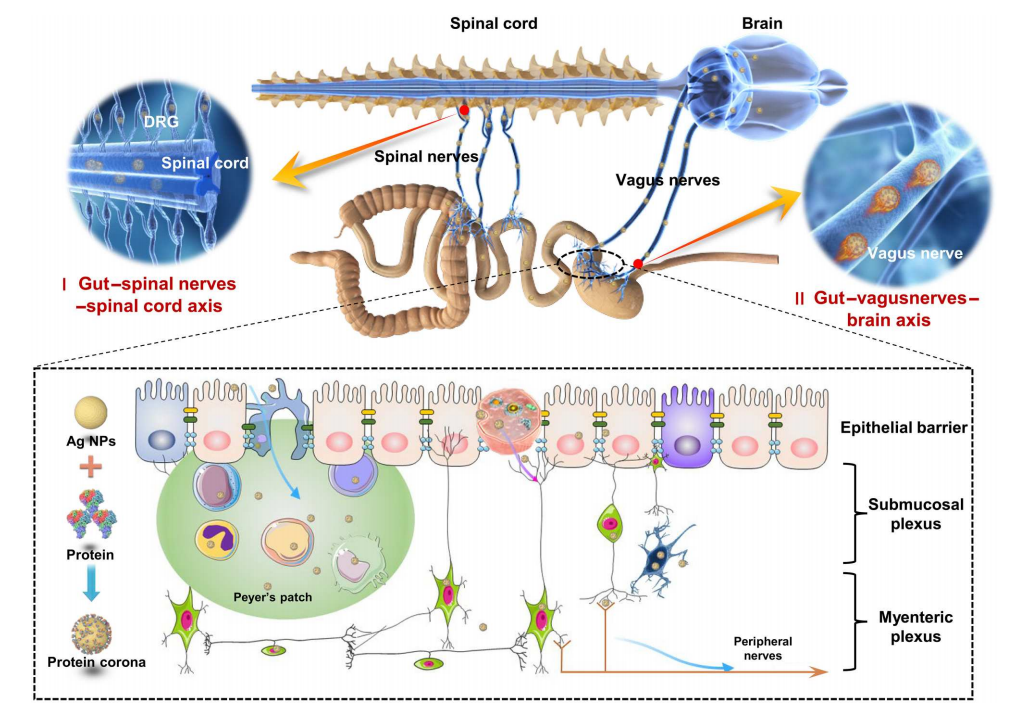
图5 NPs从肠道到中枢神经系统的跨神经元运输的工作模型
综上所述,本研究的关键发现提出并验证了先前未知的Ag NP沿肠脑轴和肠-脊髓轴易位途径,包括NP通过迷走神经和脊神经向中枢神经系统的经神经元运输(图5)。本研究结果主要在两个方面挑战了当前的认知:
(i)周围神经(迷走神经和脊神经)被认为只是化学信号(例如神经递质)传递的一条途径,用于肠道和中枢神经系统之间的通信;
(ii)NPs在口服后使用从肠道到中枢神经系统的唯一途径。迷走神经和脊神经通过解剖结构直接连接肠壁和中枢神经系统,这为NP沿肠-中枢神经系统轴的直接运输提供了直接途径。由于神经元的嗜银特性,Ag NPs比其他类型的细胞更优先进入神经细胞。本研究观察到的小鼠和恒河猴的迷走神经和脊神经表明,周围神经介导的Ag NPs从肠道转向中枢神经系统可能是一种替代的共同途径。这些结果加深了对肠道内NPs与外周神经系统和中枢神经系统之间沟通的理解。基于这些发现,使用跨神经元转运方法治疗中枢神经系统相关疾病的新策略有望出现,为不能有效穿过血脑屏障或血-脊髓屏障的纳米载体/纳米药物提供替代的传递途径。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adg2252.


