ASCO 2021:非小细胞肺癌专场--口头报告(02)
时间:2021-06-05 21:01:44 热度:37.1℃ 作者:网络
摘要介绍5
美国肿瘤学网络社区实践中未经治疗的转移性非小细胞肺癌 (mNSCLC) 患者 (pts) 的生物标志物组织研究
DOI:10.1200/JCO.2021.39.15_suppl.9004
鉴于分子检测和靶向治疗对 mNSCLC 的重要性,MYLUNG(社区癌症网络中的分子信息肺癌治疗)联盟实用研究评估了美国肿瘤学网络内超过 1,000美国各地的供应商。
这是对2018年1月4日至2020年3月31日期间开始一线(1L)系统治疗的mNSCLC患者进行的一项回顾性观察性图表研究。我们评估了ALK、BRAF、EGFR、ROS1和PD-L1的检测率;使用完整的下一代测序板(NGS);从mNSCLC诊断(dx)到1L治疗的时间;从生物标志物订单到结果的TAT;以及从mNSCLCdx到检测结果的时间。
我们确定了3474名成年人。中位年龄为69岁(范围为23-90岁),51%为女性,74%为腺癌,76%有记录的ECOG表现状态为0或1。检测率见表。90%的患者至少进行了一项生物标志物检测,46%的患者接受了全部5项生物标志物检测。从2018年到2020年,检测率的变化是:BRAF为51%到59%,EGFR为71%到71%,ALK为71%到70%,ROS1为69%到67%,PD-L1为82%到84%,接受所有5种生物标志物检测的患者为42%到49%。NGS检测从33%增加到44%(P<0.0001)。所有患者从mNSCLC诊断到1L治疗的时间中位数(四分位数[IQR])为35天。从生物标志物检测单到结果的中位数(IQR)TAT 10到15天;从mNSCLC诊断到生物标志物结果的时间为14到21天。
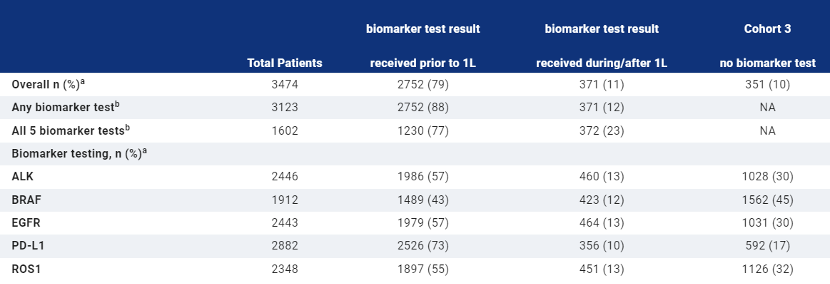
这项真实世界的研究显示,大多数患者在1L前至少接受了一项生物标志物检测,但<50%的患者接受了全部5项检测。<50%的患者进行了NGS检测,但在研究期间有所增加。从诊断到1L治疗的中位时间约为5周,从订单到结果的TAT约为2周。将报告按组织学和其他趋势进行的分析。这些数据将与MYLUNG研究的下一阶段进行比较,该研究将前瞻性地评估当代订购做法和TAT。
摘要介绍6
非小细胞肺癌 (NSCLC) 生物标志物检测和临床试验注册的种族差异
DOI:10.1200/JCO.2021.39.15_suppl.9005
癌症种族差异可能存在于医疗保健系统的许多层面,从筛查到及时诊断和接受治疗,以及临床试验注册。本研究调查了在美国接受生物标志物检测和临床试验登记的非小细胞肺癌患者中黑人与白人种族的差异。
这项回顾性观察研究利用了 Flatiron Health 数据库,其中包括晚期/转移性 NSCLC 患者的纵向数据。如果患者在 2017 年 1 月 1 日至 2020 年 10 月 30 日期间在数据库中有系统治疗的证据,则他们符合条件。描述性分析总结了生物标志物测试和试验注册中种族的差异。多变量回归检验了这些因素之间的关系。
共有14,768名患者符合条件:9,793 (66.3%) 名白人,1,288 (8.7%) 名黑人。76.4%的白人患者和73.6%的黑人患者接受了至少一项单一分子检测或综合基因组分析(p = 0.03)。在50.1%的白人患者和39.8% 的黑人患者中进行了下一代测序 (NGS)(p < 0.0001。在3.9%的白人患者和 1.9% 的黑人患者中观察到试验参与(p = 0.0002)。有一个种族(白人与黑人)与生物标志物检测(曾经与从未)和试验参与(是与否)(均 p < 0.001,未调整卡方)之间存在统计学显着关联。NGS 检测、基线生物标志物检测和种族的差异为在调整后的回归分析中保留为统计显着性 (p < 0.01)。白人和黑人患者接受一线靶向治疗的比例相当(分别为 10.2% 和 9.2%,p = 0.24);然而,这个总结没有考虑生物标志物测试结果。在19.8%的白人和22.6%的黑人患者中观察到派姆单抗+卡铂+培美曲塞的一线使用;在16.5%和18.6%之间观察到卡铂+紫杉醇,在14.8%和11.5%之间观察到单药派姆单抗。
美国国家综合癌症网络肿瘤学临床指南推荐用于晚期/转移性 NSCLC 患者的基于 NGS 的检测是黑人患者中最显着的差异,接受检测的差异超过 10 个百分点这个测试与白人同行。这可能部分有助于白人患者中观察到的临床试验参与率增加一倍以上,因为许多二线及以后的试验利用分子靶标作为纳入标准。虽然已知多种因素会影响医疗保健差异,但为了确保平等获得优质护理,获得和接受适当的生物标志物检测可能是一个可行的目标。
摘要介绍7
Amivantamab 与 lazertinib 联合用于治疗奥希替尼复发的、未接受化疗的 EGFR 突变 (EGFRm) 非小细胞肺癌 (NSCLC) 和潜在的反应生物标志物
DOI:10.1200/JCO.2021.39.15_suppl.9006
在初治和奥希替尼 (osi)复发的EGFRm NSCLC 患者(pts)中,观察到amivantamab(一种 EGFR-MET 双特异性抗体)和lazertinib(一种第三代酪氨酸激酶抑制剂)的组合的初步疗效。我们在osi复发患者中提供了联合治疗的最新结果,包括对潜在反应生物标志物的分析。
患有EGFR第19号外显子缺失或L858R突变的NSCLC患者,在接受OSI治疗后没有进行化疗,被纳入正在进行的CHRYSALIS研究(NCT02609776)的组合队列中。通过前瞻性地收集治疗前的肿瘤活检和ctDNA,患者接受1050/1400毫克amivantamab+240毫克lazertinib的联合剂量,以评估osi复发人群的安全性和有效性。调查员根据RECIST v1.1评估反应。通过下一代测序(NGS)在ctDNA或肿瘤活检(生物标志物阳性[pos])中发现的Osi抗性突变或EGFR/MET扩增,被评估为丰富的反应。免疫组化(IHC)对EGFR和MET表达的染色也被探索为反应的潜在生物标志物。
在45名osi复发患者中,36%(95% CI,22-51)有确认的反应(1个完全反应和15个部分反应 [PR])。中位随访时间为 8.2个月(1.0-11.8),20/45患者(44%)仍在接受治疗。11/16患者 (69%) 持续缓解(2.6-9.6+ 个月),尚未达到中位缓解持续时间 (NR)。中位无进展生存期 (mPFS) 为 4.9 个月(95% CI,3.7-8.3)。总共有44/45患者可通过 ctDNA 进行评估,29/45 可通过肿瘤 NGS 进行评估。基因检测确定了17个生物标志物阳性患者,其中 8 个 (47%) 有反应。在剩余的 28 分中,8分(29%)做出了回应。在这 28 名患者中,18名患者的耐药机制未知(8 名 PR),10名患者发现了非EGFR/MET耐药机制(无应答)。生物标志物pos和剩余pts的mPFS(95% CI)分别为6.7个月(3.4-NR)和4.1个月(1.4-9.5)。
使用amivantamab和 lazertinib的组合治疗在 36% 的osi进展的未接受化疗的患者中产生了反应。在这些患者中,基于基因EGFR和MET的耐药生物标志物确定了一个更可能对 amivantamab 和 lazertinib 产生反应的患者亚组,尽管其他缺乏确定的耐药标记的患者也有反应。基于IHC的方法可以确定最有可能从联合方案中受益的患者,但有必要进行进一步的研究。
摘要介绍8
patritumab deruxtecan (HER3-DXd) 在 EGFR 抑制剂耐药、EGFR突变 ( EGFR m) 非小细胞肺癌 (NSCLC) 中的疗效和安全性
DOI:10.1200/JCO.2021.39.15_suppl.9007
在EGFR TKI和铂类化疗 (PBC) 失败后,晚期EGFR m NSCLC患者 (pts) 的治疗选择有限。HER3-DXd 是一种抗体药物偶联物,由针对 HER3 的全人源单克隆抗体通过基于四肽的可切割接头连接至拓扑异构酶 I 抑制剂有效载荷组成。我们之前介绍了一项正在进行的 EGFR TKI 治疗失败后EGFR m NSCLC中 HER3-DXd 研究的有效性/安全性数据(中位随访时间,5.4 个月)。我们现在对接受推荐剂量的患者进行扩展随访(5.6 mg/kg IV Q3W)。
这项 1 期剂量递增/扩展研究包括先前接受过EGFR TKI治疗的局部晚期或转移性EGFR m NSCLC患者 (NCT03260491)。允许具有稳定脑转移 (BM) 的患者。根据RECIST v1.1,主要终点通过盲法独立中央审查 (BICR) 确认ORR;次要终点包括DOR、PFS和安全性。
研究中,57名患者接受了HER3-DXd 5.6 mg/kg静脉注射Q3W治疗;中位随访,10.2 mo。先前的抗癌方案的中位数为4。100%曾接受过EGFR TKI治疗(86%曾接受过奥希美替尼[OSI]),91%曾接受过PBC治疗。47%有BM病史。中位治疗时间为5.5月;18名患者(32%)正在接受治疗。通过BICR确认的ORR为39%,14/22个反应发生在开始HER3-DXd的3个月内。DCR为72%(95%CI,58.5%-83.0%)。中位DOR为6.9 mo(95% CI,3.1 mo-NE),中位PFS为8.2 mo(95% CI,4.4-8.3 mo)。在不同的EGFR TKI耐药机制中观察到抗肿瘤活性,包括那些与HER3不直接相关的机制(EGFR C797S、MET或HER2 amp和BRAF融合)。在先前有PBC的患者中,ORR为37%(19/52;95%CI,23.6%-51.0%);在先前有OSI和PBC的患者中,ORR为39%(17/44;95%CI,24.4%-54.5%)。在43名可评估HER3表达的患者中,几乎所有人都表达了HER3;通过IHC的膜H-score中位数是180(范围,2-280)。CR/PR患者的H评分中位数(范围;N)为195(92-268;15),SD患者为180(4-280;15),PD患者为126.5(2-251;6),无最佳总反应价值的患者为180(36-180;7)。最常见的≥3级不良事件(AEs)是血小板减少(30%)、中性粒细胞减少(19%)和疲劳(14%)。4名患者(7%;1名≥3级[2%];无5级)发生了中央裁决的药物相关的间质性肺部疾病。6/57名患者(11%)出现了与治疗中止有关的AE(没有人是由于血小板减少)。
HER3-DXd 5.6 mg/kg IV Q3W 在经过大量预处理的转移性/局部晚期EGFR m NSCLC 的各种 EGFR TKI 耐药机制中显示出抗肿瘤活性。安全性与之前的报告一致。EGFR TKI 和 PBC 失败后EGFR m NSCLC患者中 HER3-DXd 的 2 期研究已经启动(NCT04619004)。
摘要介绍9
DZD9008在具有EGFR Exon20插入突变的NSCLC患者中的1期研究的初步安全性和有效性结果
DOI:10.1200/JCO.2021.39.15_suppl.9008
没有批准的靶向治疗用于 EGFR 外显子 20 插入 (exon20ins) 突变 NSCLC。DZD9008 是一种设计合理的选择性、不可逆 EGFR exon20ins 抑制剂,正在两项正在进行的 1/2 期研究(NCT03974022 和 CTR20192097)中进行研究。
这些研究的目的是评估DZD9008对有EGFR或HER2突变的NSCLC的安全性、耐受性、药代动力学和初步抗肿瘤疗效。这两项研究都包括剂量升级和扩展队列。汇总分析被应用于定义推荐的2期剂量(RP2D)。
在2019年7月9日至2021年2月5日期间,97名EGFR或HER2突变的NSCLC患者服用了DZD9008(剂量范围:50毫克至400毫克,每天一次)。男/女:44/53;59人有EGFR外显子20。DZD9008的耐受性良好,最高为400毫克(MTD),每天一次。DLTs为腹泻和心律失常。最常见的TEAEs是腹泻(3级,5.2%)和皮疹(3级,1%)。DZD9008显示出近似于剂量比例的PK,半衰期约为50小时。56名有>16种不同EGFR外显子20ins突变的患者有>1次治疗后疗效评估。既往治疗:中位数2(范围1-10),既往化疗92.9%(52/);既往TKI 44.6%(25/56),包括1名患者曾接受过波齐尼治疗;42.9%(24/56)有脑转移。在≥100毫克的剂量水平上观察到部分反应。在RP2D剂量为300毫克,每天一次时,客观反应率为48.4%(15/31),疾病控制率(DCR)为90.3%(28/31)。2名之前接受过JNJ-61186372治疗的患者出现了反应。在不同的EGFR外显子20ins突变亚型中均观察到抗肿瘤活性。根据数据截止,中位治疗时间为100天(范围1-422)。最长的应答时间超过6个月,22名应答者中有18人仍在应答。
DZD9008 在 EGFR exon20ins 突变的预处理 NSCLC 中显示出良好的安全性和有希望的抗肿瘤功效。更新后的数据将在会议上公布。DZD9008目前处于II期临床开发阶段(NCT03974022)。


