Front Immunol:γδT细胞免疫疗法的最新临床研究进展
时间:2023-04-26 18:18:37 热度:37.1℃ 作者:网络
γδT细胞是固有免疫系统中的效应细胞,这些细胞以 MHC 不受限制的方式发挥作用,使它们成为癌症免疫治疗的理想介质,近年来在过继性T细胞免疫疗法中越来越受欢迎。
T细胞有两种类型:αβT细胞和γδT细胞。前者表达T细胞受体(TCR),该受体包含α链和β链的异二聚体。后者表达包含γ链和δ链异二聚体的TCR,通常不表达共受体CD4和CD8,平均占人类外周血T细胞的4%。γδT细胞是MHC非依赖性的,并已被发现识别多种配体分子,如BTN家族蛋白(BTN2A1/BTN3A1和BTNL3/BTNL8)、MHC相关蛋白。γδT细胞通过其TCR识别这些分子,并表达先天受体,如NKG2D、Toll样受体(TLRs)和CD16。
γδT细胞在对抗感染性和肿瘤疾病中发挥重要作用,γδT细胞的免疫反应本质上偏向于I型免疫,I型免疫对感染细胞和肿瘤细胞产生强烈的细胞毒性作用(主要通过颗粒酶B和穿孔素),并导致IFN-γ产生增加。已有的研究表明,γδT细胞与癌症的良好预后呈正相关。这进一步支持了在癌症治疗中引入γδT细胞免疫疗法。
γδT细胞免疫治疗的开发策略
目前,制药公司在开发基于γδT细胞的抗癌疗法方面取得了很大进展。这些公司正在开发的临床前和临床阶段γδT细胞相关抗癌产品,设计的方法更加多样化。
制药行业大多采用了四大类基本策略。第一种是不经修饰的过继疗法,在该策略中,研究人员专注于利用效应γδT细胞的天然能力,并利用其不依赖MHC的性质,利用“现成”、安全使用和易于生产的特点。该方法包括利用Vδ2和Vδ1γδT细胞,重点优化扩增步骤,例如GammaDelta Therapeutics和PhosphoGam公司的产品。
第二种是修饰后的过继疗法。将经典的CAR结构引入γδT细胞是这一策略的起点,至少有九家公司使用了典型的CAR-T细胞技术。CAR-γδT细胞的靶标可分为两类:一类是在肿瘤中高表达的抗原,如GPC3和间皮素,另一类是受体,如NKG2DL和PD-L1。此外,许多公司都设计了改良的CAR。一种类似于TCR-T细胞技术的策略是将选定的抗肿瘤γδTCR移植到αβT细胞中,如Gadeta;或使用γδTCR结构域修饰CARs,例如Eureka Biotechnology公司。另一种策略结合了诱导多能干细胞(iPSC)和CAR技术来生产现成的CAR-γδT细胞,如Century Therapeutics和CytoMed Therapeutics生产的细胞。除了通过CAR修饰γδT细胞外,近年来,CRISPR的基因编辑也被IN8bio和Immatics等公司普遍使用。
第三是基于抗体的策略。ImCheck已使用抗BTN抗体在体内刺激Vγ9Vδ2 T细胞;在他们I/II期临床试验的早期分析中,ICT01(抗BTN3A抗体)在22名患者队列中显示出36%的疾病控制率。LAVA Therapeutics和Shattuck等几家公司使用双特异性抗体来激活γδT细胞并赋予其特异性。PureTech使用抗Vδ1抗体来阻断Vδ1γδT细胞。Acepodia将基于抗体的方法与过继细胞转移相结合,其中γδT细胞被肿瘤特异性抗体化学修饰。
最后是化学药物的使用和对肿瘤的修饰。美国基因技术公司旨在对肿瘤细胞进行基因修饰,以提高其PAgs水平,并原位激活Vγ9Vδ2 T细胞。AVM生物技术公司利用高浓度药物地塞米松磷酸盐的抗肿瘤作用涉及γδTCR+NKT细胞的激活。这种药物可以单独给药,也可以在CAR-T细胞治疗前作为预处理剂给药。
已有的γδT细胞免疫疗法临床结果
截至2022年10月,至少有28项γδT细胞免疫疗法研究(37个队列)正在临床中进行,所有这些研究都使用了Vγ9Vδ2 T细胞。这些研究共包括559名患者,其中有14个队列接受体内刺激,23个队列接受过继细胞转移。早期的研究通常是单药治疗,后期的研究开始将γδT淋巴细胞治疗与其他传统治疗相结合,通常是化疗。此外,81%的队列接受γδT细胞治疗是用于治疗实体癌,其中肺癌和肾癌是测试最多的肿瘤。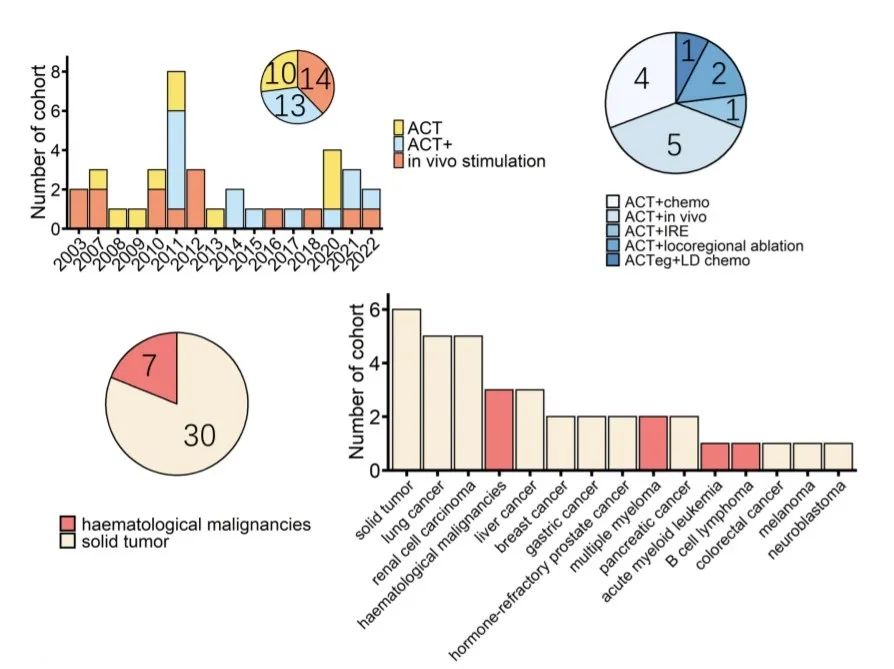
在307名可以测量肿瘤反应的患者(来自27个队列)中,无论策略如何,客观缓解率(ORR)为18%,疾病稳定(SD)率为31%。当对每种情况下的患者数量分别进行比较时,体内刺激与ACT以及ACT与ACT+之间显示出显著差异,而体内刺激与ACT+相似。然而,当详细检查结果时,发现对体内刺激治疗的最佳反应只有PR,最大的贡献来自将体内刺激与PD-1治疗相结合的研究。相比之下,在接受ACT+治疗的20名ORR患者中,有11人获得了CR。
此外,由于肿瘤类型会对治疗反应产生重大影响,因此在这组307名患者中比较了血液癌和实体癌患者的反应。其中,49名患者患有血液学癌症,而258名患者患有实体癌。血液学癌症患者中,37%(18名患者)实现响应(合并OR率30.1%),实体瘤患者中14%(36名患者)实现响应(合并OR率5.6%)
进行中的γδT细胞临床研究
截至2022年11月15日,至少有48项γδT细胞相关临床试验在ClinicalTrials上注册。在这些试验中,30项(63%)正在进行中,其中大多数是I期试验,旨在测试使用Vγ9Vδ2 T细胞治疗癌症的安全性和初步疗效。在所有这些试验的发起者中,中国和美国占81%。此外,这些注册试验也显示了在临床中应用γδT细胞策略的动态演变。
有趣的是,自2017年以来,γδT细胞临床试验的数量急剧增加。首个使用修饰γδT细胞(CAR-T)的临床试验于2016年在中国公布,并于2017年在中国开始。从那时起,又开始了10种CAR修饰的γδT细胞疗法,一项基因修饰的研究专注于增加γδT淋巴细胞的化学耐药性(NCT04165941),以及一项应用TCR-T细胞技术的研究,该技术将肿瘤细胞毒性γδTCR转化为αβT细胞(NCT04688853)。除了直接操纵T细胞外,Vγ9Vδ2 T细胞活化抗体的使用,无论是人源化抗BTN3A抗体(NCT04243499)还是工程化肿瘤-γδTCR双特异性抗体(NCT05369000,NCT04887259),在过去两年中都已成为一种新趋势。
在2017年之后的34项过继细胞转移试验中,30项明确细胞起源的临床试验中有20项使用了异基因γδT细胞。在观察治疗的癌症类型时,2017年之前,γδT细胞治疗致力于治疗实体肿瘤,但在启动CAR-γδT细胞治疗后,情况发生了变化。目前注册的CAR-γδT细胞治疗试验主要测试其在血液系统恶性肿瘤中的应用。白血病和肝癌分别是检测最多的血液癌和实体癌。
小结
回顾过去的γδT细胞免疫治疗的临床结果可以得出几个结论。首先,γδT细胞免疫疗法在临床上是一种安全的方法,无论是体内刺激、回输,还是自体或同种异体回输。一般来说,比2级更严重的不良事件与γδT细胞治疗没有直接关系,可以得到充分控制。其次,将γδT细胞疗法与其他常规疗法或体内刺激相结合显示出有希望的结果。研究表明放射治疗具有刺激性免疫调节作用。这种联合治疗产生的激活的肿瘤微环境可能有助于再注射的效应γδT细胞在肿瘤内有效运作。最后,新的方法,包括γδT细胞和免疫检查点抑制剂联合免疫治疗,双特异性抗体和 CAR-γδT 细胞都是有望克服目前治疗局限性的新策略。TME对γδT 细胞 免疫抑制作用的进一步研究,以及抗癌药物联合治疗、分子靶向药物、表观遗传药物、双特异性抗体以及 CAR-γδT 细胞的临床研究,将为未来γδT 细胞免疫治疗的临床应用奠定基础。
参考文献:
1. A close look at current γδ T-cell immunotherapy. Front Immunol. 2023 Mar 31;14:1140623


