病理干货 | 一文讲明白:甲状腺基因检测的意义
时间:2023-11-18 21:21:26 热度:37.1℃ 作者:网络
甲状腺癌是内分泌系统常见的恶性肿瘤,据中国肿瘤登记中心的数据显示,我国城市地区女性甲状腺癌发病率位居女性所有恶性肿瘤的第4位[1]。如何精准诊断甲状腺结节良恶性,从甲状腺癌的生物学角度,特别是从肿瘤的基因层面认识甲状腺癌的发病机制,鉴别低风险甲状腺癌和高风险甲状腺癌,是明确诊断、避免过度治疗、规范彻底治疗和建立个体化预后管理模式非常重要的过程。
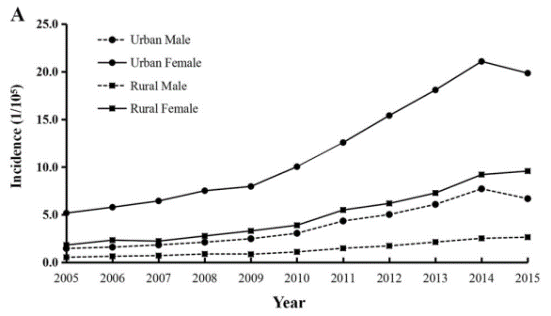
图1:甲状腺癌的流行病学数据统计[2]
01 甲状腺癌及其分类[3]
甲状腺癌分为分化型甲状腺癌(DTC)、髓样甲状腺癌(MTC)和未分化甲状腺癌(ATC)。其中DTC又分为乳头状甲状腺癌(PTC)和滤泡状甲状腺癌(FTC)。各种类型的甲状腺癌恶性程度不同,治疗方式和预后也大相径庭。DTC在临床最常见,约占所有甲状腺癌的95%。,预后一般较好,但是部分甲状腺癌患者早期已出现局部器官侵犯、颈部淋巴转移或远处器官转移,严重影响患者生活质量和生存期。低分化甲状腺癌(PDTC)一般被认为来源于DTC,其生物学行为位于DTC和ATC之间。乳头状甲状腺微小癌(PTMC)一般预后较好,但仍有15%~20%出现复发、颈部淋巴结转移或远处器官转移,甚至危及生命。
02 基因检测对甲状腺肿瘤有哪些意义?
《CSCO分化型甲状腺癌诊疗指南(2021版)》指出,基因检测有助于甲状腺结节良恶性鉴别、肿瘤复发风险分层,并为DTC靶向治疗提供分子依据[3] 。

◉ 意义1:基因检测辅助甲状腺结节良恶性的鉴别[1,3-5]
明确诊断是肿瘤治疗的前提,超声及超声引导下的细针穿刺(FNA)是甲状腺结节良恶性甄别的首选方法。国内通常将2017 版Bethesda系统(TBSRTC)作为甲状腺细胞病理诊断标准。根据诊断标准,细胞学分别诊断为:标本无法诊断或标本不满意(Ⅰ类)、良性(Ⅱ类)、意义不明确的细胞不典型病变/滤泡性病变(AUS/FLUS)(Ⅲ类)、滤泡性肿瘤/可疑滤泡性肿瘤(FN/SFN)(Ⅳ类)、可疑恶性肿瘤(Ⅴ类)和恶性肿瘤(Ⅵ类)六大类型。其中,Ⅲ至Ⅳ类不确定的诊断给临床带来巨大挑战,因为良恶性诊断决定了甲状腺结节管理方案如何制定。
甲状腺癌NCCN指南(2022.V2)和甲状腺癌诊疗指南(2022版)认为:经FNA不能确定良恶性的甲状腺结节,可对穿刺标本进行某些甲状腺癌的分子标记物检测,如BRAF突变、RAS突变、RET/PTC重排等,有助于提高确诊率。术前检测BRAF突变状况,还有助于PTC的诊断和临床预后预测,便于制定个体化的诊治方案。

◉ 意义2:基因检测辅助DTC个体化管理方案制定[4,6]
外科手术是治疗甲状腺癌的主要手段,通过多基因检测,可以让医生更加全面地了解患者的病情程度,从而选择相应的手术治疗方式。根据2015版美国甲状腺协会(ATA)指南,DTC(分化型甲状腺癌)需要行甲状腺腺叶切除,但是如果术前已明确存在BRAF突变,手术应联合淋巴清扫或甲状腺全切除术;BRAF突变与肿瘤复发相关,预防性中央区淋巴结清扫术被推荐应用于BRAF突变的甲状腺癌患者。腺叶切除及患侧中央区淋巴结清扫是DTC的基本治疗术式,对于是否需要扩大手术范围,甲状腺癌基因检测与临床应用广东专家共识(2020版)推荐结合基因变异情况(如 BRAF/RAS 合并 TERT、PIK3CA、TP53 等)来判断肿瘤复发危险度,从而制定个体化手术方案。DTC(cN0) 管理方案具体操作流程推荐如下图:

分化型甲状腺癌(cN0)基因变异与个体化管理方案制定推荐:具体手术方案的制定应根据影像学和细胞学等临床资料综合考虑;(a)多基因突变特指BRAF/RAS合并TERT、PIK3CA、TP53等突变;分化型甲状腺癌(DTC);乳头状甲状腺微小癌(PTMC);放射性碘(radioiodine, RAI)
◉ 意义3:基因检测指导甲状腺癌靶向/免疫治疗[5]
靶向治疗是放射性碘抵抗或手术不能切除的甲状腺癌患者的重要治疗方式,能减轻患者的症状并延长生存期。

甲状腺癌NCCN指南(2022.V2)指出,局部复发、晚期和/或转移性甲状腺腺癌无需行放射碘(RAI)治疗,并且推荐患者检测 BRAF V600E、RET、NTRK、ALK融合指导靶向治疗;推荐MMR、MSI和TMB检测指导患者免疫治疗。
◉ 意义4:基因检测预测甲状腺癌RAI抵抗[7]
BRAF基因突变上调促癌基因VEGF和MET表达,BRAF突变与肿瘤的侵袭能力和碘治疗失败密切相关。TERT 启动子突变也与甲状腺癌吸碘或碘难治密切相关。一项回顾性研究,研究了164名中位年龄为50岁(35-62岁)的患者(104名女性和60名男性)在复发性PTC中RAI亲和力的丧失与V600E基因型和启动子突变之间的关系。研究表明:BRAF V600EV突变、尤其是BRAF V600EV合并TERT启动子突变与复发性PTC患者RAI抵抗密切相关,对PTC患者RAI治疗失败具有预测意义。
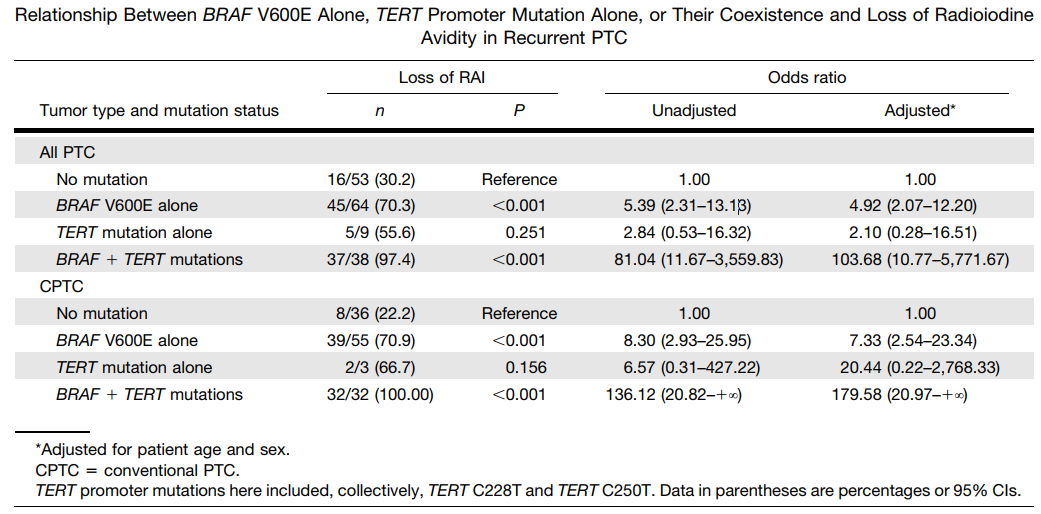
BRAFV600E突变与碘难治、淋巴结转移密切相关,BRAF V600E联合TERT启动子共突变推荐行颈部淋巴结的预防性清扫以提高治愈率,因为此类型病例对放射性碘不敏感,同位素治疗效果差。BRAF/RAS联合PIK3CA、TP53、EIFIA、CTNNB1等基因突变同样预示着肿瘤的高侵袭性,与碘抵抗密切相关。专家认为基因检测可评估 DTC 对放射性碘的敏感性,指导治疗的选择、剂量调整、预测疗效或联合应用MAPK 通路抑制剂[4]。
◉ 意义5:基因检测辅助甲状腺癌复发/预后风险分层
2017年JAMA Oncol杂志发表的临床相关性研究检测了1051名患者(764名女性和287名男性)的BRAF V600E和TERT启动子突变和PTC特异性死亡率相关性,发现BRAF V600E和TERT启动子突变可对PTC的死亡风险分层[8]。Rengyun Liu等人对507名年龄为45.9±14.0岁(平均值±标准差)的患者(365名女性和142名男性)的BRAF和TERT C228T突变与PTC高危临床病理特征的关系进行了回顾性研究,BRAF V600E和TERT C228T共突变的PTC患者复发风险比单个基因突变更高[9]。
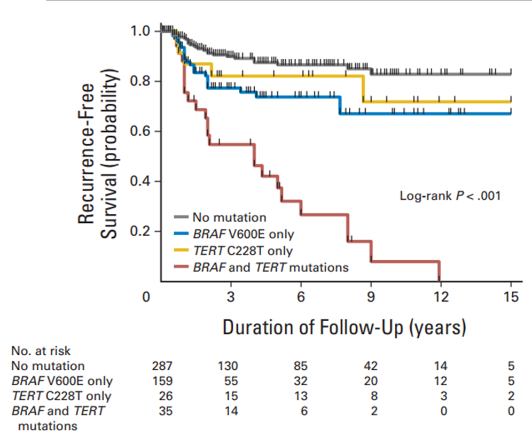
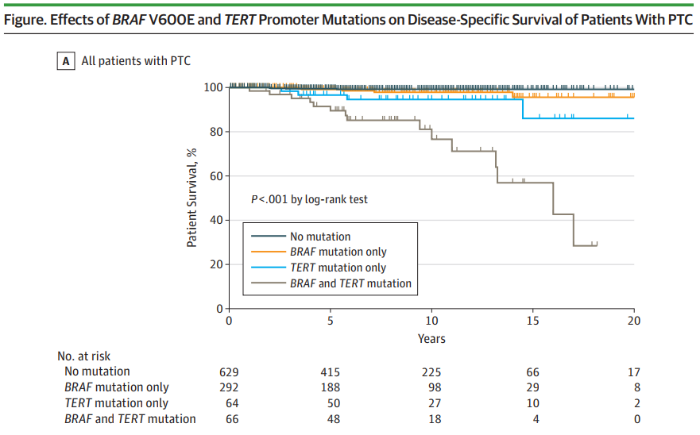
PTC患者风险排序为:BRAF+且TERT+>>>>仅BRAF+=仅TERT+> BRAF-且TERT-(“+”代表突变,“-”代表野生型)[8-9]。
03 甲状腺癌常见突变基因
◉ BRAF基因:
在甲状腺FNA细胞病理中研究的最多,PTC突变率可达80%,在亚洲人群中,BRAF突变率甚至更高,BRAF基因在FTC中较少突变,在良性结节罕见突变,因此,BRAF是PTC非常重要的肿瘤标志物[10-11],BRAF突变甲状腺结节恶性风险达到99.8%。研究显示,Bethesda I类和Ⅲ类结节中BRAF突变的病例占15%~39%[12]。BRAF突变假阳性非常低,因此,FNA细胞标本伴BRAF突变可以高度怀疑恶性结节。
◉ RAS基因:
在DTC中的突变率仅次于BRAF,在FTC 中为40%~50%,在PTC中10%~20%,在滤泡亚型乳头状甲状腺癌(follicular variant papillary thyroid carcinoma, FVPIC)中突变率最高,在带乳头状细胞核特征的非侵袭性滤泡型甲状腺肿瘤(non-invasive follicular thyroid neoplasm with papillary like nuclear features, NIFTP)突变率为20%~40%,59%伴有RAS 突变的病例为NIFTP。RAS突变在甲状腺良性结节中也有发现,因此,RAS用于甲状腺结节确定性诊断存在局限性[11,13]。
◉ RET/PTC基因重排:
在PTC中RET基因重排/融合发生率为10%~20%,在放射线诱导的PTC中发生率较高,PTC中RET基因可与多个伴侣基因发生重排/融合,其中CCDC6-RET 和NCOA4-RET是最为常见的形式。专家建议伴有RET基因重排/融合的PTC恶性程度更高,建议尽早积极外科手术治疗[14-15]。一项回顾性研究显示,RET/PTC重排对BethesdaⅢ类结节恶性诊断率为60%,无假阳性存在,提示RET/PTC重排是PTC诊断特异性非常高的标志物。此外, RET 基因胚系突变是遗传性甲状腺髓样癌(MTC)形成、发展的基础,体细胞(60%~90%)或胚系(100%)RET基因突变见于MTC,根据RET 基因突变位点的不同,MTC的恶性程度可分为最高危组、高危组和中危组,RET基因 M918T 是散发性MTC 最常见突变类型[16]。
◉ TERT基因启动子突变:
在DTC中的发生率为10%~15%,在PDTC和ATC中为40%~45%,而在良性结节中比较罕见。TERT突变会上调TERT mRNA和蛋白表达以及端粒长度,TERTC228T点突变明显多于C250T 突变。TERT启动子突变在甲状腺癌诊断、失分化与转移等方面起重要作用,特别是与BRAF突变共存时,PTC侵袭性及复发风险显著增加,因此,TERT基因是甲状腺癌诊断和侵袭性评估重要肿瘤标志物[4,10,17]。
◉ TP53基因:
含11个外显子和10个内含子,编码P53蛋白,其监控细胞周期DNA损伤、调控细胞增殖、维持细胞正常生长和抑制恶性细胞增殖。TP53 基因突变多发于5~9号外显子,在各种侵袭型较强的FVPTC中常见,如PTC柱状细胞-高细胞亚型等,在PDTC和ATC中突变更加频繁,而在正常甲状腺组织以及甲状腺滤泡腺瘤、慢性甲状腺炎等良性病变中未检出突变型P53。因此,目前认为TP53基因与甲状腺癌去分化有关,提示预后不良[4]。
本文(包括图片)仅供行业交流学习用,不作为医疗诊断依据。
参考文献
1. 甲状腺癌诊疗指南(2022年版)[J]. 中国实用外科杂志, 2022, 42(12):16.
2. Wang J , Yu F , Shang Y , et al. Thyroid cancer: incidence and mortality trends in China, 2005–2015[J]. Endocrine, 2020, 68(5).
3. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)分化型甲状腺癌诊疗指南2021[J]. 肿瘤预防与治疗, 2021(012):034.
4. 罗定远, 廖健伟. 甲状腺癌基因检测与临床应用广东专家共识(2020版)[J]. 中华普通外科学文献:电子版, 2020, 14(3):8.
5. NCCN clinical practice guidelines in oncology: thyroid carcinoma(2022.V2).
6. Bryan, R, Haugen, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: What is new and what has changed?[J]. Cancer, 2017.
7. Liu J , Liu R , Shen X , et al. The Genetic Duet of BRAF V600E and TERT Promoter Mutations Robustly Predicts Loss of Radioiodine Avidity in Recurrent Papillary Thyroid Cancer. [J]. Society of Nuclear Medicine, 2020(2).
8. Liu R , Bishop J , Zhu G , et al. Mortality Risk Stratification by Combining BRAF V600E and TERT Promoter Mutations in Papillary Thyroid Cancer: Genetic Duet of BRAF and TERT Promoter Mutations in Thyroid Cancer Mortality.[J]. Jama Oncology, 2017.
9. Xing M , Liu R , Liu X , et al. BRAF V600E and TERT Promoter Mutations Cooperatively Identify the Most Aggressive Papillary Thyroid Cancer With Highest Recurrence[J]. Journal of Clinical Oncology, 2014, 32(25):2718-2726.
10. Xing M, Haugen BR, Schlumberger M. Progress in molecularbased management of differentiated thyroid cancer[J]. Lancet, 2013, 381(9871): 1058-1069.
11. Mayson SE, Haugen BR. Molecular diagnostic evaluation of thyroid nodules[J]. Endocrinol Metab Clin North Am, 2019, 48(1): 85-97.
12. Nikiforov YE, Steward DL, Robinson-Smith TM, et al. Molecular testing for mutations in improving the fine-needle aspiration diagnosis of thyroid nodules[J]. J Clin Endocrinol Metab, 2009, 94(6): 2092-2098.
13. Ghuzlan AA, Ramos HE, Schlumberger M. Noninvasive follicular thyroid neoplasm with papillary-like nuclear features[J]. Curr Opin Endocrinol Diabetes Obes, 2017, 24(5): 377-380.
14. Santoro M , Carlomagno F . Central Role of RET in Thyroid Cancer[J]. Cold Spring Harbor Perspectives in Biology, 2013, 5(12):a009233.
15. 广东省医学教育协会甲状腺专业委员会, 广东省基层医药学会细胞病理与分子诊断专业委员会. 甲状腺癌RET基因检测与临床应用专家共识(2021版)[J]. 中华普通外科学文献(电子版), 2022, 16(01):1-8.
16. Drilon A , Hu Z I , Lai G , et al. Targeting RET-driven cancers: lessons from evolving preclinical and clinical landscapes[J]. Nature Reviews Clinical Oncology, 2017.
Liu R, Xing M. TERT promoter mutations in thyroid cancer[J]. Endocr Relat Cancer, 2016, 23: R143-R155.


