北大张宏权/战军团队《Cell Reports》:发现抑制结直肠癌细胞周期演进的新机制
时间:2023-09-01 17:01:38 热度:37.1℃ 作者:网络
2023年8月29日,来自北京大学基础医学院、北京大学国际癌症研究院的张宏权/战军研究团队在Cell Reports杂志上在线发表题为 “FRMD8 Targets both CDK4 Activation and RB Degradation to Suppress Colon Cancer Growth”的研究论文,发现了抑癌蛋白FRMD8通过调控细胞周期抑制结直肠癌进程的新分子机制和潜在的治疗靶点。

严格的细胞周期调控保证了哺乳动物细胞正常的有丝分裂,而细胞周期失调导致不受控制的细胞增殖是癌症的一大重要特征。尽管选择性抑制细胞周期蛋白依赖激酶CDK4/6的抑制剂已被批准用于晚期激素受体阳性乳腺癌的治疗,然而CDK4/6抑制剂在临床治过程中会因其非特异性作用而产生显著的副作用及长期使用的耐药问题。视网膜母细胞瘤基因(Retinoblastoma gene,Rb gene)是一种抑癌基因,编码RB蛋白。活化的RB抑制细胞周期,对于CDK4/6抑制剂治疗的敏感性至关重要,Rb1基因的改变和RB的丢失会使癌细胞对CDK4/6抑制剂产生耐药性。FRMD8(含FERM结构域蛋白8)是一个新发现的含FERM结构域蛋白,尽管有研究报道FRMD8参与炎症和生长因子信号通路的调控,但是FRMD8在肿瘤中的生物学功能及作用的分子机制仍是未知的。
该团队研究发现FRMD8是一个新的结直肠癌抑癌分子。FRMD8通过抑制CDK4的激活同时阻止RB蛋白的降解,以双重抑制机制阻止结直肠癌细胞周期的快速进展。这项研究对阐明结直肠癌发生发展的规律及克服CDK4/6抑制剂在结直肠癌治疗中的耐药性具有重要的意义。
该团队发现FRMD8与CDK7、CDK4均直接相互作用并抑制CDK4在T172位点的磷酸化。FRMD8通过阻止CDK7与CDK4之间的相互作用,抑制CDK7对CDK4的激活。有趣的是,抑癌蛋白RB作为CDK4的底物,不仅磷酸化的比例被下调,总蛋白的水平也被FRMD8上调。研究人员进一步发现FRMD8与RB的E3泛素连接酶MDM2竞争性结合RB,干扰MDM2与RB的结合,从而破坏MDM2介导的RB经泛素-蛋白酶体途径降解的过程,使得RB半衰期延长、稳定性增加。
此外,GST pull-down实验证实FRMD8通过其分子中保守的259LKCHE263基序与RB直接相互作用,而由FRMD8高度保守的含有LKCHE基序的20个氨基酸残基构成的多肽同样可抑制MDM2与RB结合并上调RB表达,展现出潜在的临床应用价值。
为了探究FRMD8在肿瘤细胞增殖方面的作用,该研究团队通过一系列体内体外实验证实FRMD8阻滞细胞周期进展,抑制结直肠癌细胞增殖。动物实验结果表明小鼠肠上皮细胞中Frmd8基因的缺失会促进氧化偶氮甲烷(Azoxymethane,AOM)/葡聚糖硫酸钠(Dextran sodium sulfate,DSS)诱导的结直肠癌发生。最后,研究人员发现在结直肠癌患者肿瘤组织中FRMD8的表达要明显低于正常组织,而这是由于FRMD8启动子高甲基化所致,更为重要的是FRMD8的低表达预示着结直肠癌患者的不良预后。
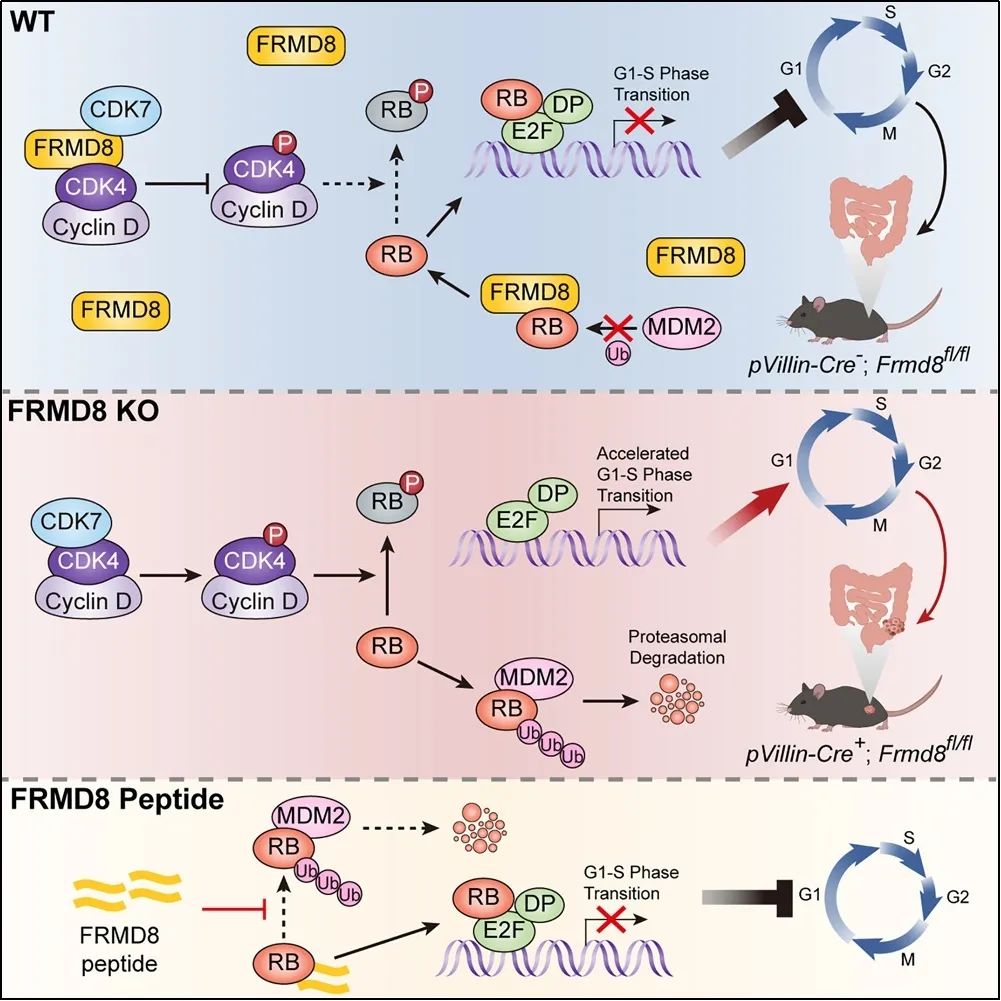
该研究揭示出FRMD8是一个新的结直肠癌抑癌分子,并且是一个潜在的结直肠癌预后标志物。FRMD8通过抑制CDK4激活和稳定RB的双重机制限制了细胞周期的过度进展,发挥对细胞周期的“刹车”作用。FRMD8稳定RB的多肽一方面可以与CDK4/6抑制剂协同作用,增强其抑制肿瘤生长的作用,另一方面可能会有助于克服肿瘤细胞对CDK4/6抑制剂的耐药性,为开发新的结直肠癌治疗药物提供了新的思路。
北京大学基础医学院博士研究生于淼为本文的第一作者,北京大学基础医学院、北京大学国际癌症研究院张宏权教授和战军副教授为论文的通讯作者。研究中得到北京大学基础医学院杜晓娟教授和张晓伟教授的帮助。该研究受国家自然科学基金重点和面上项目及科技部重点基础研究项目的资助。
原文链接:
https://doi.org/10.1016/j.celrep.2023.112886


